以ITS为主要成分的无血清培养基对软骨细胞增殖和表型的影响
刘瑾春 康 宁 肖 苒 刘霞 曹谊林
·论著·
以ITS为主要成分的无血清培养基对软骨细胞增殖和表型的影响
刘瑾春 康 宁 肖 苒 刘霞 曹谊林
目的观察以ITS为主要成分的无血清培养基对软骨细胞增殖和表型的影响。方法培养猪耳软骨细胞,分为无血清组和含血清组,无血清组应用包含胰岛素铁硒传递蛋白(ITS)、地塞米松及维生素C为主要成分的无血清培养基;含血清组应用包含10%血清的常规培养基。观察平面和三维培养状态下无血清培养基对软骨细胞增殖、基质分泌和软骨表型维持的作用。结果平面培养条件下,无血清组的细胞增殖率出现下调,细胞表型不能维持。在三维培养情况下无血清组可以保持软骨细胞存活和软骨细胞的表型,Ⅱ型胶原和蛋白多糖组织学染色结果与含血清组无明显差异,软骨特异基因ColⅡ、Aggrecan的表达与含血清组无明显差异,并能够形成较好的软骨样组织。结论以ITS、地塞米松及维生素C为主要成分的无血清培养基,在三维培养条件下能基本保持软骨细胞的存活和表型,可用于软骨细胞的体外三维培养。
无血清培养基胰岛素铁硒传递蛋白组织工程软骨表型
目前体外单层或者三维培养软骨细胞最常用的培养基为DMEM或F12培养基,同时添加10%的胎牛血清(FBS),血清在体外培养细胞中的主要作用是提供细胞增殖所必需的生长因子,以促进细胞的生长和增殖[1]。但是不同批号血清很难保证实验条件的一致性,必然对实验数据的精度和可靠性产生一定影响[2];从临床应用的角度,体外细胞培养过程中动物血清成分会引起不必要的免疫反应;同时由于血清的成分十分复杂,在对细胞产物进行分析或提纯时必然受到血清成分的干扰[3]。而应用无血清培养基,具有降低成本、避免血清潜在因素的影响、提高实验结果的可重复性及降低污染率等优点[4]。
胰岛素在软骨组织的发生和发育过程中发挥着重要的调控作用,缺乏胰岛素会导致严重的软骨发育异常。胰岛素可以在三维培养的情况下促进软骨细胞生存并保持软骨表型[5]。胰岛素铁硒传递蛋白(Insulin-Transferrin-Selenium,ITS)是胰岛素、转铁蛋白和硒的混合物[3]。ITS已经被应用于组织工程软骨的构建、软骨细胞的扩增和再分化[6-7]。糖皮质激素和维生素C在软骨组织的发生和发育过程中发挥着重要的调控作用。糖皮质激素可以增加软骨细胞的生存率,抑制软骨细胞肥大,有利于软骨细胞表型的维持[8]。维生素C能够促进软骨细胞增殖,保持软骨细胞的特性和表型[9]。以ITS、地塞米松和维生素C为主要成分的无血清培养基能否促进软骨细胞增殖、分泌细胞外基质和保持软骨细胞表型,最终形成良好的组织工程软骨,值得进一步研究。
1 材料与方法
1.1 实验材料与仪器
DMEM培养液、青霉素、链霉素(Gibco,USA);10%胎牛血清FBS(Hyclone,USA);胶原酶NB4、0.25%胰蛋白酶(Sigma,USA);Ⅱ型胶原单克隆抗体、二步法免疫组化检测试剂盒(北京中杉金桥生物技术有限公司);胰岛素铁硒传递蛋白ITS(北京迈晨科技有限公司);反转录酶(Promega,USA)。
恒温CO2培养箱(Thermo,USA);超净工作台(上海博迅实验器材公司);倒置相差显微镜(Nikon ECLIPSE TS100,Japan);高速恒温冷冻离心机(Hitachi,Japan);PCR仪(Bio-RAD,USA);电泳仪(DYY-7C型,北京六一仪器厂);凝胶成像分析仪(Biospectrun AC,USA)。
1.2 软骨细胞平面培养和检测
1.2.1 软骨细胞分离和培养
无菌取猪耳软骨,切成0.3 cm×0.3 cm×0.1 cm大小,PBS冲洗3遍,0.25%胰蛋白酶预消化30min,以0.15%的Ⅳ型胶原酶消化8~12 h,过滤、离心、洗涤、计数。以含10%FBS的DMEM培养液重悬,按2.0×104cells/cm2的密度接种于培养皿,于37℃、5% CO2、100%饱和湿度条件下培养。48 h后首次换液,待细胞生长近80%汇合后,以0.25%胰蛋白酶+ 0.02%EDTA消化收集,常规传代至第2代后以2.0×104cells/mL密度接种于96孔板(100μL/孔)和6孔板培养皿(4 mL)中,置37℃、5%CO2恒温箱内培养。
1.2.2 软骨细胞爬片和HE染色
第二代软骨细胞根据培养基的不同分为含血清组和无血清组。含血清组pellets进行常规培养,培养基包括低糖DMEM培养液、1%青霉素和链霉素、10%FBS;无血清组培养基包括低糖DMEM培养液、1%胰岛素铁硒传递蛋白(ITS)、100μg/m L丙酮酸钠、50μg/m L维生素C、40μg/m L脯氨酸、10-7 M地塞米松、1%青霉素和链霉素。制备无菌玻璃细胞爬片,置于培养皿底部,软骨细胞以2.0×104cells/cm2的密度接种于培养皿,分别在两组软骨细胞培养液中培养,细胞达到80%融合后行细胞爬片,4%多聚甲醛固定30min,行HE染色。
1.2.3 测量MTT生长曲线
第二代软骨细胞按照上述培养条件分为无血清组和含血清组,接种于96孔板内,每孔内细胞数为2 000个。细胞增殖情况通过MTT法来评估[10]。在第1~7 d的同一个时间点,每孔加入100μL MTT溶液(5 mg/m L,pH 7.4,PBS液溶解),培养4 h弃去培养液,每孔加1m L DMSO,在摇床上裂解10min,于490 nm波长处测定裂解液的光吸收值。每个时间点每组取6个平行样本进行统计。
1.2.4 RT-PCR检测软骨细胞表型
Trizol法提取细胞总RNA,调整RNA浓度为1μg/μL,-80℃保存。
逆转录反应体系(共20μL)和反应程序:10mM dNTP 1μL、Oligod T 1μL、RNA 500 ng及ddH2O共11μL,65℃,5min;5×buffer 4μL、DDT 2μL,37℃,2 min;M-MLV 1μL,37℃,1 h;70℃,15min。
聚合酶链式反应(PCR)引物均由北京赛百盛公司合成,检测ColⅡ、Aggrecan及18S的基因表达(表1)。未表明出处的引物序列为引物设计软件Gene Runner(version 3.05)设计,序列的特异性通过National Center for Biotechnology Information(NCBI)在线工具BLAST进行验证。
PCR反应体系:ddH2O 17.4μL、Tag-mix 10μL、上游引物0.8μL、下游引物0.8μL、cDNA 1μL。PCR反应程序:94℃1 min,94℃30 sec,退火温度30 sec,7 2℃30 sec,重复35个循环,最后72℃延伸5 min。PCR产物在含有0.1 mg/mL溴化乙锭的1.5%琼脂糖凝胶中电泳,凝胶成像系统显像。
1.3 软骨细胞三维培养和检测
1.3.1 软骨细胞聚集体(pellets)的形成
取第二代软骨细胞制成5×105cells/m L细胞悬液,将1 m L细胞悬液加入15 m L离心管内用于制成一个pellet,600 g离心5 min。细胞在离心管底部形成细胞聚集体(5×105cells),拧松15m L离心管盖,置37℃、5%CO2恒温箱内培养。P2聚集体(pellets)根据培养基的不同分为含血清组和无血清组,分组方法同前。3 d后首次换液,培养2周。每组重复4个。
1.3.2 组织学和免疫组织化学检测
取材后将标本放入4%多聚甲醛中固定24 h,经脱水、石蜡包埋后切成5μm厚切片,进行HE染色、番红O染色和甲苯胺蓝染色,观察细胞外基质中糖胺多糖(Glycosaminoglycan,GAG)的分泌情况。免疫组化染色:3%过氧化氢溶液室温下放置10 min阻断内源性酶,PBS冲洗,0.4%胃蛋白酶37℃消化30min,PBS冲洗,加入1∶100的鼠抗Ⅱ型胶原单克隆抗体,4℃过夜,37℃复温1 h,PBS冲洗,加入羊抗鼠二抗,37℃下静置40 min,应用DAB显色试剂盒显色4~6min,苏木素2min衬染。
1.3.3 RT-PCR检测软骨细胞表型
Trizol法提取总RNA,检测ColⅡ、ColⅩ、Sox 9、Aggrecan、ColⅨ及18S的基因表达(表1),方法同前。

表1 引物序列Table1 Primer sequence
1.4 统计学分析
定量指标均以(均数±标准差)表示,所测数据采用方差分析(ANOVN)进行统计分析,P<0.05为具有显著性差异,统计软件包为SPSS 16.0。
2 结果
2.1 软骨细胞平面培养时MTT曲线及HE染色观察细胞活力和增殖能力
MTT比色法显示含血清组软骨细胞细胞数量整体呈升高趋势,培养第5天进入平台期;无血清组整体细胞数量没有明显的增加(图1)。两组软骨细胞均在培养30 min后大量贴壁,9 h后基本全部贴壁。培养3 d后细胞爬片显示含血清组的细胞覆盖面积较无血清组稍大,两组细胞形态相似(图2)。
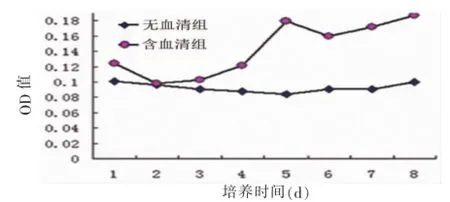
图1 平面培养时两组软骨细胞的MTT生长曲线Fig.1 M TT assay of chondrocytes in serum-containing group and serum-free group under monolayer cu lture
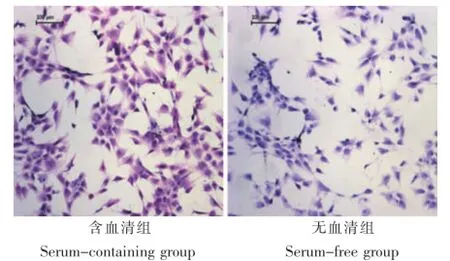
图2 平面培养时软骨细胞组织学观察(标尺:100μm)Fig.2 Histologicalobservation of chondrocytes unde r m onolayer cultu re(Scale:100μm)
2.2 软骨细胞平面培养时软骨特异基因的表达
前3天两组的表达水平及趋势相似,在第7天无血清组Aggrecan和ColⅡ的表达减弱,而含血清组则随着培养时间的延长,Aggrecan和ColⅡ的表达逐渐增强(图3)。
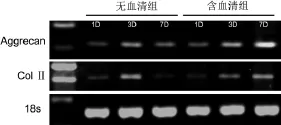
图3 平面培养时两组软骨细胞Aggrecan和ColⅡ表达比较Fig.3 Exp ression of Aggrecan and ColⅡin serumcontaining group and serum-free group under m onolayer culture
2.3 软骨细胞pellets大体观察和湿质量比较
培养2周时无血清组和含血清组的软骨细胞pellets均随培养时间的延长体积逐渐增大,外观瓷白色、半透明且有弹性。无血清组软骨细胞pellets的体积、湿质量明显大于含血清组,但是组织厚度低于含血清组(P<0.05)(图4)。
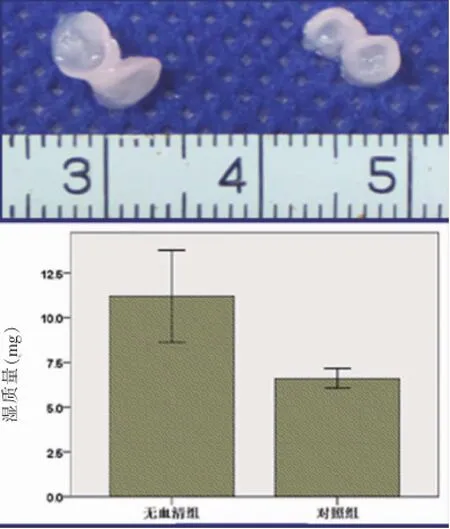
图4 体外培养2周时两组软骨细胞pellets大体观和湿质量比较Fig.4 Gross view and wetweightof the chondrocyte pellets in serum-containing group and serum-free group 2 weeks after culture
2.4 软骨细胞pellets HE、甲苯胺蓝和Ⅱ型胶原免疫组化染色
HE染色可见两组均有陷窝样结构形成,甲苯胺蓝、番红O染色和Ⅱ型胶原染色结果显示,无血清组和含血清组无明显差异(图5)。
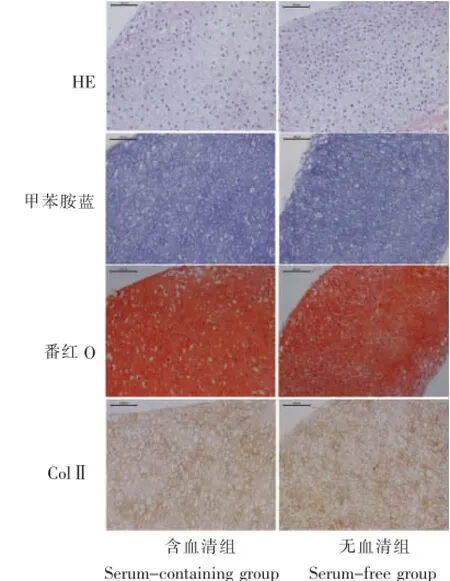
图5 体外培养2周,软骨细胞pellets组织学和免疫组化染色结果(标尺:100μm)Fig.5 Histological and immunohistochem ical observation of the chondrocyte pellets 2weeksafter culture(Scale:100μm)
2.5 无血清组和含血清组软骨细胞pellets基因的表达比较
PCR结果显示,无血清组和含血清组ColⅡ、ColⅨ、ColⅩ、Aggrecan、Sox9和18S的表达均无明显差异,其中标志细胞肥大的ColⅩ均没有表达。结果提示,软骨细胞在无血清培养条件下软骨特异基因的表达并未减少(图6)。
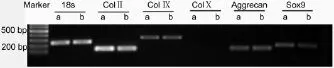
图6 体外培养2周时两组软骨特异基因的表达Fig.6 The expression of specific genes of the chondrocyte pellets in serum-containing group and serum-free group 2 weeks after culture
3 讨论
自体软骨细胞是目前软骨缺损治疗及软骨组织工程最常用的种子细胞,但其数量有限,需经体外扩增才能获得足量有功能的软骨细胞用于软骨组织的修复或重建[12]。现有的扩增方法都是添加血清的单层培养,但是由于血清的成分十分复杂,在对细胞产物进行分析或者提纯时必然受到血清成分的干扰;同时不同批号血清的质量难以保持一致,所以无血清培养基用于软骨细胞的培养势在必行。研究显示添加特异生长因子的无血清培养基在细胞增殖能力和细胞表达特异细胞外基质方面与含血清培养效果相似[13-14],如无血清培养基中添加高密度脂蛋白、转铁蛋白、成纤维生长因子、氢化可的松和表皮生长因子,可以显著促进原代软骨细胞增殖[15]。
本实验应用以ITS为主要成分,包括维生素C、地塞米松的无血清培养基,摒弃了常用的TGF-β1和IGF-1,与含血清培养基进行了比较。我们希望的无血清培养基应该满足以下3方面的要求:①应该能在三维培养的条件下保证软骨细胞的存活;②能保持软骨细胞的表型和分泌软骨细胞特异的细胞外基质;③在培养组织工程化软骨时,能达到普通培养基的效果。研究显示,兔关节软骨细胞不能在未添加细胞因子和生长激素的F-12培养基中生存,1周内细胞全部死亡[16],而本实验培养基中添加胰岛素铁硒传递蛋白(ITS)、地塞米松以及维生素C,虽然在平面培养的条件下不能促进软骨细胞的增殖,但是尚能维持软骨细胞体外生存1周。在含血清组,两种最重要细胞外基质蛋白蛋白多糖(Aggrecan)和Ⅱ型胶原(ColⅡ)的表达在1周的培养时间内逐渐增强,而无血清组的表达则在培养第7天时明显减弱,提示包含ITS、维生素C和地塞米松的无血清培养基方案在单层培养的条件下只能短期保持软骨细胞的表型。
应用包含ITS、维生素C和地塞米松的无血清培养基方案三维培养软骨细胞pellets时,软骨细胞聚集体在大体、湿重方面无血清组甚至优于常规含10%血清的对照组;在软骨特异细胞外基质Aggrecan和ColⅡ的染色方面两组无明显差异;在软骨特异基因ColⅡ、ColⅨ、ColⅩ、Aggrecan、Sox9和18S的表达方面两组结果也无明显差异。提示在三维培养的条件下,以ITS、地塞米松和维生素C为主要成分的无血清培养基可以保持软骨细胞的表型、促进软骨细胞分泌特异细胞外基质,培养组织工程化软骨时能达到普通培养基的效果。
对软骨细胞的生物学研究是软骨组织工程中重要的基础课题,在软骨组织工程研究中应用无血清培养基势在必行,本研究结果对于应用无血清培养基培养软骨细胞的研究具有重要意义。
[1]ChoiYC,MorrisGM,Lee FS,etal.Theeffectof serum onmonolayer cell culture of mammalian articular chondrocytes[J].Connect Tissue Res,1980,7(2):105-112.
[2]付百年,赵睿,王智宇.无血清培养基与含血清培养基培养CHO细胞的比较[J].中国生物制品学杂志,2004,17(3):158-160.
[3]Kisiday JD,Kurz B,DiMicco MA,et al.Evaluation of medium supp lemented with insulin-transferrin-selenium for culture of primary bovine calf chondrocytes in three-dimensional hydrogel scaffolds[J].Tissue Eng,2005,11(1-2):141-151.
[4]Kamil SH,Kojima K,VacantiMP,etal.Tissue engineered cartilage: utilization ofautologous serum and serum-freemedia for chondrocyte culture[J].Int JPediatr Otorhinolaryngol,2007,71(1):71-75.
[5]Bohme K,Conscience-Egli M,Tschan T,etal.Induction of proliferation or hypertrophy of chondrocytes in serum-free culture: the role of insulin-like growth factor-I,insulin,or thyroxine[J].J Cell Biol,1992,116(4):1035-1042.
[6]Mandl EW,van der Veen SW,Verhaar JA,etal.Serum-freemedium supplemented with high-concentration FGF2 for cell expansion culture of human ear chondrocytes promotes redifferentiation capacity[J].Tissue Eng,2002,8(4):573-580.
[7]Chua KH,Aminuddin BS,Fuzina NH,etal.Insulin-transferrinselenium preventhuman chondrocyte dedifferentiation and promote the formation of high quality tissue engineered human hyaline cartilage[J].Eur Cell Mater,2005,9:58-67.
[8]QuartoR,CampanileG,CanceddaR,etal.Thyroid hormone,insulin, and glucocorticoidsaresufficient tosupportchondrocytedifferentiation to hypertrophy:a serum-free analysis[J].JCell Biol,1992,119(4): 989-995.
[9]Kim G,OkumuraM,BosnakovskiD,etal.Effects of ascorbic acid on proliferation and biological properties of bovine chondrocytes in alginate beads[J].Jpn JVet Res,2003,51(2):83-94.
[10]Ibold Y,Lübke C,Pelz S,et al.Effect of different ascorbate supplementations on in vitro cartilage formation in porcinehigh-density pellet cultures[J].Tissue Cell,2009,41(4):249-256.
[11]JefferiesD,Farquharson C,Thomson J,etal.Differences inmetabolic parameters and gene expression related to osteochondrosis/ osteoarthrosis in pigs fed 25-hydroxyvitamin D3[J].Vet Res,2002, 33(4):383-396.
[12]Risbud MV,Sittinger M.Tissue engineering:advances in vitro cartilage generation[J].Trends Biotechnol,2002,20(8):351-356.
[13]Malpeli M,Randazzo N,Cancedda R,et al.Serum-free growth medium sustains commitment of human articular chondrocyte through maintenance of Sox9 expression[J].Tissue Eng,2004,10 (1-2):145-155.
[14]Kamil SH,Kojima K,VacantiMP,etal.Tissue engineered cartilage: utilization ofautologousserum and serum-freemedia for chondrocyte culture[J].Int JPediatr Otorhinolaryngol,2007,71(1):71-75.
[15]Kato Y,Gospodarowicz D.Growth requirements of low-density rabbitcostal chondrocyte culturesmaintained in serum-freemedium [J].JCell Physiol,1984,120(3):354-363.
[16]胡翰生,王静成,蒋百川,等.无血清培养兔关节软骨细胞的初步研究[J].实用临床医药杂志,2008,12(3):92-93.
Effects of Serum-free Culture M edium Containing ITS on Chondrocytes Proliferation and Phenotype
LIU Jinchun1,2,KANG Ning1,XIAO Ran1,LIU Xia1,CAO Yilin1.
1 Plastic Surgery Hospital,Chinese Academy of Medical Science, Beijing 100144,China;2 Medical Lab of Tissue Regeneration,Xinxiang Medical College,Henan 453003,China. Corresponding author:LIU Xia(E-mail:lacey2003@163.com);CAO Yilin(E-mail:yilincao@yahoo.com)
Objective To investigate the effects of serum-free culturemedium containing Insulin-Transferrin-Selenium on chondrocytes proliferation and phenotype.Methods P2 Chondrocytes were cultured in monolayer or in 3-D pellets in DMEM with 10%FBS(serum-containing group)and DMEM with 1%ITS,10-7 M Dexamethasone,50μg/m L Vitamin C (serum-free group).Chondrocytes proliferation,matrix secretion and gene expression were tested by MTT assay,histological staining,immunohistochemistry and semi-quantitative gene expression analysis.Results Serum-free culturemedium could not promote chondrocytes proliferation and phenotype of chondrocytes could be maintained for only 3 days in monolayer culture.In 3-D culture,the histological,immunohistochemical results and expression of cartilage-specific genes were comparable between serum-containing group and serum-free group.Conclusion Serum-free culturemedium could promote cartilage formation and maintain phenotype of chondrocytes in 3-D culture.Serum-free culture medium can be used for differential proteomics analysis and protein assay analysis.
Serum-freemedium;Insulin-Transferrin-Selenium;Tissue engineering;Chondrocytes phenotype
Q813.1+1
A
1673-0364(2012)03-0121-05
2012年3月23日;
2012年5月12日)
10.3969/j.issn.1673-0364.2012.03.001
国家自然科学基金青年科学基金(30801192);北京市自然科学基金(7102134);高等学校博士学科点专项科研基金(新教师基金课题,200800231078);卫生部临床学科重点项目;北京市科委重大计划项目(D090800046609003)。
100144北京市中国医学科学院整形外科医院研究中心(刘瑾春,康宁,肖苒,刘霞,曹谊林);453003河南省新乡市新乡医学院河南省医用组织再生重点实验室(刘瑾春)。
刘霞(E-mail:lacey2003@163.com);曹谊林(E-mail:yilincao@yahoo.com)。

