松质骨基质复合生物蛋白胶构建组织工程软骨的研究
王正辉 常会敏 吴宝俊 杨壮群 KamalMustafa 卢晓云
松质骨基质复合生物蛋白胶构建组织工程软骨的研究
王正辉 常会敏 吴宝俊 杨壮群 KamalMustafa 卢晓云
目的尝试采用松质骨基质与生物蛋白胶复合材料构建组织工程软骨。方法体外培养大鼠软骨细胞,接种于松质骨基质/生物蛋白胶材料上行体外培养。采用HE、甲苯胺蓝染色免疫学检测、扫描电镜观察等方法观察所构建的组织工程软骨的特性。结果松质骨基质/生物蛋白胶组的组织学结构更接近于软骨样组织,其Ⅱ型胶原、蛋白多糖基因表达量及蛋白多糖含量明显高于松质骨基质组。结论松质骨基质/生物蛋白胶复合材料可用于构建组织工程软骨,是一种较理想的支架材料。
软骨细胞组织工程生物蛋白胶支架材料
先天性畸形或后天获得性疾病导致的软骨组织缺损,如耳、鼻、气管的缺损或畸形等,严重影响患者的颜面外观或器官功能。软骨是一种无血管的组织,自身修复能力有限。随着组织工程学的发展,组织工程软骨的构建为修复软骨缺损开辟了一条新途径。
在组织工程软骨的构建中,大量生长状态良好的软骨细胞以及合适支架材料起着十分关键的作用。近年的研究表明,多种生物材料均可用于组织工程软骨的构建,各种材料均有各自的优势和缺点。松质骨基质(BMG)是具有良好的组织亲和性和结合力的天然生物材料。但是,单纯的松质骨基质对软骨细胞的吸附力并不强,软骨细胞不易附着,而且松质骨基质支架的孔隙大小不等,孔径相对较大,软骨细胞易丢失,不易形成软骨组织。因此,本研究尝试将BMG与生物蛋白胶复合,用于构建组织工程软骨。
1 材料与方法
1.1 主要试剂与仪器
高糖DMEM培养基、胰蛋白酶(Gibco公司);透明质酸酶、Ⅱ型胶原酶(Sigma公司);胎牛血清(Invitrogen公司);Ⅱ型胶原一抗(小鼠抗大鼠,Neomarker公司);Aggrecan单克隆抗体(羊抗大鼠,Santa Cruz公司);壳聚糖/明胶(天津中医药大学);BMG(第四军医大学骨科);生物蛋白胶(广州倍绣生物技术有限公司);Real-time PCR mix(Toyoboco公司);CO2培养箱(Thermo公司);荧光显微镜(Nikon公司)。
1.2 实验方法
1.2.1 SD大鼠肋软骨细胞的培养[1]
SD大鼠颈椎脱臼法处死,无菌操作台中取其肋软骨组织,剥离软骨膜,用眼科剪剪至1mm3左右的组织块。采用三步法消化,获得软骨细胞,置于37℃、5%CO2恒温培养箱中培养。传代培养采用0.25%胰蛋白酶和0.02%EDTA(比例为1∶1)进行消化,25 cm2培养瓶接种,接种密度为1×105cells/mL。本实验所采用的是第2代肋软骨细胞,分别接种于松质骨基质/生物蛋白胶材料(BMG/生物蛋白胶组)与松质骨基质材料(BMG组)上进行体外培养。
1.2.2 BMG/生物蛋白胶-软骨细胞复合物的构建
将松质骨基质浸泡于DMEM培养液中5 min后取出,用灭菌滤纸吸干附在松质骨基质表面和网眼内的水分,浸泡凝血酶后晾干。将纤维蛋白原主体胶与第1代软骨细胞混合,制成1×107cells/mL的细胞悬液,向材料上滴入纤维蛋白原细胞悬液50μL,加入DMEM培养液200μL,置于培养箱内10min。将软骨模块全部移至24孔培养板中,加入2mL含20%胎牛血清的高糖DMEM培养液,置于5%CO2恒温箱内培养,每天半量更换培养液,共培养8周。
1.2.3 组织学观察
培养1周时取出组织块,4%多聚甲醛固定,常规制作切片,行HE、甲苯胺蓝染色,光镜观察。
1.2.4 免疫学检测[2]
培养6周的组织块以4%多聚甲醛固定,Triton室温下浸泡25min,0.01M PBS洗3次,每次5min;滴加1滴3%H2O2,消除内源性过氧化物酶活性。0.01M PBS洗涤3次,每次3 min;滴加1滴工作用血清(试剂A),常温孵育15min,以消除非特异性染色;分别滴加(1:200)Ⅱ型胶原(CollagenⅡ)单克隆抗体50μL,4℃冰箱过夜(>18 h);加入用免疫荧光染色二抗稀释液稀释荧光标记的二抗,培养箱内,孵育15 min;0.01 M PBS洗3次,每次5 min;避光,荧光显微镜观察。
1.2.5 扫描电镜观察
培养2、4周的标本各1块,2.5%戊二醛固定,梯度乙醇脱水,干燥,扫描电镜观察支架材料表面软骨细胞的黏附和细胞的形态、结构。
1.2.6 Real-time PCR检测CollagenⅡ及Agrecan mRNA含量[3]
6周时用Trizol常规提取组织块RNA,CollagenⅡ引物序列:5’-AACACTGCCAACGTCCAGAT-3’/ 3’–CTGCAGCACGGTATAGGTGA-5’;Aggrecan引物序列:5’-GAGGTCGTGGTGAAAGGTGT-3’/3’–GTGTGGATGGGGTACCTGAC-5’;内参GAPDH序列:5’-AAATGGTGAAGGTCGGTGT G-3’/3’–GGTAGTTGCTGGGGAAGT-5’。具体操作根据试剂盒说明进行。
1.2.7 生物化学分析
6周时检测构建的组织工程软骨的GAG和羟脯氨酸的含量,以分别验证A ggrecan和C ollagenⅡ的含量。采用Hoechst 33258染色法进行测量,以硫酸软骨素制作标准曲线,二亚基亚甲蓝分光比色法检测GAG。采用L-羟脯氨酸制作标准曲线检测羟脯氨酸的含量[4]。所有检测均重复3次。
2 实验结果
2.1 组织学观察
构建的组织工程软骨1周时HE染色显示,软骨细胞位于一个筛网结构中,彼此之间被相邻的细胞胞外基质分开。BMG/生物蛋白胶组较BMG组表现出更好的软骨样组织特征。在BMG/生物蛋白胶组细胞外周和区间基质被甲苯胺蓝染色深蓝色证实了蛋白多糖的存在,而在BMG组甲苯胺蓝染色呈淡蓝色(图1)。
2.2 免疫学和SEM观察
6周时,Ⅱ型胶原免疫染色显示,BMG/生物蛋白胶组中基质强染,而BMG组只有较浅的着色。电镜观察显示,在BMG/生物蛋白胶组可观察到筛网内密集的或者单个的软骨细胞,细胞周围有大量的基质。而BMG组只能观察到少量的软骨细胞(图2)。
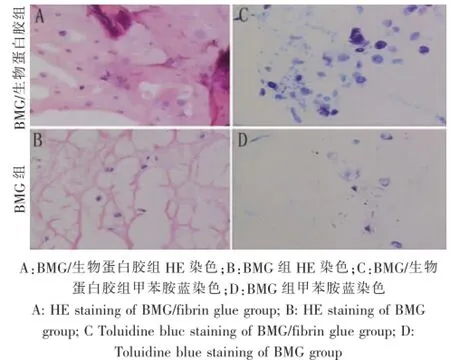
图1 BMG/生物蛋白胶组与BMG组组织学观察(100×,光镜)Fig1 The histological observation of tissue in BMG/fibrin glue group and BMG group(100×,lightm icroscope)
2.3 生化分析和Real time PCR检测
Real time PCR检测显示,BMG/生物蛋白胶组和BMG两组的Ⅱ型胶原基因表达没有显著差异(P>0.05);而蛋白多糖的基因表达发现,BMG/生物蛋白胶组明显高于BMG组(P<0.05)。BMG/生物蛋白胶复合体和BMG组中mRNA的表达证实这两种支架材料都具有维持软骨细胞表型的能力(图3)。生化分析结果显示,与BMG组相比,BMG/生物蛋白胶组糖胺多糖、羟脯氨酸的水平显著增加(P<0.05),BMG组的羟脯氨酸含量只有BMG/生物蛋白胶组的36.5%(图4)。
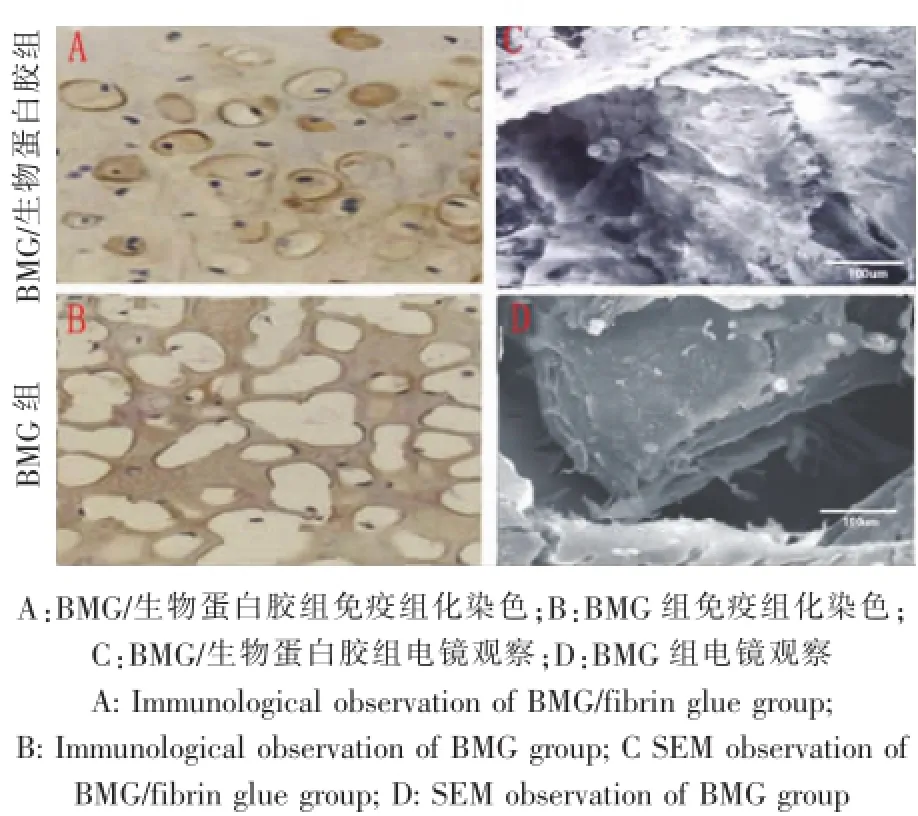
图2 BMG/生物蛋白胶组与BMG组免疫组化染色(100×,荧光显微镜)和电镜观察(标尺:100μm)Fig2 The imm unological observation(100×,fluorescence m icroscope)and SEM observation(Scale:100μm)of tissue in BMG/fibrin glue group and BMG group
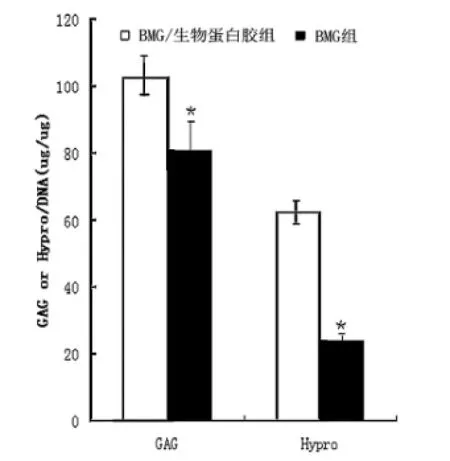
图3 BMG/生物蛋白胶组与BMG组C olⅡ、A ggrecan基因表达量Fig.3 The expression of collagen II and aggrecan in BMG/fibrin glue group and BMG group
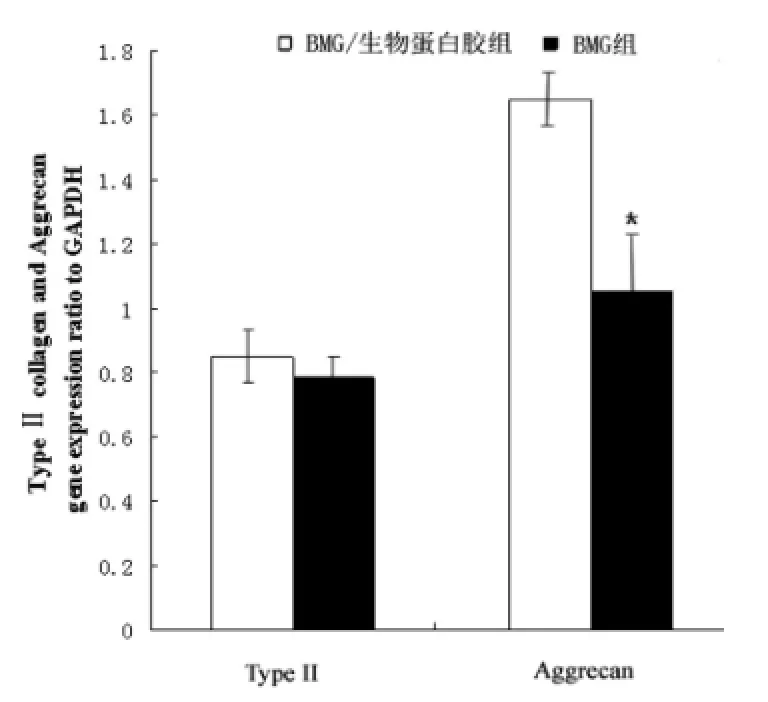
图4 BMG/生物蛋白胶组与BMG组糖胺多糖和羟脯氨酸含量Fig.4 The glycosam inoglycan and hydroxyproline content in BMG/fibrin glue group and BMG group
3 讨论
BMG是骨组织经过脱钙、去脂、去蛋白等处理,去掉了除BMP以外95%非胶原蛋白和有阻滞作用的脂质成分,降低了抗原性[5-6],同时松质骨基质还存留有少量BMP和其他促进骨软骨形成的内在生长因子。但是,单纯的BMG对软骨细胞的吸附力并不强,软骨细胞不易附着,容易丢失,不易形成软骨组织。生物蛋白胶又称为纤维蛋白封闭剂,可塑性强,生物相容性好,是组织工程软骨构建可选择的聚合物支架[7]。Lynn等[8]已经在实验中证实,兔关节软骨细胞能在人纤维蛋白凝胶中分裂增殖、合成基质并保持其表型。纤维蛋白胶存在降解速度过快的缺点[9],我们尝试将BMG/生物蛋白胶进行复合,以期能够相互弥补缺陷,更为符合组织工程软骨构建的要求。
我们发现,软骨细胞与单纯的BMG黏附性较差。软骨细胞很容易从BMG支架材料上脱落,从而影响软骨组织的形成。这种低黏附性可能是由于BMG相对较大的孔径造成的。目前研究中,解决细胞低黏附性问题的方法就是用生物蛋白胶制备BMG/生物蛋白胶凝胶支架材料。本研究结果表明,与单纯BMG材料比较,BMG/生物蛋白胶支架材料上的软骨细胞能分泌更多特定的细胞外基质成分,在软骨细胞之间形成大大小小的群集,维持了原代细胞的形态。另外,组织学证明,在BMG/生物蛋白胶上的软骨细胞细胞外基质的沉积优于BMG组,可能是由于BMG/生物蛋白胶组的细胞接种率和接种均匀性较单纯的BMG组好造成的。将生物蛋白胶复合后明显促进了高质量的软骨组织的形成[10]。
理想的适合软骨组织工程的支架材料不仅能促进软骨细胞的黏附与增殖,而且能维持软骨细胞表型。众所周知,在体外培养软骨细胞时,尤其是在培养皿或者培养瓶中的单层培养系统,软骨细胞容易去分化,从而失去分泌软骨特有细胞外基质大分子(如Ⅱ型胶原蛋白和蛋白多糖)的能力,取而代之的是分泌Ⅰ型胶原。去分化后的软骨细胞产生机械性能较差的纤维软骨[11]。本研究中,透明软骨的细胞外基质分子(Ⅱ型胶原蛋白和蛋白多糖)基因表达表明,在BMG/生物蛋白胶及BMG组都很好维持了软骨细胞的表型。具有正常表型和功能的软骨细胞中Ⅱ型胶原蛋白的含量很高、蛋白多糖的表达较高,这表明我们构建的软骨样组织,其软骨细胞表型在培养的前6周得到很好的维持,说明这两种支架材料都能支持软骨细胞的生长和软骨形成。
尽管BMG/生物蛋白胶和单纯BMG组在组织学上并没有明显的差异,两组的Ⅱ型胶原基因表达图谱也没有明显差异。但是,两组的蛋白多糖表达存在很大的不同。这种自相矛盾的检测结果,可能是应为mRNA和蛋白质分析水平的差异。
[1]王正辉,贺西京,杨壮群,等.RNA干扰aggrecanase1表达对体外培养的软骨细胞基质代谢的影响[J].南方医科大学学报,29(9): 1766-1769.
[2]王正辉,吴宝俊,Kamal Mustafa.RNA干扰技术构建组织工程软骨的实验研究[J].中国修复重建外科杂志,2012,26(1):106-111.
[3]Wang ZH,Yang ZG,He XJ,et al.Effects of RNAi-mediated inhibition ofaggrecanase-1 and aggrecanase-2 on ratcostochondral chondrocytes in vitro[J].Acta Pharmacol Sin 2008,29(10):1215-1226.
[4]Wang ZH,He XJ,Yang ZG,et al.Cartilage tissue engineering with demineralized bonematrix gelatin and fibrin glue hybrid scaffold: an in vitro study[J].Artificial Organs,2010,34(2):161-166.
[5]Iwata H,Ono S,Sato K,etal.Bonemorphogenetic protein-induced muscle-and synovium-derived cartilage differentiation in vitro [J].Clin Orthop Relat Res,1993,296:295-300.
[6]Kawcak CE,Trotter GW,Powers BE,et al.Comparison of bone healing by demineralized bonematrix and autogenous cancellous bone in horses[J].Veterinary Surg,2000,29:218-226.
[7]Munirah S,Kim SH,Ruszymah BHI,et al.The use of fibrin and poly(lactic-co-glycolic acid)hybrid scaffold for articular cartilage tissue engineering:an in vivo analysis[J].Eur Cells and Mater, 2008,15:41-52.
[8]Lynn AK,Brooks RA,Bonfield W,et al.Repair of defects in articular joints.Prospects for material-based solutions in tissue engineering[J].JBone Joint Surg Br,2004,86:1093-1099.
[9]Eyrich D,Brandl F,Appel B,et al.Long term stable fibrin gels for cartilage engineering[J].Biomaterials,2007,28:55-65.
[10]EndresM,Neumann K,Schroder SE,etal.Human polymer-based cartilage grafts for the regeneration of articular cartilage defects [J].Tissue and Cell,2007,39:293-301.
[11]TsaiWB,Chen CH,Chen JF,etal.The effectsof typesofdegradable polymers on porcine chondrocyte adhesion,proliferation and gene expression[J].JMater Sci:Mater Med,2006,17:337-343.
Construction Tissue-Engineered Cartilage Using Bone M atrix Gelatin and Biological Fibrin G lue
WANG Zhenghui1, CHANG Huim in1,WU Baojun1,YANG Zhuangqun2,Kamal Mustafa3,LU Xiaoyun4.
1 Department of Otolaryngology-Head &Neck Surgery,The Second Affiliated Hospital,Xi'an Jiaotong University,Xi'an 710004,China;2 Department of Plastic and Burns Surgery,The First A ffiliated Hospital,Xi'an Jiaotong University,Xi'an 710061,China;3 Faculty of Dentistry, University of Bergen,Norwa;4 Departmentof Biological Science and Bioengineering,School of Life Science and Technology, Xi'an Jiaotong University,Xi'an 710049,China.Corresponding author:WU Baojun(E-mail:yzhqun@mail.xjtu.edu.cn).
Objective To explore the feasibility of the construction of tissue-engineered cartilage using hybrid scaffolds of demineralized bonematrix gelatin(BMG)and fibrin glue.M ethods Rattus chondrocytes were cultured on hybrid BMG/ fibrin glue scaffolds(BMG/fibrin glue group)and BMG scaffolds(BMG group)in vitro.Engineered cartilage-like tissue grown on the scaffolds was characterized by histological observation,immunological examination,scanning electron m icroscopy, biochemical assays and analysis of gene expression.Results The presence of proteoglycan was confirmed by positive toluidine blue in BMG/fibrin glue group,compared with BMG group.Collagen type II exhibited intense immuno-positivity at the peri-cellularmatrices in BMG/fibrin glue group,compared with BMG group.The expression of collagen typeⅡhad no significant difference between BMG/fibrin glue group and BMG group(P>0.05),while the expression of aggrecan core protein in BMG/fibrin glue group was higher than that in BMG group(P<0.05).The glycosaminoglycan production and hydroxyproline content of BMG/fibrin glue group were higher than that of BMG group(P<0.05).Conclusion The fibrin/BMG hybrid scaffoldsmay serve as a potential cell delivery vehicle and a structural basis for cartilage tissue engineering.
Chondrocytes;Tissue-engineered cartilage;B iological fibrin glue;Scaffolds
Q813.1+2
A
1673-0364(2012)03-0126-04
2012年3月20日;
2012年4月14日)
10.3969/j.issn.1673-0364.2012.03.002
国家自然科学基金资助项目(81000416);中央高校基本科研业务费专项资金(西安交通大学国际合作类,交叉学科类);西安交通大学第二附属医院人才培养基金。
710004陕西省西安市西安交通大学第二附属医院耳鼻喉-头颈外科(王正辉,常会敏,吴宝俊);710061陕西省西安市西安交通大学第一附属医院整形烧伤科(杨壮群);挪威卑尔根大学牙科学院(Kamal Mustafa);710049陕西省西安市西安交通大学生命科学与技术学院(卢晓云)。
吴宝俊(E-mail:yzhqun@mail.xjtu.edu.cn)。

