食管鳞状细胞癌中血管内皮生长因子C mRNA的表达及其临床意义*
马 俊, 鲁建军, 邹健勇, 顾 勇, 钟佛添
(中山大学附属第一医院胸外科,广东广州510080)
食管癌是常见的消化道恶性肿瘤之一,在世界范围内存在着地区、种族和病理类型的差异。我国是食管癌高发国家,其中90%以上为鳞状细胞癌[1]。食管鳞状细胞癌显著的生物学特性表现为肿瘤早期往往出现淋巴结转移,肿瘤侵犯黏膜下层时即可发生广泛和跳跃性淋巴结转移。血管内皮生长因子C(vascular endothelial growth factor C,VEGF-C)是作用于淋巴上皮细胞中血管内皮生长因子受体3(vascular endothelial growth factor receptor 3,VEGFR-3)的细胞因子,VEGF-C在食管癌淋巴管形成、淋巴结侵犯和转移中起重要作用[2]。本研究通过原位杂交法检测VEGF-C mRNA在食管鳞状细胞癌组织及正常食管组织中的表达,探讨其表达的临床意义。
对象和方法
1 研究对象
标本取自中山大学附属第一医院胸外科2009年3月至2010年2月经手术切除的新鲜食管鳞状细胞癌组织以及癌旁5 cm以上正常食管组织39例,切取后立即置于液氮中暂存,然后-80℃低温冰箱中保存。所有标本均经临床及病理组织学检查确诊,患者术前未行化、放疗。其中男性34例,女性5例。年龄44~83岁,平均(59.9±9.64)岁。按2009年第7版食管癌国际分期,T2组9例,T3组30例;有淋巴结转移14例,无淋巴结转移25例。低分化13例,中高分化26例。
2 主要试剂
VEGF-C原位杂交试剂盒、原位杂交专用盖玻片及原位杂交PBS购自武汉博士德生物工程有限公司,DAB显色试剂盒购自北京康为世纪生物科技有限公司。其它生化试剂均为国产分析纯。
3 原位杂交过程
低温冰箱取出标本后马上予以固定1 h。固定液为4%多聚甲醛 +0.1 mol/L PBS(pH 7.0~7.6),含有1/1000 DEPC。常规脱水、浸蜡、包埋。切片厚度6 μm。石蜡切片经常规脱蜡至水。30%H2O21份+蒸馏水10份混合,室温10 min以灭活内源性酶,蒸馏水洗3次。切片上滴加3%柠檬酸新鲜稀释的胃蛋白酶,37℃消化10 min。原位杂交用PBS洗3次×5 min。蒸馏水洗1次。用1%多聚甲醛+0.1 mol/L PBS(pH 7.2~7.6,含有1/1 000 DEPC)室温后固定10 min。蒸馏水洗涤3次。干的杂交盒底部加20%甘油20 mL以保持湿度。按每张切片20 μL加预杂交液。恒温箱40℃ 4 h。吸取多余液体,不洗。按每张切片20 μL杂交液,加在切片上。将原位杂交专用盖玻片的保护膜揭开后,盖在切片上。恒温箱40℃杂交过夜。揭掉盖玻片,37℃左右水温的2× SSC洗涤5 min×2次;37℃ 0.5×SSC洗涤15 min;37℃0.2×SSC洗涤15 min×3次。滴加封闭液37℃ 30 min。甩去多余液体,不洗。滴加生物素化鼠抗地高辛37℃60 min。原位杂交用PBS洗5 min×4次。滴加SABC 37℃20 min。原位杂交用PBS洗5 min×3次。滴加生物素化过氧化物酶37℃20 min。原位杂交用PBS洗5 min×4次。使用DAB显色试剂盒:1 mL蒸馏水加显色剂A、B、C各1滴,混匀,加至标本上。显色20 min。充分水洗。苏木素复染,充分水洗。酒精脱水,二甲苯透明,封片。观察VEGF-C mRNA表达情况,分为阳性组和阴性组。
4 统计学处理
用SPSS 19.0统计软件进行分析并绘制生存曲线。VEGF-C mRNA阳性率的比较采用χ2检验,生存率的比较采用log-rank检验,以P<0.05为差异有统计学意义。
结果
1 食管鳞癌组织与正常食管组织VEGF-C mRNA表达情况
VEGF-C mRNA表达阳性的细胞胞浆着色呈棕黄色,见图1A,VEGF-C mRNA表达阴性的细胞胞浆无棕黄色着色,见图1B。在39例食管鳞状细胞癌组织中,28例(71.8%) VEGF-C mRNA表达阳性,正常食管组织中5例(12.8%)表达阳性。两者比较差异有统计学意义(P<0.05),见表1。

Figure 1.Results of in situ hybridization for the expression of VEGF-C mRNA.A:positive group(tumor tissue); B:negative group(non-tumor tissue).图1VEGF-C mRNA表达情况

表1 食管组织中VEGF-C mRNA表达情况Table 1 .The expression of VEGF-C mRNA in tumor tissues and non-tumor tissues(n=39)
2 食管鳞癌组织中VEGF-C mRNA表达与肿瘤浸润和淋巴结转移的关系
VEGF-C mRNA表达阳性率在T3组显著高于T2组(80.0%vs 44.4%,P<0.05),在有淋巴结转移组显著高于无淋巴结转移组(92.9%vs 60.0%,P<0.05)。而在年龄分组(70.6%vs 75.0%)、性别分组(68.4%vs 80.0%)及肿瘤分化程度分组(65.4%vs 84.6%)之间无显著差异(P>0.05),见表2。
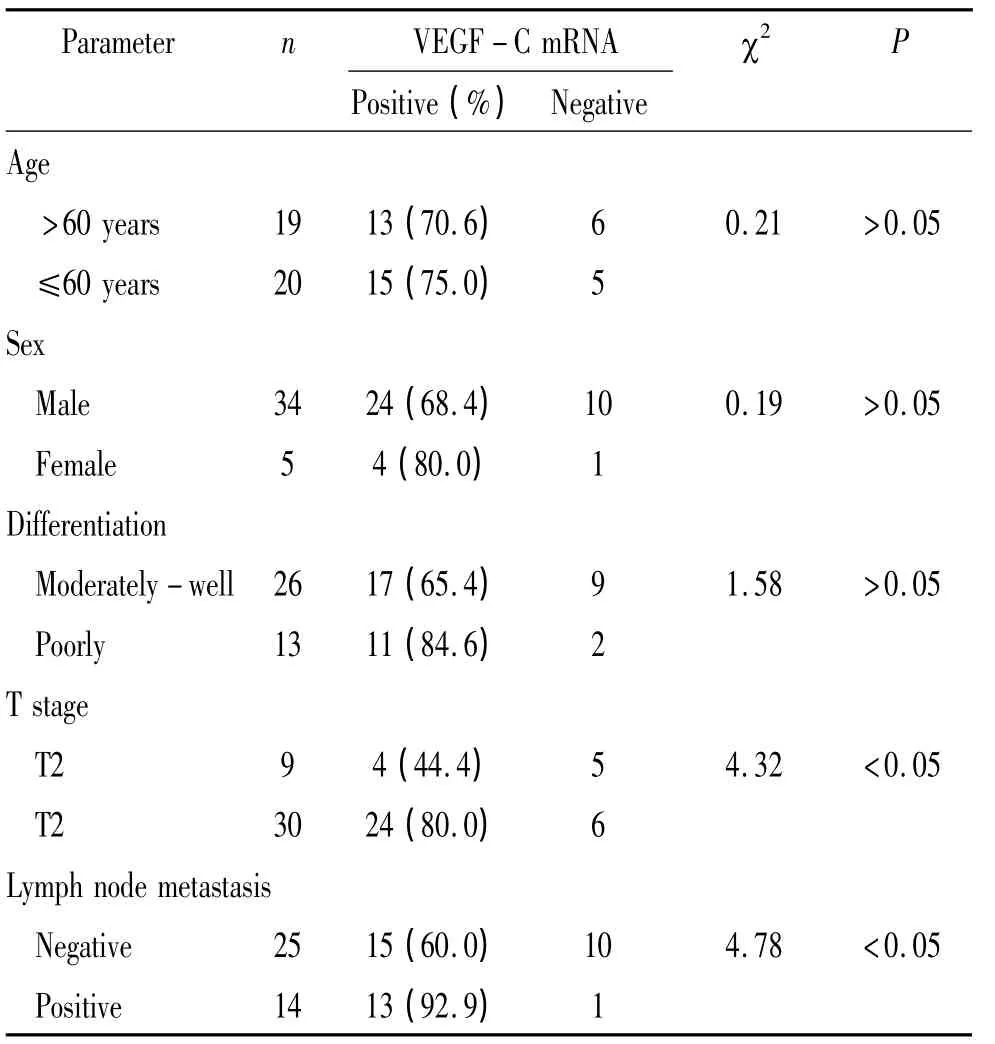
表2 肿瘤组织VEGF-C mRNA表达与临床病理参数的关系Table 2 .Relationship between clinicopathological parameters and expression of VEGF-C mRNA in tumor tissues
3 食管鳞癌组织中VEGF-C mRNA表达情况与患者预后的关系
随访至死亡或2012年2月29日(以先者为准),VEGFC mRNA表达阳性组患者生存率低于阴性组[46.4%(13/ 28)vs 81.8%(9/11),P<0.05],见图2。

Figure 2.Survival curves of the two groups.图2 两组患者的生存曲线
讨论
食管鳞状细胞癌的生长与转移依赖肿瘤相关血管、淋巴管提供养分、氧气和转移通道,其显著的生物学特性表现为肿瘤早期往往出现淋巴结转移,肿瘤侵犯黏膜下层时即可发生广泛和跳跃性淋巴结转移。肿瘤转移是一个多步骤、多阶段、多基因的复杂过程,其中肿瘤组织的血管生成及淋巴管生成是必不可少的环节。肿瘤血管、淋巴管生成受肿瘤细胞和宿主细胞产生和释放的多种血管、淋巴管生成因子和生成抑制因子共同调控。
VEGF-C是VEGF家族中的一员,是迄今为止唯一的血管、淋巴管内皮细胞刺激因子,通过其受体2(KDR)及受体3 (Flt-4)分别作用于血管和淋巴管上皮,促进肿瘤的生长和转移[3]。VEGF-C主要通过作用于VEGFR-3受体促进淋巴管内皮细胞的增殖和迁移,从而发挥淋巴管新生的作用而促进肿瘤淋巴转移[4]。Duff等[5]研究表明VEGF-C mRNA表达增加在上皮恶性肿瘤淋巴结转移、扩散中起重要作用。Isaka等[6]的研究显示过量表达VEGF-C导致肿瘤周围淋巴管异常增生,使肿瘤组织更易通过淋巴管转移。VEGF-C作为新生淋巴管的重要调控因子的作用已得到共识。
近年来,通过对VEGF-C在人肿瘤中的表达及其与肿瘤淋巴结转移之间的关系做了大量研究,表明VEGF-C表达与消化道肿瘤淋巴管生成和淋巴结转移相关。Furudoi等[7]应用免疫组化法检测152例进展期结直肠癌组织的VEGF-C表达,发现VEGF-C表达与淋巴管侵犯、淋巴结转移和浸润深度有关,并用多因素分析方法证明VEGF-C表达和淋巴结转移是影响5年生存率的独立因素。对胃癌标本进行检测发现VEGF-C的表达与淋巴管密度明显相关,提示VEGF-C与胃癌淋巴管生成密切相关。此外,在鼻咽癌[8]、乳腺癌[9]、非小细胞肺癌[10]、脑胶质瘤[11]等实体肿瘤组织中均检测到高表达的VEGF-C mRNA,其表达明显高于正常组织,并与淋巴管形成、淋巴结转移及预后密切相关。
本实验采用原位杂交的方法检测食管鳞癌组织及正常食管组织中VEGF-C mRNA的表达,发现食管鳞癌中VEGF-C mRNA表达明显高于正常食管组织,表明肿瘤组织中可能通过某些途径促进VEGF-C mRNA的表达。本组资料显示VEGF-C mRNA阳性表达率与患者T分期有密切的相关性。T3分期组的VEGF-C mRNA的表达阳性率显著高于T2分期组,提示VEGF-C与肿瘤浸润深度有关,与Takala等[12]的结论相符,可能与VEGF-C增强肿瘤侵袭能力、抑制细胞凋亡有关。本组资料显示有淋巴结转移患者的VEGFC mRNA表达率明显高于无淋巴结转移者,与Tanaka等[13]的研究结果相符。提示VEGF-C可能引起肿瘤周围淋巴管增生,或诱导肿瘤内淋巴管形成,从而使肿瘤细胞通过淋巴管进行转移扩散的概率增大。本组数据显示VEGF-C mRNA阳性组患者术后随访显示生存率低于VEGF-C mRNA阴性组,提示VEGF-C与肿瘤预后相关,推测可能与其促进肿瘤淋巴转移作用有关。
本组数据显示VEGF-C mRNA的表达与食管鳞状细胞癌浸润及淋巴结转移相关,并影响患者术后1年生存率,提示VEGF-C作为食管鳞癌血管和淋巴管新生过程中的重要因素,有望成为治疗食管鳞癌新的、理想的“生物靶点”。通过抑制VEGF-C及其受体的表达以及两者的结合,阻断VEGF-C信号转导通路,抑制肿瘤新生血管和淋巴管,达到抑制肿瘤浸润和转移的目的,有望降低食管鳞癌的淋巴转移率,改善病人的预后。目前已有相关的药物实验在进行,并取得一定的成果[14]。
通过本实验的结果,我们推测食管鳞癌肿瘤细胞产生的VEGF-C与其受体的胞外区特异性结合后,通过空间变构诱导细胞内酪氨酸残基自身磷酸化,并启动细胞内信号转导而发挥生物学效应,促进血管内皮细胞分裂与增殖,增加血管通透性,使肿瘤更易浸润到深部组织。同时通过受体介导的途径诱导淋巴管内皮细胞增殖、新生淋巴管形成,新生肿瘤淋巴管由于其特殊结构,淋巴管通透性上升,肿瘤细胞就易于侵入淋巴管并形成远处淋巴结的转移。但是食管鳞癌的浸润和淋巴转移的发生是一个多因素参与和协同作用的结果,其机制尚未完全明了。本实验仅从食管鳞癌VEGF-C mRNA这一因子观察,其结果仅能对解释食管鳞癌发生、发展与淋巴转移的机制提供参考。准确机制的阐述仍需要进一步临床及基础实验的证实。
[1] 吴在德.外科学[M].第7版.北京:人民卫生出版社,2008:349.
[2] Kozlowski M,Naumnik W,Niklinski J,et al.Vascular endothelial growth factor C and D expression correlates with lymph node metastasis and poor prognosis in patients with resected esophageal cancer[J].Neoplasma,2011,58 (4):311-319.
[3] Kar K,Kainen MJ,Petrova TV.Vascular endothelial growth factor receptors in the regulation of angiogenesis and lymphangiogenesis[J].Oncogene,2000,19(49):5598-5605.
[4] Hashimoto I,Kodama J,Seki N,et al.Vascular endothelial growth factor-C expression and its relationship to pelvic lymph node status in invasive cervical cancer[J].Br J Cancer,2001,85(1):93-97.
[5] Duff SE,Li C,Renehan A,et al.Immunodetection and molecular forms of plasma vascular endothelial growth factor-C[J].Int J Oncol,2003,22(2):339-343.
[6] Isaka N,Padera TP,Hagendoorn J,et al.Peritumor lymphatics induced by vascular endothelial growth factor-C exhibit abnormal function[J].Cancer Res,2004,64 (13):4400-4404.
[7] Furudoi A,Tanaka S,Haruma K,et al.Clinical significance of vascular endothelial growth factor C expression and angiogenesis at the deepest invasive site of advanced colorectal carcinoma[J].Oncology,2002,62(2):157-166.
[8] 赵国光,向晓娟,何友兼.血管内皮生长因子C、D在鼻咽癌组织中的表达及其临床意义[J].癌症,2007,26(1):90-95.
[9] Skobe M,Hawighorst T,Jackson DG,et al.Induction of tumour lymphangiogenesis by VEGF-C promotes breast cancer metastasis[J].Nat Med,2001,7(2):192-198.
[10] Ko YH,Jung CK,Lee MA,et al.Clinical significance of vascular endothelial growth factors(VEGF)-C and-D in resected non-small cell lung cancer[J].Cancer Res Treat,2008,40(3):133-140.
[11] 叶秀峰,钟雪云,朱 粲,等.Flt-4在不同级别脑星形细胞瘤中的表达意义[J].中国病理生理杂志,2005,21(2):380-382.
[12] Takala H,Saarnio J,Wiik H,et al.HIF-1α and VEGF are associated with disease progression in esophageal carcinoma[J].J Surg Res,2011,167(1):41-48.
[13] Tanaka T,Ishiguro H,Kuwabara Y,et al.Vascular endothelial growth factor C(VEGF-C)in esophageal cancer correlates with lymph node metastasis and poor patient prognosis[J].J Exp Clin Cancer Res,2010,29(1):83.
[14] Shah MA,Ramanathan RK,Ilson DH,et al.Multicenter phaseⅡstudy of irinotecan,cisplatin,and bevacizumab in patients with metastatic gastric or gastroesophageal junction adenocarcinoma[J].J Clin Oncol,2006,24(33): 5201-5206.

