细胞外低渗诱导大鼠胚胎心肌细胞H9c2容积激活性氯电流和调节性细胞容积回缩*
刘振锋, 厉冰雪, 滕双凤, 罗 海, 林 娜, 黄维渊, 朱林燕, 王立伟△, 陈丽新△
(暨南大学医学院1生理学系,2药理学系,广东广州510632)
容积激活性氯通道广泛存在于哺乳动物细胞上,参与细胞的多种生理和病理过程的调节。我们前期在鼻咽癌以及白血病细胞的研究中发现,容积敏感性氯通道在细胞的调节性容积回缩(regulatory volume decrease,RVD)过程中起重要作用,并参与了细胞的增殖、迁移、凋亡等过程[1-4]。近年来研究显示,容积激活性氯通道和许多心血管疾病的发生发展密切相关,其在心肌缺血、心肌肥大、心脏衰竭以及高血压引起的血管重塑过程中起重要作用[5]。大鼠胚胎心肌细胞H9c2细胞株是研究心肌细胞功能活动的常用细胞株,为心脏的生理病理研究提供了便利,以往有学者用之探讨心肌细胞钾离子通道和钙离子通道的功能活动[6-7],但目前未见该细胞株是否存在容积激活性氯通道的报道。本研究探讨细胞外低渗刺激是否可以诱导H9c2细胞容积激活性氯电流,研究该细胞的调节性容积回缩过程,这有助于阐明心肌细胞容积激活性氯通道的功能和调节性容积回缩能力,为了解容积激活性氯通道在心脏疾病的发生与发展中所起的作用奠定实验基础。
材料和方法
1 细胞培养
大鼠胚胎心肌细胞H9c2细胞株用含10%FBS、1×105U/L青霉素和 100 mg/L链霉素的高糖DMEM生长液(Gibco)常规培养在37℃、饱和湿度、5%CO2培养箱内,每2 d传代1次。
2 主要试剂
氯通道阻断剂他莫昔芬(tamoxifen)、5-硝基-2-(3-苯丙胺)苯甲酸[5-nitro-2-(3-phenylpropylamino)benzoic acid,NPPB]和ATP均购自Sigma。Tamoxifen在实验当天用甲醇新鲜配成 40 mmol/L母液,使用时用相应的灌流液稀释至终浓度20 μmol/L。NPPB用DMSO配成100 mmol/L储存液,储存在4℃冰箱中,使用时用相应的灌流液稀释至终浓度 100 μmol/L。ATP用蒸馏水配成 100 mmol/L储存液,储存在-20℃中,实验终浓度为10 mmol/L。
3 灌流液与电极内液
等渗灌流液(isotonic solution,ISO)渗透压为300 mOsmol/L,含(mmol/L):70 NaCl、0.5 MgCl2、2 CaCl2、10 HEPES和140 D-mannitol。低渗液(hypotonic solution,HYPO)渗透压为160 mOsmol/L,除不含甘露醇外,其它成分和浓度与等渗灌流液相同。高渗液(hypertonic solution,HYPER)渗透压为440 mOsmol/L,含280 D-mannitol,其余成分与等渗灌流液相同。各灌流液分别用Tris液调pH至7.4。灌流液配制毕后,用冰点渗透压计(Osmomat 030; Gonotec,Germany)检测溶液渗透压。
电极内液组成(mmol/L):70 N-methyl-D-glucamine chloride(NMDG -Cl),1.2 MgCl2,10 HEPES,1 EGTA,140 D-mannitol和2 ATP,用盐酸调节pH值至7.25。微电极充灌电极内液后尖端电阻为(5~10)MΩ。
4 全细胞膜片钳
用EPC-7膜片钳放大器(List Electronic,Germany)记录H9c2细胞的全细胞电流。电流和电压信号用CED1401(Cambrige,UK)数字化(采样频率3 kHz),实验数据用EPC(CED,Cambridge,UK)软件分析。
H9c2细胞用0.125%胰酶消化后制成细胞悬液,并滴于玻片上,待细胞贴壁牢固后进行实验。电压钳制模式有2种:(1)细胞被钳制在0、-40、+40、-80、+80 mV,并不断反复循环,每个钳制脉冲波宽200 ms,间隔4 s,在每个钳制脉冲开始10 ms后取值;(2)钳制电压-120 mV~120 mV,步增20 mV,每个钳制脉冲波宽300 ms,间隔1 s,在每个钳制脉冲开始10 ms后取值。在每个脉冲开始。先用等渗液灌流细胞5 min,记录此时背景电流,再用低渗液给予细胞刺激,同时记录电流。在电流增大至稳定后,改换含不同氯通道阻断剂的低渗液继续灌流,待电流被抑制平稳时计算电流的抑制率。
阻断剂对电流抑制率的计算公式为:
抑制率(%) = [(IHYPO-IISO) - (IBLOCKERSIISO)]/(IHYPO-IISO)×100%。其中IHYPO是47%HYPO作用到稳定时电流;IISO是等渗灌流时电流;IBLOCKERS是47%HYPO加入阻断剂至作用稳定时电流。
5 细胞体积测量
将细胞消化后制成悬液滴于玻片上,贴壁牢固后置于显微镜下拍图。实验分为低渗组和NPPB组,低渗组先将细胞用等渗灌流液灌流10 min,然后更换低渗液继续灌流;NPPB组先将细胞用等渗灌流液适应5 min,加入含100 μmol/L NPPB继续灌流5 min,然后更换为含等浓度NPPB的低渗液灌流35 min,全程灌流45 min。
实验完成后用图像分析软件(Image-Pro Plus 6.3)测量细胞的面积,从而间接测量细胞的直径,再转换成细胞容积V后,对细胞容积进行标准化处理。取细胞灌流1~5 min的体积均值作为初始体积V0。
细胞容积V、标准化体积Vst和细胞RVD能力的计算公式分别为:
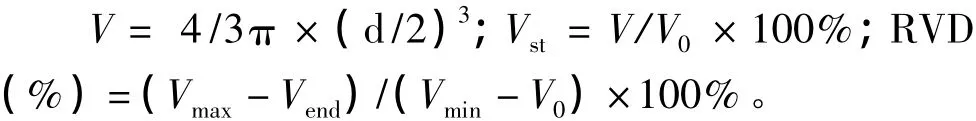
其中,Vmax为细胞最大时的标准化体积,Vend为细胞在第45 min的标准化体积。
6 统计学处理
采用SPSS 13.0进行统计分析,数据用均数±标准误(±sE)表示,用方差分析(ANOVA)检验均数差异显著性,以P<0.05为差异有统计学意义。
结果
1 细胞外低渗诱导大鼠胚胎心肌细胞H9c2容积激活性氯电流
采用全细胞记录模式记录H9c2细胞的跨膜电流。等渗条件下,可以记录到一基础电流,该基础电流微小且稳定。在+80 mV和-80 mV电压钳制下,其平均电流密度分别为(5.30±0.80)pA/pF和 (-4.82±0.85)pA/pF(n=30)。当将等渗液换为低渗液进行细胞灌流时,跨膜电流迅速增大,最后稳定在峰值。平均电流密度分别为(47.77±3.80) pA/pF和(-33.36±2.80)pA/pF(n=30,P<0.01),内向电流较外向电流为小,表现出外向优势。其翻转电位是(-9.02±0.61)mV,见图1A、B。
在钳制电压为±120 mV,电压间距20 mV,钳制脉冲波宽为300 ms时,电流并没有表现出明显的时间依赖性失活和电压依赖性失活,见图1C。
2 低渗诱导H9c2细胞氯电流的容积敏感性
在低渗诱发的电流达到峰值并平稳后,换用47%高渗液灌流,电流明显减小。高渗液对外、内向电流的抑制率分别为:(100.17±1.34)%和(98.44 ±1.74)%(n=9,P<0.01)。这说明该电流是具有容积敏感性的,其可被低渗灌流液诱导产生,又可被高渗灌流液抑制,见图2。图2A为低渗灌流诱导容积激活性电流的全程图,图2B为细胞平均电流密度与钳制电压之间的关系,图2C、D分别为该电流在低渗及高渗灌流液作用下的瞬时电流图。

Figure 1.Chloride currents activated by hypotonicity in H9c2 cells.A:typical time course of the current activated by hypotonicity.B: current-voltage relationship.±sE.n=30.**P<0.01 vs ISO.ISO:isotonic control solution;HYPO:hypotonic bath solution.C:typical current traces recorded in hypotonic solution.图1 低渗激活的H9c2全细胞氯电流

Figure 2.Inhibition of hypotonicity-activated chloride currents by hypertonic bath solution in H9c2 cells.A:typical time course of the chloride currents induced by hypotonicity and inhibition of the currents by cell shrinkage induced by the hypertonicity.B:current-voltage relationship.±sE.n=9.**P<0.01 vs HYPO.C:typical current traces recorded in hypotonic solution.D:typical current traces recorded in hypertonic solution.图2 高渗液抑制低渗激活的氯电流
3 氯通道阻断剂抑制低渗激活的氯电流
为了进一步分析氯通道在低渗刺激诱导的H9c2细胞电流中的作用,我们观察了氯通道阻断剂对低渗激活的H9c2细胞氯电流的影响,发现该电流均可以被tamoxifen、NPPB和ATP这3种氯通道阻断剂不同程度抑制。
在+80 mV和-80 mV钳制电压时,tamoxifen抑制低渗液激活的氯电流,其对外内向电流的抑制率分别为:(73.96±6.70)%和(76.51±4.64)%(n= 7,P<0.01)。图3A、B、C、D分别为tamoxifen抑制低渗激活的氯电流全程图、电流密度-电压关系、低渗及tamoxifen作用下的瞬时电流图。

Figure 3.Inhibition of hypotonicity-activated chloride currents by chloride channel blocker tamoxifen in H9c2 cells.A:typical time course of the chloride current induced by hypotonicity and inhibition of the currents by tamoxifen(20 μmol/L).B:current-voltage relationship.±sE.n=7.**P<0.01 vs HYPO.C:typical current traces recorded in hypotonic solution.D: typical current traces recorded in hypotonic solution containing tamoxifen.图3 氯通道阻断剂tamoxifen抑制低渗激活的氯电流
NPPB可以抑制该容积敏感性电流,见图4。其对外内向电流的抑制率分别为:(81.12±6.11)%和(79.06±7.64)%(n=5,P<0.01)。图4A、B、C、D分别为NPPB抑制低渗激活的氯电流全程图、电流密度-电压关系、低渗及NPPB作用下的瞬时电流图。
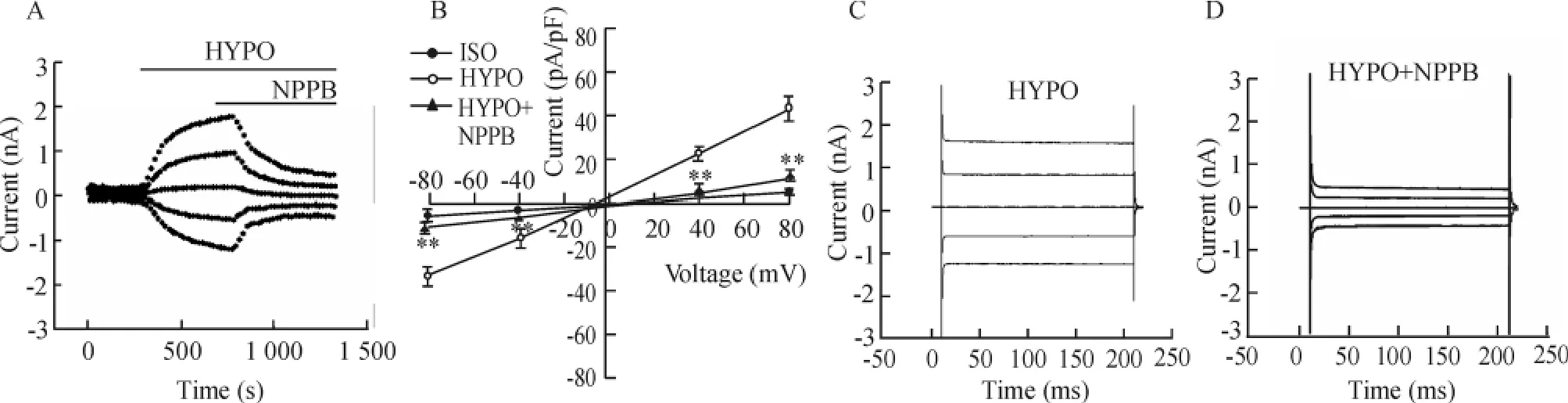
Figure 4.Inhibition of hypotonicity-activated chloride currents by chloride channel blocker NPPB in H9c2 cells.A:typical time course of the chloride currents induced by hypotonicity and inhibition of the currents by NPPB(100 μmol/L).B:currentvoltage relationship.±sE.n=5.**P<0.01 vs HYPO.C:typical current traces recorded in hypotonic solution.D:typical current traces recorded in hypotonic solution containing NPPB.图4 氯通道阻断剂NPPB抑制低渗激活的氯电流
ATP显著抑制该容积敏感性电流,见图5。其对外、内向电流的抑制率分别为:(91.94±2.78)%和(40.01±8.80)%(n=6,P<0.01),其对外向电流的抑制作用远远大于对内向电流的抑制作用。图5A、B、C、D分别为ATP抑制低渗激活的氯电流全程图、电流密度-电压曲线、低渗及ATP作用下的瞬时电流图。
NPPB和tamoxifen灌流液中分别含有相应浓度的DMSO和甲醇,为排除两者的影响,用0.1%DMSO及0.05%甲醇的47%低渗灌流液分别作用于H9c2细胞,发现电流无明显改变。
4 低渗诱导心肌细胞调节性容积回缩及氯通道阻断剂对心肌细胞调节性容积回缩的影响
低渗液在H9c2细胞中诱发明显的RVD。在等渗液灌流下,细胞容积稳定,当灌流液从等渗液换为低渗液时,细胞迅速增大,在低渗液作用于细胞5 min时达到最大,此时细胞容积增加至(147.82±4.57)%(n =8),随后容积逐渐减小,低渗35 min时细胞容积减少为(115.55±3.86)%(n=8,P<0.01)。RVD使细胞容积回复(69.73±8.83)%,见图6A、C。
细胞在含NPPB的等渗灌流液中轻微胀大。更换含NPPB的低渗液(HYPO+NPPB)继续灌流,观察到细胞迅速胀大,HYPO+NPPB作用5 min时细胞容积为(142.82±4.03)%,与低渗组细胞容积的最大值(147.82±4.57)%比较,差异没有统计学意义。随后细胞体积较稳定,未见明显细胞容积回缩。HYPO+NPPB作用35 min时,细胞体积为(149.19±9.06)%(n=8),与低渗组比较,两者在45 min时的体积差别有统计学意义(P<0.01),见图6B、C。
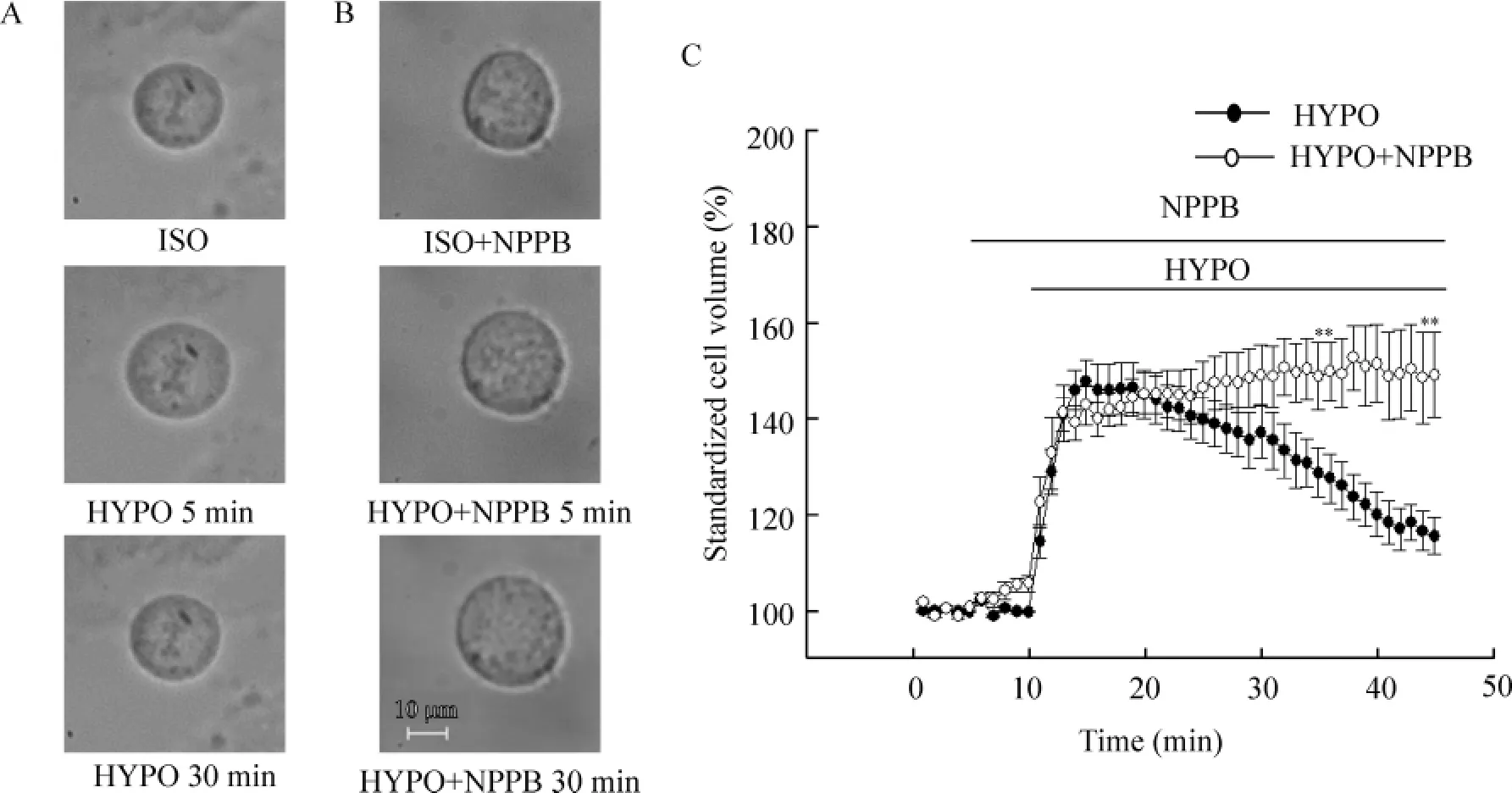
Figure 6.Chloride channel blocker NPPB inhibited the RVD process in H9c2 cells.ISO:isotonic bath solution;HYPO:hypotonic bath solution;HYPO+NPPB:hypotonic bath solution containing 100 μmol/L NPPB.A:cell images taken in the isotonic solution(ISO)and 47%hypotonic solution for 5 min(HYPO 5 min)and 30 min(HYPO 30 min);B:cell images taken in the isotonic solution containing NPPB(ISO+NPPB)and 47%hypotonic solution containing NPPB for 5 min(HYPO+ NPPB 5 min)and 30 min(HYPO+NPPB 30 min);C:inhibition of RVD by chloride channel blocker NPPB in H9c2 cells.±sE.n=8.**P<0.01 vs HYPO.图6 氯通道阻断剂NPPB抑制H9c2心肌细胞的调节性容积回缩过程
讨论
细胞容积维持相对稳定是细胞进行正常生理活动的必要条件。心肌细胞需有一定的容积调节能力,使其在遭受内外渗透压变化时仍能维持自身容积的相对稳定,氯通道在这一生理调节过程中起着重要作用。不仅如此,在某些病理条件下,如心肌缺血、心力衰竭、心律失常等可以记录到激活的容积激活性氯电流,这说明,其在心脏的病理过程中也具有重要意义[8]。心肌缺血时,心肌细胞内线粒体氧化磷酸化途径受抑,ATP生成减少,钠离子、水以及代谢产物在细胞内堆积,造成细胞内高渗,引起心肌细胞水肿,激活容积激活性氯通道从而产生RVD,可能对心肌细胞起保护作用。文献提示,缺血前处理可以增强心肌细胞的RVD能力[9],缺血预适应可以增加心脏组织对缺血缺氧的耐受性,对心肌细胞起保护作用。预处理心肌由于缺血缺氧,心肌细胞发生肿胀,可以激活心肌细胞上的容积激活性氯通道,保护缺血再灌注过程中的心肌细胞,使得心脏组织在再次缺氧缺血时避免容积的过度增大[10]。因此,容积激活性氯通道在心肌缺血时发挥重要作用,其可能成为心肌缺氧缺血治疗药物的一个新靶标。在肥大心肌也观察到容积激活性氯电流的激活[5],这提示,容积激活性氯通道不仅可能参与了心脏的急性损伤过程,其也可能参与了某些心脏慢性疾患的发生发展。
本研究中,我们使用H9c2细胞作为研究对象,观察细胞在低渗刺激诱导的容积激活性氯电流特性和调节性容积回缩。结果表明,灌流低渗液后可观察到H9c2细胞容积迅速胀大,并激活一个具有外向优势的跨膜电流,由于灌流液与电极内液配方不含钾离子,且由Nernst公式计算出的钠离子和钙离子的平衡电位均大于200 mV,因此可以基本排除电流与这 3种离子的关系。该电流可被 tamoxifen、NPPB、ATP等多种氯通道阻断剂抑制,这提示低渗在H9c2细胞上激活的电流为氯电流。且计算出的平衡电位较接近氯离子的平衡电位,高渗灌流液可以抑制这个电流,表明该电流有容积敏感性。该电流不表现出明显的时间依从性失活与电压依赖性失活,该电流的电生理学特性和药理学特性与我们前已报道的白血病细胞及低分化鼻咽癌细胞容积激活性氯电流的特性相似[11-12]。H9c2细胞在低渗环境中发生胀大,激活容积激活性氯通道,氯离子外流,伴随水外流,导致细胞容积减小,即产生调节性容积回缩。用氯通道阻断剂NPPB抑制H9c2细胞容积激活性氯电流的同时也抑制了该细胞RVD过程,表明低渗刺激可以在H9c2细胞上诱发RVD,容积激活性氯通道在这一过程中起关键作用。
我们前期研究显示,许多抗肿瘤药物作用于细胞引起细胞凋亡时,能激活氯电流,该电流生理特性与容积激活性氯电流相似,也可以被高渗灌流液完全抑制,具有容积敏感性[13-14]。氯通道阻断剂能拮抗抗癌药引起的细胞凋亡,提示氯通道参与抗肿瘤药诱导的细胞凋亡过程[4]。抗肿瘤药是否可通过作用于容积敏感性氯通道诱导心肌细胞凋亡而产生心脏毒性,仍需进一步的深入研究。研究H9c2心肌细胞的容积敏感性氯通道的特性,有助于阐明氯通道在心肌生理及病理功能活动中的作用。
[1] Yang L,Ye D,Ye W,et al.ClC-3 is a main component of background chloride channels activated under isotonic conditions by autocrine ATP in nasopharyngeal carcinoma cells[J].J Cell Physiol,2011,226(10):2516-2526.
[2] Chen LX,Zhu LY,Jacob TJ,et al.Roles of volume-activated Cl-currents and regulatory volume decrease in the cell cycle and proliferation in nasopharyngeal carcinoma cells[J].Cell Prolif,2007,40(2):253-267.
[3] Mao J,Chen L,Xu B,et al.Volume-activated chloride channels contribute to cell-cycle-dependent regulation of HeLa cell migration[J].Biochem Pharmacol,2009,77 (2):159-168.
[4] Zuo W,Zhu L,Bai Z,et al.Chloride channels involve in hydrogen peroxide-induced apoptosis of PC12 cells[J].Biochem Biophys Res Commun,2009,387(4):666-670.
[5] Duan DD.The ClC-3 chloride channels in cardiovascular disease[J].Acta Pharmacol Sin,2011,32(6):675-684.
[6] Sipido KR,Marban E.L-type calcium channels,potassium channels,and novel nonspecific cation channels in a clonal muscle cell line derived from embryonic rat ventricle[J].Circ Res,1991,69(6):1487-1499.
[7] Shi H,Wang H,Han H,et al.Ultrarapid delayed rectifier K(+)current in H9c2 rat ventricular cell line:biophysical property and molecular identity[J].Cell Physiol Biochem,2002,12(4):215-226.
[8] Baumgarten CM,Clemo HF.Swelling-activated chloride channels in cardiac physiology and pathophysiology[J].Prog Biophys Mol Biol,2003,82(1-3):25-42.
[9] Diaz RJ,Armstrong SC,Batthish M,et al.Enhanced cell volume regulation:a key protective mechanism of ischemic preconditioning in rabbit ventricular myocytes[J].J Mol Cell Cardiol,2003,35(1):45-58.
[10] Bozeat ND,Xiang SY,Ye LL,et al.Activation of volume regulated chloride channels protects myocardium from ischemia/reperfusion damage in second-window ischemic preconditioning[J].Cell Physiol Biochem,2011,28 (6):1265-1278.
[11] 曹国振,左婉红,马文波,等.人急性淋巴细胞白血病细胞容积激活性氯电流的研究[J].中国病理生理杂志,2011,27(4):677-681.
[12] 朱林燕,左婉红,张海峰,等.低渗诱导高分化鼻咽癌细胞CNE-1容积激活性氯电流[J].中国病理生理杂志,2009,25(6):1094-1097.
[13] 刘善文,李 媛,李华荣,等.小檗碱激活人结肠癌细胞容积敏感的氯通道[J].生理学报,2011,63(6): 517-524.
[14] 罗海兵,李华荣,刘善文,等.蟾蜍灵激活低分化鼻咽癌细胞氯通道[J].中国病理生理杂志,2011,27(4): 672-676.

