ERK信号通路在檞皮素促大鼠MSCs成骨分化中的作用*
奉水旺, 杨 丽, 王攀攀, 李淑琴, 汪 甜, 尹素娟, 张荣华△
(暨南大学1药学院中药学教研室,2医学院,广东广州510632)
骨髓间充质干细胞(mesenchymal stem cells,MSCs),通过迁移、增殖、分化,在骨吸收部位形成成骨细胞(osteoblast,OB),并介导新骨组织形成的过程,也是骨形成的核心过程[1]。目前对MSCs的成骨分化和骨形成的分子机制认识有限,给骨代谢疾病如骨质疏松(osteoprosis,OP)的治疗带来局限。近年来研究发现,细胞外信号调节激酶(extracellular signal-regulated kinase,ERK)信号在MSCs成骨分化中发挥了重要作用[2]。实验发现槲皮素(quercetin,QUE)可以抑制去势小鼠骨量丢失而对子宫没有不利影响,但其作用机制还不明确[3]。本实验通过研究QUE是否能促进MSCs成骨,并探索ERK信号通路是否在此过程中发挥重要作用,以期阐明QUE保护骨量的细胞分子生物学机制,为QUE应用于OP等骨代谢疾病的预防和治疗提供细胞分子生物学依据。
材料和方法
1 材料
1.1 动物 SPF级3月龄雌性Sprague-Dawley (SD)大鼠,由南方医科大学实验动物中心提供,许可证号SCXK粤2006-0015。MSCs由大鼠股骨和胫骨中分离提取,传至第3代后进行实验。
1.2 主要试剂 Alpha-modified minimum essential medium(α-MEM)购于HyClone;优级胎牛血清购于天津灏洋生物制品科技有限责任公司;QUE购于中国药品生物制品检定所;PD98059购于Millipore;噻唑蓝(methyl thiazolyl tetrazolium,MTT)和BCA蛋白浓度测定试剂盒购于碧云天生物科技公司;碱性磷酸酶(alkaline phosphatase,ALP)测定试剂盒购于南京建成生物工程研究所;酶联免疫吸附测定(enzyme-linked immunosorbent assay,ELISA)试剂盒购于RB公司;甘油醛-3-磷酸脱氢酶(glyceraldehyde-3-phosphate dehydrogenase,GAPDH)兔抗大鼠Ⅰ抗、ERK1/2和p-ERK1/2兔抗大鼠Ⅰ抗及羊抗兔Ⅱ抗购于Cell Signaling;SYBR Green PCR Master Mix购于Toyobo。
2 方法
2.1 MSCs的提取 大鼠颈椎脱臼处死,75% 乙醇浸泡10 min;分离双侧下肢,取出股骨和胫骨,去尽表面肌肉以及骨膜;将取出的股骨和胫骨移至超净工作台,用75% 乙醇泡10~30 s,D-Hanks液冲洗5~8次;剪去骨两干骺端,用5 mL注射器吸取含10%FBS的α-MEM完全培养液反复冲洗骨髓腔;用1 mL注射器4×13 TW LB针头反复吹打,使细胞成单细胞悬液,调整细胞密度为1.0×109cells/L,接种到25 cm2培养瓶中,放入37℃、5%CO2培养箱中培养。24 h后半量换液,48 h后全量换液,以后每隔3 d换1次培养液。3代以后的细胞用于实验。
2.2 MTT法检测QUE对MSCs的增殖作用 细胞传到第3代用0.25% 胰蛋白酶消化、重悬,以5.0× 106cells/L密度接种于96孔板中。在37℃,5% CO2培养箱内培养到细胞达80% 融合时,设置含QUE 0.01 μmol/L、0.1 μmol/L、1 μmol/L、10 μmol/L和100 μmol/L的给药浓度组以及空白组,每组6个复孔。加入无血清的MEM/α培养液培养24 h后,分别加入上述药物浓度的MEM/α完全培养液,培养24 h后,弃去培养液,加入5 g/L MTT溶液20 μL,37℃、5%CO2培养箱内继续培养4 h后,弃MTT溶液,加100 μL DMSO,振荡10 min,使结晶完全溶解,酶标仪490 nm波长检测吸光度(A)。
2.3 ALP测定试剂盒检测不同浓度QUE对MSCs的ALP活性的影响 以1.0×108cells/L细胞密度接种于6孔板中,在37℃、5%CO2培养箱内培养到细胞达80% 融合时,按上述实验分组设置,每组6个孔。加入无血清的α-MEM培养液培养24 h后,分别加入上述药物浓度的α-MEM完全培养液,培养72 h后,吸弃孔中的培养液,用D-Hanks液洗2~3遍,每孔加入细胞裂解液1 mL,4℃作用30 min,收集细胞裂解液。BCA法检测各组的总蛋白浓度,用ALP检测试剂盒检测各组ALP表达。
2.4 分组及干预方法 将细胞以1.0×108cells/L的细胞密度接种于6个60 mm培养皿中,将其设置为空白对照组、QUE组、QUE+PD98059组和PD98059组。细胞无血清α-MEM培养液培养24 h后,需加抑制剂的组先加入抑制剂30 min后,再加入QUE,使各抑制剂最终浓度PD98059为10 μmol/L,QUE的最终浓度为10 μmol/L。
2.5 检测各组ALP、Ⅰ型胶原(collagen typeⅠ,ColⅠ)和骨钙素(bone Gla protein,BGP)表达 按2.4方法操作后共同培养72 h,弃去培养液,用 DHanks液洗涤3次,加入150 μL细胞裂解液,收集细胞裂解液。用BCA法测定各组的总蛋白浓度,用ALP检测试剂盒检测各组ALP表达,ELISA法检测各组ColⅠ和BGP表达。
2.6 Western botting检测ERK1/2及其磷酸化蛋白的表达 按2.4方法操作后共同培养24 h,弃去培养液,用D-Hanks液洗涤3次,加入100 μL细胞裂解液,收集细胞裂解液。用BCA法检测各组总蛋白浓度,12%SDS-PAGE凝胶进行电泳分离,每组上样总蛋白量30 μg,转膜,封闭,加Ⅰ抗、辣根过氧化物酶标记Ⅱ抗,用ECL液进行荧光显影并显示在X光片上,结果用Quantity One Manual图像分析软件测定各条带的灰度并进行分析。
2.7 荧光定量PCR检测转化生长因子 β1(transforming growth factor β1,TGF-β1)、骨形成蛋白2(bone morphogenetic protein 2,BMP-2)和核心结合因子α1 (core binding factor α1,Cbfα1)mRNA的表达 设计18S、TGF-β1、BMP-2和Cbfα1的荧光定量PCR引物(序列见表1)。按2.4方法分组后共同培养24 h,Trizol提取总RNA,取1 μg总RNA合成cDNA,然后以cDNA为模板,进行上述各基因的荧光定量PCR反应。反应体系包括:2×SYBR Green PCR Master Mix 10 μL;cDNA 5 μL;上、下游引物各0.5 μL; dH2O 4 μL。反应在 ABI PRISM® 7500 Sequence Detection System上进行,运行条件为:先95℃ 5 min,然后95℃ 15 s,60℃15 s,72℃ 32 s,共40个循环,在每个循环的第2步结束后收集荧光信号,以荧光信号对反应循环数作图。每个反应设3个复孔,取平均值Ct,通过ΔΔCt法计算各组细胞的上述基因的表达水平。
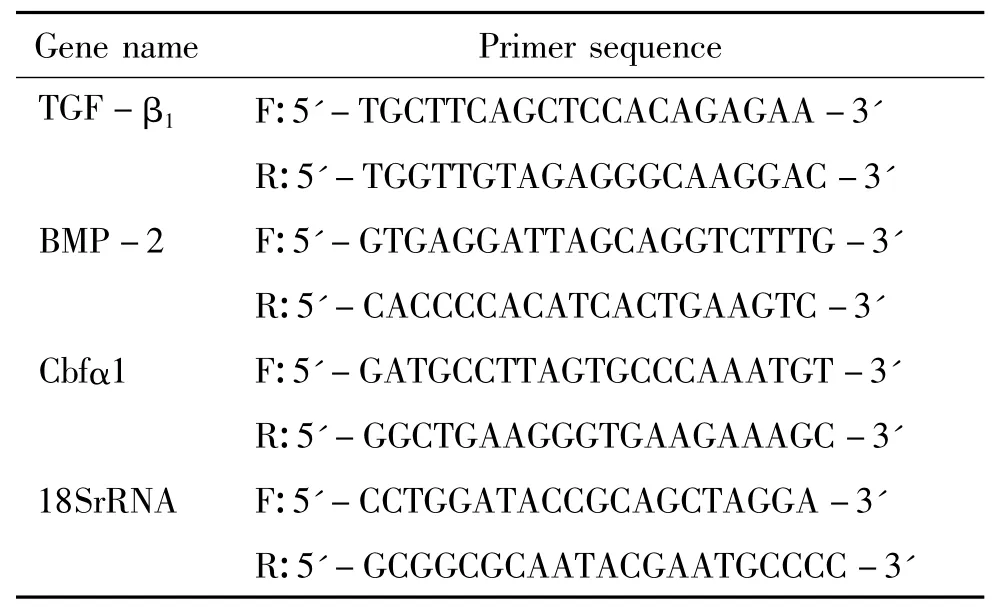
表1 荧光定量PCR的引物序列Table 1 .The primer sequences for fluorescence quantitative PCR
3 统计学处理
数据采用SPSS 16.0统计软件分析处理,计量资料的数据以均数±标准差(±s)表示,组间比较进行单因素方差分析,以P<0.05为差异有统计学意义。
结果
1 QUE对MSCs的增殖和ALP表达的影响
MTT结果显示,10 μmol/L组、1 μmol/L组和0.1 μmol/L组A值显著高于空白组(P<0.05),但10 μmol/L组、1 μmol/L组和0.1 μmol/L组之间A值无显著差异(P>0.05);ALP表达结果显示,10 μmol/L组ALP表达显著高于其它各组(P<0.05)。因此,10 μmol/L QUE具有最佳促MSCs骨向分化的作用,见表2。
表2 不同QUE浓度对MSCs的增殖和ALP表达的影响Table 2 .Effects of different concentrations of QUE on the proliferation and ALP expression of MSCs(±s.n=6)

表2 不同QUE浓度对MSCs的增殖和ALP表达的影响Table 2 .Effects of different concentrations of QUE on the proliferation and ALP expression of MSCs(±s.n=6)
*P<0.05 vs 0 μmol/L.
?
2 对MSCs干预后ALP、BGP和ColⅠ表达的结果
QUE组ALP、BGP和ColⅠ表达高于空白组(P<0.01),QUE+PD98059组ALP、BGP和ColⅠ表达低于QUE组(P<0.01),QUE+PD98059组ALP、BGP和ColⅠ表达高于PD98059组(P<0.01),见表3。
表3 实验各组ALP、ColⅠ和BGP表达Table 3 .Effects of ERK signaling on ALP,BGP and ColⅠexpression in MSCs(±s.n=3)
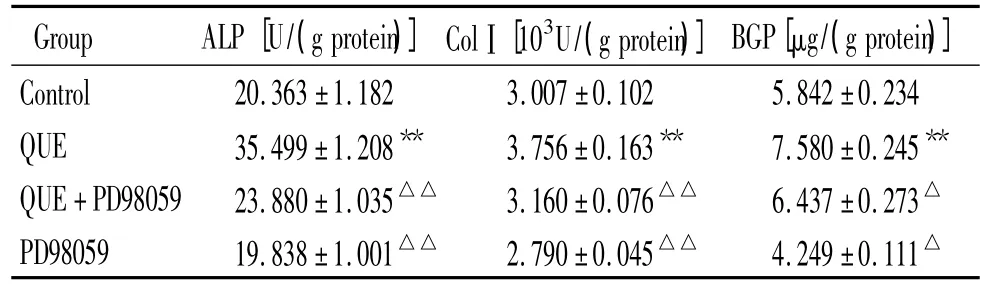
表3 实验各组ALP、ColⅠ和BGP表达Table 3 .Effects of ERK signaling on ALP,BGP and ColⅠexpression in MSCs(±s.n=3)
**P<0.01 vs control group;△P<0.05,△△P<0.01 vs QUE group.
?
3 磷酸化ERK1/2表达的检测结果
与空白组比较,QUE组磷酸化ERK1/2表达增加(P<0.05);与QUE组比较,QUE+PD98059组和PD98059组磷酸化ERK1/2表达减少(P<0.05),见图1。

Figure 1.Phosphorylation of ERK1/2 in QUE-treated MSCs analyzed by Western blotting.图1 Western blotting检测磷酸化ERK1/2的表达
4 TGF-β1、BMP-2和Cbfα1 mRNA表达的检测结果
与空白组比较,QUE组BMP-2和Cbfα1的表达均增加(P<0.01),TGF-β1表达也增加(P<0.05);与QUE组比,QUE+PD98059组和PD98059组BMP-2和Cbfα1的表达下降(P<0.01),TGF-β1表达也下降(P<0.05),见图2。
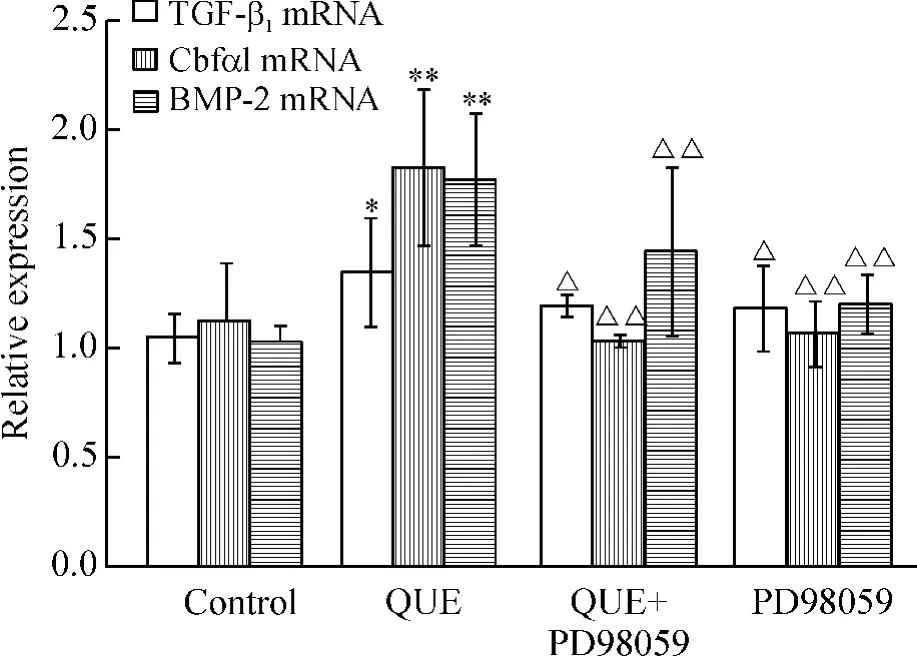
Figure 2.The expression of TGF-β1,BMP-2 and Cbfα1 mRNA in QUE or/and PD98059-treated MSCs.±s.n =3.*P<0.05,**P<0.01 vs control group;△P<0.05,△△P<0.01 vs QUE group.图2 TGF-β1、BMP-2和Cbfα1 mRNA的表达
讨论
近年来研究发现,MSCs成骨分化能力减弱而成脂分化能力增强是OP发生的重要机制之一[3],因此对MSCs成骨分化能力调节的研究成为OP治疗机制研究的热点。现有研究表明,QUE可以抑制去势小鼠骨量丢失而对子宫没有不利影响,但其作用机制的研究还不明确,尤其在它对MSCs是否有作用,如何作用方面还没有报道[4]。因此,本实验从QUE是否能促进MSCs成骨分化入手,并深入探索ERK信号通路是否在此过程发挥作用。
MSCs在成骨分化过程中的不同阶段会表达各种骨特征标志蛋白,如ALP和ColⅠ在成骨分化早期表达高,发生矿化后有所降低,随后是基质蛋白,如:骨桥蛋白和骨涎蛋白,最后同时出现BGP和细胞外基质钙化。这些基质蛋白的协同作用,保证了细胞外基质的成熟,伴随着外基质的成熟,OB被包埋其中而形成骨组织[5]。因此,本实验通过检测ALP成骨特异性指标,来评价不同浓度QUE促进MSCs骨向分化能力;同时以ERK1/2的磷酸化对ALP、ColⅠ和BGP蛋白的影响,来评价ERK信号通路在QUE促进MSCs成骨分化过程可能起到的作用。本实验对不同浓度QUE进行筛选,实验结果提示,10 μmol/ L QUE具有最佳促MSCs骨向分化作用,并能促进MSCs的增殖。
ERK通路是有丝分裂原活化蛋白激酶(mitogen-activated protein kinase,MAPK)系统中主要的通路。MAPK具有显著的进化保守三级激酶级联形式的特点:细胞受刺激后激活MAPK激酶的激酶(MAP kinase kinase kinase,MKKK),进而激活MAPK激酶(MAP kinase kinase,MKK),MKK激活后通过双位点磷酸化调控MAPK的活性。ERK通路是MAPK系统主要和经典的通路:细胞外信号→细胞受体→细胞内酪氨酸激酶和适配蛋白→Ras→Raf→MEKK1→MEK1→ERK1/2→转录因子→细胞增殖、转化相关基因表达→细胞增生、转化。许多研究证明[6-7],ERK在MSCs成骨分化中起到重要的调节作用。BMPs是属于TGF-β超家族的成员之一,因其能促进OB、成软骨细胞的分化和诱导异位骨形成而得名。研究表明BMP-2和TGF-β1在MSCs成骨分化中能起到十分重要的作用[8-9]。Cbfα1是成骨特异性转录因子又称Runx2[10]。Shi等[11]通过实验证明,间歇性拉伸载荷刺激 MSCs骨向分化是通过RhoA-ERK1/2通路调制Cbfα1变化起作用的,因此Cbfα1作为ERK通路促进MSCs成骨分化的下游转录因子,可作为判断ERK通路是否激活的重要指标。我们在实验中加入QUE,磷酸化的ERK1/2增加,同时Cbfα1表达增加;PD98059抑制ERK1/2后加入QUE,磷酸化的ERK1/2减少,同时Cbfα1表达减少;结果表明,QUE能激活ERK通路。实验中在加入或不加入 ERK1/2的抑制 PD98059情况下,BMP-2和TGF-β1表达随之改变,说明BMP-2和TGF-β1与ERK通路有重要的联系,那么它们之间有着怎么样的联系呢?
有研究表明[12],在大豆黄酮促进成人干细胞增殖实验中发现ERK依赖TGF-β1的调节;然而也有报道用药物阻断Ras/MEK/ERK后[13],TGF-β1表达同时受到抑制。本研究发现,QUE在诱导MSCs成骨的过程中,成骨分化相关指标表达增加,同时伴随BMP-2和TGF-β1表达增加;用PD98059抑制ERK1/2后,成骨分化相关指标表达下降,同时BMP-2和TGF-β1表达也降低;有许多研究已经证明ERK通路能介导 Cbfα1的表达[14],TGF-β/BMPs通路也能调节Cbfα1[15]。因此,QUE在促进MSCs成骨过程中,激活了ERK通路,激活的ERK通路对TGF-β1和BMP-2有调节作用,在ERK通路与TGF-β/BMPs通路之间的交互作用下,共同调节成骨转录因子Cbfα1,从而调节成骨分化;从ERK通路的激活到促进BMP-2和TGF-β1的生成从而增强对Cbfα1调节作用,这一过程将QUE促进MSCs成骨的作用放大。
综上所述,一定浓度的QUE能促进MSCs的增殖和成骨分化,ERK信号的激活在QUE促进MSCs成骨过程中起到十分重要的作用。
[1] Hadjidakis DJ,Androulakis II.Bone remodeling[J].Ann N Y Acad Sci,2006,1092:385-396.
[2] 罗 杨,刘 一,张科强.MAPK信号传导通路在间充质干细胞向成骨细胞分化中的作用[J].吉林医学,2008,29(6):443-445.
[3] 梁世桢,王国轩,范龙坤,等.去势大鼠骨量丢失过程中骨髓间充质干细胞的增殖分化功能[J].中国病理生理杂志,2012,28(3):398-403.
[4] Tsuji M,Yamamoto H,Sato T,et al.Dietary quercetin inhibits bone loss without effect on the uterus in ovariectomized mice[J].J Bone Miner Metab,2009,27(6):673-681.
[5] 廖二元,谭利华.代谢性骨病学[M].第1版.北京:人民卫生出版社,2003:1-78.
[6] 张丽蓉,项 鹏,夏文杰,等.PD98059对人骨髓间质干细胞分化为成骨细胞的影响[J].中国病理生理杂志,2002,18(8):896-899.
[7] Chen TH,Chen WM,Hsu KH,et al.Sodium butyrate activates ERK to regulate differentiation of mesenchymal stem cells[J].Biochem Biophys Res Commun,2007,355(4):913-918.
[8] 王 瑒,李 正,王小娜,等.雷奈酸锶通过上调骨形态发生蛋白2的表达促进骨髓间充质干细胞分化为成骨细胞[J].中国病理生理杂志,2012,28(3):404-408.
[9] Schwartz Z,Simon BJ,Duran MA,et al.Pulsed electromagnetic fields enhance BMP-2 dependent osteoblastic differentiation of human mesenchymal stem cells[J].J Orthop Res,2008,26(9):1250-1255.
[10] Takeda S,Bonnamy JP,Owen MJ,et al.Continuous expression of Cbfa1 in nonhypertrophic chondrocytes uncovers its ability to induce hypertrophic chondrocyte differentiation and partially rescues Cbfa1-deficient mice[J].Genes Dev,2001,15(4):467-481
[11] Shi Y,Li H,Zhang X,et al.Continuous cyclic mechanical tension inhibited Runx2 expression in mesenchymal stem cells through RhoA-ERK1/2 pathway[J].J Cell Physiol,2011,226(8):2159-2169.
[12] Lee J,Roh KB,Kim SC,et al.Soy peptide-induced stem cell proliferation:involvement of ERK and TGF-β1[J].J Nutr Biochem,2012,Jan 2[Epub ahead of print].
[13] Tsubaki M,Yamazoe Y,Yanae M,et al.Blockade of the Ras/MEK/ERK and Ras/PI3K/Akt pathways by statins reduces the expression of bFGF,HGF,and TGF-β as angiogenic factors in mouse osteosarcoma[J].Cytokine,2011,54(1):100-107.
[14] Lee CH,Huang YL,Liao JF,et al.Ugonin K promotes osteoblastic differentiation and mineralization by activation of p38 MAPK-and ERK-mediated expression of Runx2 and osterix[J].Eur J Pharmacol,2011,668(3):383-389.
[15] Alliston T,Choy L,Ducy P,et al.TGF-β-induced repression of CBFA1 by Smad3 decreases cbfa1 and osteocalcin expression and inhibits osteoblast differentiation[J].EMBO J,2001,20(9):2254-2272.

