饲粮不同采食水平下肉羊氮沉积和尿中嘌呤衍生物排出规律的研究
马 涛 刁其玉* 邓凯东 姜成钢 屠 焰 王永超 刘 洁 赵一广
(1.中国农业科学院饲料研究所,北京 100081;2.金陵科技学院动物科学与技术学院,南京210038)
目前评价反刍动物的蛋白质营养需要通常采用小肠可消化蛋白质体系(MP),该体系将进入反刍动物小肠的总蛋白质剖分为饲粮非降解蛋白质(UDP)和瘤胃微生物蛋白质(MCP)2大部分[1-3]。由于MCP占MP的比例很大,且小肠吸收的氨基酸几乎有50%以上全部来源于 MCP[4],因此定量MCP具有重要意义。测定微生物氮(MN)产量的经典方法为标记法,标记物分为内源性和外源性2大类[5]。标记法的缺点是需要瘘管动物,且测定步骤繁琐。尿嘌呤衍生物(purine derivatives,PD)法的出现克服了这些缺点,该法简单易行,不需要安装瘘管,因此被广泛应用于反刍动物MN产量的估测。目前国内外研究主要集中在牛上开展,在肉用绵羊上却鲜有报道,而由于PD排出量在不同动物品种之间存在差异[6],因此有必要针对肉用绵羊尿中PD排出规律进行研究。本试验以我国杜寒杂交肉用绵羊作为试验动物,研究不同采食水平下其氮平衡和PD排出规律,为在肉用绵羊上应用该法估测MN产量提供依据。
1 材料与方法
1.1 试验材料
尿囊素:纯度≥98.5%(国药集团化学试剂有限公司,中国);尿酸:纯度≥99%(Sigma,金诺利华科技有限公司,中国);黄嘌呤氧化酶:活性21.5U/mg(Merck,德国);尿酸酶:活性10U/mg(Asahi Kasei,日本)。
1.2 试验动物及饲粮
本试验选用6月龄体况健康,平均体重为(41.3±2.8)kg的杜寒杂交绵羊公羔12只,按照自由采食(AL)、自由采食量的70%(70%AL)和自由采食量的40%(40%AL)3个干物质采食水平饲喂,试验用基础饲粮为同一种全混颗粒饲料(表1)。
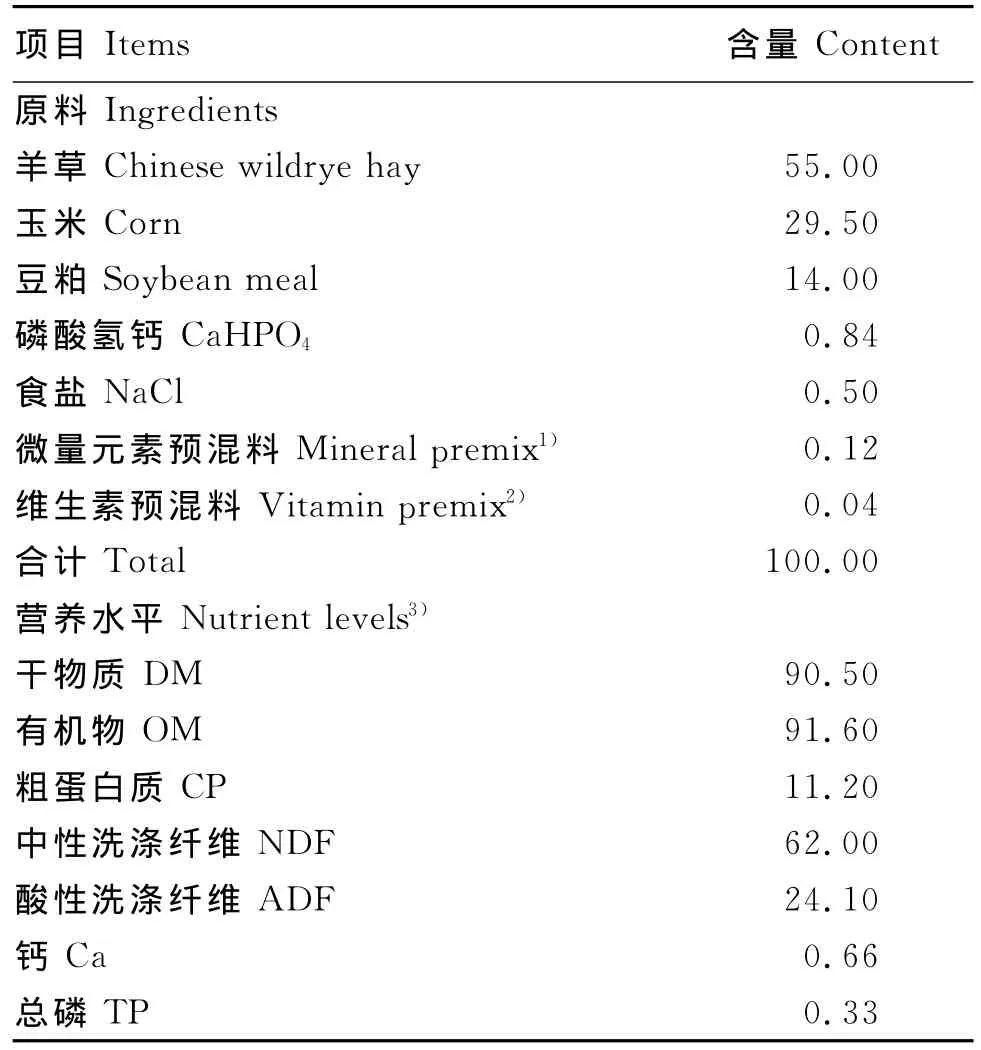
表1 基础饲粮组成及营养水平(干物质基础)Table 1 Composition and nutrient levels of the basal diet(DM basis) %
1.3 试验设计与饲养管理
试验采用单因子试验设计,将12只公羔随机分为3组,每组4只羊,每只羊为1个重复。试验共持续12d,其中预试期7d,正试期全收粪、尿法采样5d。试验开始前确定“自由采食量”,以AL组中羊只最低的干物质采食量定为“自由采食量”,从而确定70%AL组和40%AL组的干物质采食量。试验羊只单笼饲养,每天08:00饲喂1次,自由饮水。
1.4 测定指标与方法
1.4.1 样品采集与处理
正试期每天采集剩料样品,按羊只分别混合。每天全收粪并称重,采样时将粪样混匀,从不同位点取未受羊毛及尘土污染的部分取样,准确称取总粪量的10%并于自封袋中保存,每天按羊只分别混合后置于-20℃冰箱保存;每天全收尿并记录尿量,收尿前于桶中加入100mL 10%的稀硫酸,调整尿样pH至2~3,采样时先将尿样加自来水稀释至5L,后取20mL尿样于收尿瓶中保存,每天按羊只分别混合后置于-20℃冰箱保存。
1.4.2 测定方法及计算公式
饲料、粪样和尿样中的干物质、灰分、粗蛋白质测定采用常规方法分析[7]。PD采用分光光度计进行测定[8]。
营养物质采食量、消化率及氮平衡等指标计算公式如下:

1.5 数据处理
数据统计分析采用SAS 9.1的单因素方差分析(one-way ANOVA)进行显著性检验,并采用Duncan氏法进行多重比较,试验结果以平均值±标准差表示。
2 结 果
2.1 营养物质消化率和氮平衡
不同采食水平下肉羊营养物质消化率和氮平衡情况见表2。干物质、有机物、粗蛋白质采食量和DOMI随采食水平的降低而显著降低(P<0.05);干物质、有机物和粗蛋白质消化率随采食水平的降低而升高,其中干物质、有机物消化率在3组间存在显著差异(P<0.05),而粗蛋白质消化率只在AL组和40%AL组间存在显著差异(P<0.05)。随着采食水平的降低,摄入氮、粪氮和尿氮排出量均降低,其中摄入氮和粪氮排出量在3组间差异显著(P<0.05);尿氮排出量在70%AL组和40%AL组间差异不显著(P>0.05)。3个组的羊只均处于正氮平衡状态,沉积氮与摄入氮存在线性相关(R2=0.92;图1),沉积氮在3个组间差异显著(P<0.05);氮沉积率和氮吸收率均表现出相同的变化趋势,在70%AL组最高,分别为43.27%和64.92%,在40%AL组最低,分别为58.65%和37.56%,2组间差异显著(P<0.05)。

表2 不同采食水平下肉羊营养物质消化率和氮平衡情况Table 2 Nutrient digestibility and N balance of mutton sheep at different levels of feed intake
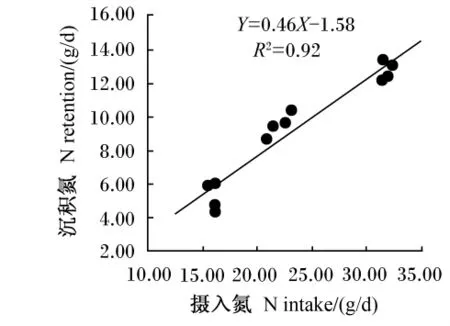
图1 不同采食水平下肉羊沉积氮与摄入氮的相关关系Fig.1 The correlation between N retention and N intake of mutton sheep at different levels of feed intake
2.2 PD和 MN
不同采食水平下羔羊PD排出量、PNI以及MN产量见表3。随采食水平的降低,尿囊素、尿酸、黄嘌呤+次黄嘌呤排出量均呈下降趋势,分别由14.76、2.52和1.54mmol/d降至6.33、1.70和0.93mmol/d,其中尿囊素排出量在3组间差异显著(P<0.05),尿酸、黄嘌呤+次黄嘌呤排出量只在AL组和40%AL组间存在显著差异(P<0.05)。尿囊素排出量占总排出量比例随采食水平的降低而降低,由78.54%降至70.68%,且在AL组和40%AL组间存在显著差异(P<0.05),尿酸、黄嘌呤+次黄嘌呤排出量占总排出量比例随采食水平的升高而升高,分别由13.37%和8.09%升至18.90%和10.42%,其中尿酸排出量占总排出量的比例仅在AL组和40%AL组间存在显著差异(P<0.05),黄嘌呤+次黄嘌呤排出量占总排出量的比例在AL组和70%AL组间差异不显著(P>0.05)。
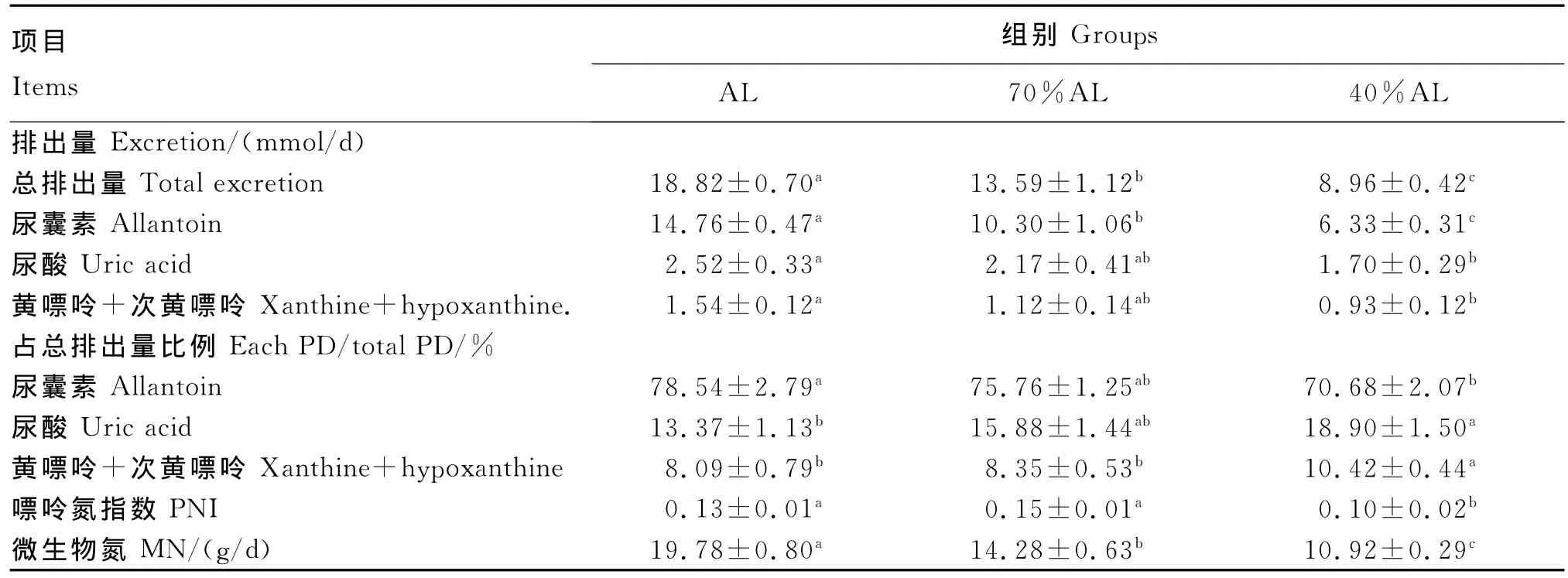
表3 不同采食水平下尿中嘌呤衍生物排出量、嘌呤氮指数以及微生物氮产量Table 3 Urinary excretion of PD,PNI,and MN yield of mutton sheep at different levels of feed intake
本试验中,PNI在AL组和70%AL组间差异不显著(P>0.05),但都与40%AL组存在显著差异(P<0.05),其中70%AL组的PNI最高,为0.15,而40%AL组的PNI最低,为0.10。MN在3组之间差异显著(P<0.05),其中AL组最高,40%AL组最低。随着DOMI水平和氮采食水平的下降,PD排出量也减少,PD排出量与DOMI和氮采食量间均存在着线性相关(图2、图3),相关方程分别为:Y=21.41 X-1.81(R2=0.94)和 Y=0.61 X-0.48(R2=0.95);另外,本试验中PD排出量与MN产量之间存在线性相关(图4),相关方程为:Y=0.91 X+2.57(R2=0.93)。

图2 不同采食水平下肉羊尿中嘌呤衍生物排出量与可消化有机物采食量的相关关系Fig.2 The correlation between urinary PD excretion and DOMI of mutton sheep at different levels of feed intake

图3 不同采食水平下肉羊尿中嘌呤衍生物排出量与摄入氮的相关关系Fig.3 The correlation between urinary PD excretion and N intake of mutton sheep at different levels of feed intake
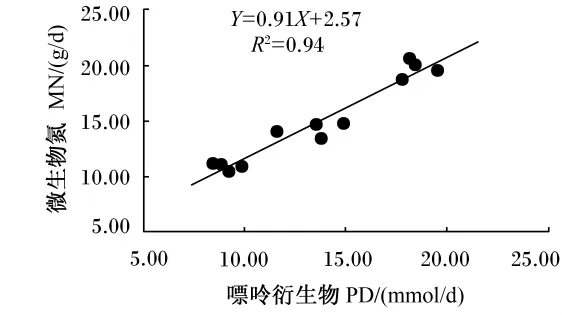
图4 不同采食水平下肉羊尿中嘌呤衍生物排出量与微生物氮产量的相关关系Fig.4 The correlation between urinary PD excretion and MN yield of mutton sheep at different levels of feed intake
3 讨 论
3.1 饲粮采食水平对营养物质消化率的影响
本试验中,饲粮干物质、有机物和粗蛋白质消化率变化范围分别为60%~66%、65%~71%和64%~66%,其中干物质和粗蛋白质消化率范围均低于Fernades等[11]在山羊上(分别为71%~75%和74%~81%)和 Galvani等[12]在绵羊上(分别为72%~74%和70%~73%)的报道,而有机物消化率则与Poshiwa等[13]在绵羊上的研究结果(64%~70%)较为接近。本试验中,随着饲粮采食水平的降低,营养物质消化率均呈上升趋势,与Fernades等[11]和 Galvani等[12]得 出的 结论相一致,而与Poshiwa等[13]得出的结论相反。理论上讲,当饲粮采食水平降低时,食糜的排空速度减慢,有利于营养物质被充分消化吸收,因此消化率会相应升高[13]。
3.2 饲粮采食水平对尿中PD排出量的影响
本试验中PD排出量为9.0~18.8mmol/d,在欧洲绵羊的PD排出量范围(6.4~22.6mmol/d)之内[14-15],尿囊素为主要的 PD,尿酸次之,黄嘌呤+次黄嘌呤排出量最低,与Lindberg[16]和 Puchala等[17]的 报 道 一 致;尿 囊 素、尿酸、黄嘌呤+次黄嘌呤排出量占总排出量的比例平均值分别为74.99%、16.05%和8.95%,均处于Chen等[8]报道的绵羊尿中尿囊素、尿酸、黄嘌呤+次黄嘌呤占总排出量的比例范围(分别为60%~80%、10%~30%和5%~10%)之内;随饲粮采食水平的下降,绵羊尿中尿囊素排出量占PD排出量的比例逐渐降低,而尿酸、黄嘌呤+次黄嘌呤排出量占PD排出量的比例逐渐升高,这与Chen等[18]得出的报道一致。
研究发现反刍动物PD排出量与DOMI呈线性相关,方程的斜率表示单位DOMI的PD排出量,本试验中得出肉羊PD排出量与DOMI存在线性相关(R2=0.94),方程斜率为21.41,高于Poshiwa等[13]在绵羊(2.97)和山羊(5.86)上建立的回归方程的斜率,这可能与羊的品种以及饲粮成分有关。通过延长回归直线得到的内源PD排出量为-1.81mmol/d,该值低于 Poshiwa等[13]在绵羊上得到的内源 PD(0.15mmol/d),但高于其在山羊上得到的内源PD(-0.33mmol/d)。对于羊来说,通过延长PD排出量和DOMI的回归直线得到的内源PD排出量并不能代表其真实内源PD排出量,这是因为随着DOMI升高,PD排出量也相应升高,而内源PD则会逐渐降低,当PD排出量高于0.6mmol/kg BW0.75时,内源 PD 则可以忽略不计[18],因此羊的内源PD并非一个恒定值,会随着饲粮采食情况的变化而变化。
3.3 氮平衡和尿中PD排出量的关系
瘤胃微生物的生长需要饲粮提供氮源,因此饲粮氮摄入水平会影响瘤胃微生物生长效率和蛋白质合成情况,进而影响PD的排出量[19]。本试验中,当 饲 粮 氮 摄 入 量 由 31.80g/d 降 至16.39g/d时,对 应 的 PD 排 出 量 则 由18.82mmol/d降至8.96mmol/d,两者之间存在线性相关(R2=0.95)。在消化过程中,饲粮氮在瘤胃中转化成氨,其中一部分被用于瘤胃微生物合成蛋白质,而过量的氨则会被瘤胃壁吸收并最终从尿中排出,如果MCP合成量增加,则尿中排出的氮量就会相应减少,而由于PD能够估测MCP合成量,因此可以用以PD形式排出的氮量与尿中总氮排出量的比值来表示饲粮摄入氮的利用情况[20]。PNI受到动物品种以及饲粮组成等因素的影响,本试验中PNI变化范围为0.10~0.15,在另一试验中,Geoger等[9]报道山羊的PNI变化范围为0.208~0.350,但本试验和上述作者试验中的PNI与氮沉积率和氮吸收率均表现出相同的变化趋势,说明PNI能够将氮平衡和PD排出量有机结合起来,用于评价饲粮氮的利用效率。
4 结 论
肉羊PD排出量与DOMI和氮采食量均存在线性相关,相关方程分别为Y=21.41 X-1.81(R2=0.94)和 Y=0.61 X-0.48(R2=0.95);PNI能够将氮平衡和PD排出量有机结合起来,用于评价饲粮氮的利用效率。
[1] ARC.The nutrition of goats[M].New York:CAB International,1998:7-64.
[2] CSIRO.Nutrient requirements of domesticated ruminants[M].Collingwood,Australia:CSIRO Publishing,2007:296.
[3] NRC.Nutrient requirements of small ruminants:sheep,goats,cervids and new world camelids[S].Washington,D.C.:National Academy Press,2007:384.
[4] AFRC.Nutritive requirements of ruminant animals[S].[S.l.]:Commonwealth Agricultural Bureaux Slough,1992:787-835.
[5] BRODERICK G A,MERCHEN N R.Markers for quantifying microbial protein synthesis in the rumen[J].Journal of Dairy Science,1992,75(9):2618-2632.
[6] 杨膺白,梁贤威,郭辉,等.山羊尿中嘌呤衍生物排出规律的研究[J].黑龙江畜牧兽医,2011(1):64-66.
[7] AOAC.Official methods of analysis[S].Washington,D.C.:Association of Official Analytical Communities,1990.
[8] CHEN X B,GOMES M J.Estimation of microbial protein supply to sheep and cattle based on urinary excretion of purine derivatives.An overview of the technical details[C]//Estimation of microbial protein supply based on purine derivative excretion.Bucksburn:Rowett Research Institute,1995.
[9] GEORGE S K,VERMA A K,MEHRA U R,et al.Nitrogen utilization in goats fed various oil cakes[J].Archiva Zootechnica,2011,14(2):76-91.
[10] ARC.The nutrient requirements of ruminant livestock[S].Slough:Commonwealth Agricultural Bureaux,1984.
[11] FERNANDES M H M R,RESENDE K T,TEDESCHI L O,et al.Energy and protein requirements for maintenance and growth of Boer crossbred kids[J].Journal of Animal Science,2007,85(4):1014-1023.
[12] GALVANI D B,PIRES C C,KOZLOSKI G V,et al.Protein requirements of Texel crossbred lambs[J].Small Ruminant Research,2009,81(1):55-62.
[13] POSHIWA X,NGONGONI N T,MANYUCHI B,et al.The effect of plane of nutrition on the urinary purine derivative excretion in sheep and goats[C]//MAKKAR,H P S,CHEN X B.Estimation of microbial protein supply in ruminants using urinary purine derivatives.Dordrecht:Kluwer Academic Publishers,2004:140-148.
[14] LINDBERG J E,JACOBSSON K G.Nitrogen and purine metabolism at varying energy and protein supplies in sheep sustained on intragastric infusion[J].British Journal of Nutrition,1990,64:359-370.
[15] CHEN X B,MEJIA A T,ORSKOV E R,et al.Evaluation of the use of the purine derivative:creatinine ratio in spot urine and plasma samples as an index of microbial protein supply in ruminants:studies in sheep[J].Journal of Agriculture and Science of Cambridge,1995,125:137-143.
[16] LINDBERG J E.Nitrogen metabolism and urinary excretion of purines in goat kids[J].British Journal of Nutrition,1989,61:309-321.
[17] PUCHALA R,KULASEK G W.Estimation of microbial nucleic acids and urinary excretion of purine derivatives[J].Canadian Journal of Animal Science,1992,72:821-830.
[18] CHEN X B,HOVELL F D D,ØRSKOV E R,et al.Excretion of purine derivatives by ruminants:effect of exogenous nucleic acid supply on purine derivative excretion by sheep[J].British Journal of Nutrition,1990,63(1):131-142.
[19] 李丽莉,梁坤,韦升菊,等.不同日粮采食水平对青年母水牛尿中嘌呤衍生物排出规律的影响研究[J].黑龙江畜牧兽医,2009,12:11-14.
[20] SUBBA D B.Purine nitrogen index,apotentially parameter for rapid feed evaluation in ruminants[D].Ph.D thesis.Aberdeen:University of Aberdeen,1997.

