组织因子在翼状胬肉中的表达
李景翠 张雪菲
翼状胬肉是一种常见的眼表疾病,其发病机制至今尚未完全明确,与肿瘤具有相似性。翼状胬肉是具有增殖性、侵袭性和高度血管化的组织[1],而且翼状胬肉中存在变异细胞,这也是肿瘤的特性之一[2]。Kase等[3-4]研究表明,翼状胬肉表皮细胞与正常结膜细胞相比具有非常强的增殖活性。血管内皮生长因子(vascular endothelial growth factor,VEGF)是目前已知的在新生血管形成过程中起主要作用的刺激因子,其能刺激血管内皮细胞增殖、迁移,增加血管的通透性,诱导毛细血管管腔形成,而其在翼状胬肉中的作用也已得到证实[5]。有研究报道,在肿瘤组织中组织因子(tissue factor,TF)能上调VEGF的表达[6]。TF是一种跨膜糖蛋白,能与凝血因子Ⅶ(FⅦ)结合后激活凝血通路,这种相互作用能触发细胞内的信号,并由G蛋白偶联蛋白酶激活受体与黏附因子和其他因子介导[7]。TF受致癌性和分化途径的调节,在肿瘤发生、生长、血管生成和转移中发挥作用[7-9]。本实验的目的是应用免疫组织化学法检测TF在初发型进展期翼状胬肉组织及正常球结膜组织中的表达。
1 材料与方法
1.1 材料来源 收集我院眼科翼状胬肉患者手术切除的标本30例,均为初发型进展期,其中男16例、女14例;平均年龄54.8岁。选取20例正常的眼结膜组织作为对照,男女各10人,平均年龄53.0岁。眼科检查排除沙眼、睑缘炎、过敏性结膜炎及其他眼表疾病。初发进展期翼状胬肉:结膜及结膜下组织增生肥厚,呈三角形侵入角膜,既往未进行翼状胬肉切除。正常眼结膜组织取自白内障与斜视及单纯孔源性视网膜脱离复位手术患者鼻侧球结膜(均征得患者同意)。
1.2 主要试剂及仪器 试剂:兔抗人TF多克隆抗体、SABC免疫组织化学染色试剂盒;DAB试剂盒(均购买自武汉博士德生物工程有限公司)。仪器:烤箱、高压锅、冰箱、光学显微镜等。
1.3 标本处理与切片 标本经体积分数10%甲醛液固定24 h后取材,常规脱水,石蜡包埋,切片,60℃烘片后,45℃烘箱保存6 h。标本经苏木精-伊红染色,于光学显微镜下观察翼状胬肉与人正常球结膜标本的组织学表现。
1.4 SABC法免疫组织化学染色 处理好的切片脱蜡至水,体积分数3%H2O2室温10 min以灭活内源性酶。蒸馏水洗2 min×3次。高压锅抗原修复后,50 g·L-1BSA(封闭液)试剂室温封闭20 min,滴加一抗(兔抗人TF多克隆抗体,其工作浓度1∶200),阴性对照:用0.01 mol·L-1PBS液替代一抗,4℃冰箱过夜。滴加二抗:聚合HRP标记抗兔IgG,最后用DAB光镜下显色并观察,流水终止染色。苏木素轻度复染、脱水,透明,封片、观察。镜下细胞内有黄染颗粒即为阳性,不着色为阴性。每张切片在高倍显微镜下(200倍)随机选择5个视野,计算每个视野阳性细胞表达率,取平均值作为该标本的阳性细胞表达率。TF表达结果分为:阴性(-):无阳性细胞;弱阳性(+):阳性细胞表达率小于50%;强阳性(++):阳性细胞表达率大于50%。
1.5 统计学方法 本研究数据采用SPSS 11.7软件进行统计学处理。计数资料用百分率表示,组间比较采用χ2检验,以P<0.001为差异有统计学意义。
2 结果
TF在翼状胬肉组织的表达定位于上皮细胞胞质(图1),在翼状胬肉中的阳性细胞表达率为86.67%(26/30)。在正常结膜组织上皮细胞中无表达或呈弱阳性表达(图2),其阳性细胞表达率为15.00%(3/20)。在正常结膜组织和初发翼状胬肉组织中,TF表达差异有统计学意义(χ2=25.301,P<0.001;见表1)。

表1 TF在翼状胬肉及正常结膜组织中的表达Table 1 Expression of TF in primary pterygium and normal conjunctiva
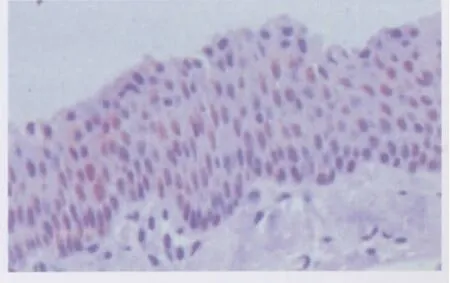
Figure 1 The positive expression of TF in pterygium(×400)TF在翼状胬肉中阳性表达(×400)
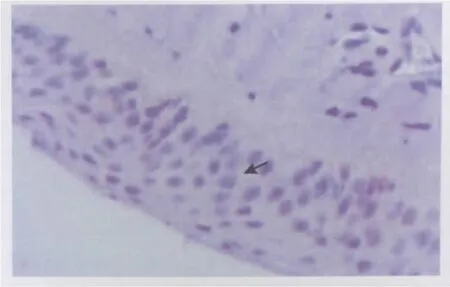
Figure 2 The negative expression of TF in normal conjunctiva(× 400)TF在正常结膜组织中阴性表达(×400)
3 讨论
TF是相对分子质量为47 000的跨膜糖蛋白受体,由263个氨基酸残基构成,结构域可分为3段: 1~219位氨基酸构成胞外区,220~242位氨基酸构成跨膜区,243~263位氨基酸残基构成胞内区。TF是血液中FⅦ的膜受体,正常血管内皮细胞表面并不表达TF蛋白,而在肿瘤组织中,TF常在肿瘤细胞及肿瘤新生血管内皮细胞表面高表达。由于肿瘤血管结构的不完整,肿瘤细胞表面高表达的TF容易与血液中的FⅦ结合,从而引发临床肿瘤患者各种与凝血异常相关的疾病[10]。FⅦa/TF诱导的信号途径具有多样性,它激活诱导的细胞内信号在很大程度上随细胞类型不同而有差别,但总的来说FⅦa/TF诱导的细胞内信号分别或协同参与了TF相关的血管生成、肿瘤细胞侵袭、转移和生长[11]。
肿瘤的侵袭和转移是多步骤、多阶段的过程,细胞外基质(extracellular matrix,ECM)的降解是肿瘤转移的重要前提。ECM中起降解作用的蛋白酶主要有纤溶酶原激活物(plasminogen activator,PA)、基质金属蛋白酶(matrix metalloproteinases,MMP)及组织蛋白酶。PA分为尿激酶型纤溶酶原激活物(u-PA)和组织型纤溶酶原激活物(t-PA)。PA可以激活纤溶酶原,使其转化为有活性的纤溶酶。纤溶酶具有高度的蛋白水解活性,能够降解ECM成分,从而促进肿瘤的局部浸润和转移[12]。肿瘤细胞表面TF介导凝血途径活化生成凝血酶,凝血酶可以上调u-PA和t-PA的表达[13],从而起到降解ECM的作用,促进肿瘤侵袭和转移。MMP是一类蛋白水解酶,是目前所知的最重要的基质降解酶类之一。MMP主要的生理功能是降解ECM成分,如胶原、明胶、弹性蛋白、纤连蛋白和蛋白聚糖等[14]。降解ECM、突破基底膜是肿瘤血管生成、侵袭和转移的重要环节,MMP是参与该过程的重要的蛋白水解酶,是一种重要的肿瘤侵袭转移相关因子[15],TF通过细胞内配体ABP280的募集并与TF结合,造成皮质层肌动蛋白的重新聚合,而细胞骨架成分,如肌动蛋白的多聚可产生细胞内信号并调节MMP表达[16],从而增强肿瘤降解基质的能力。而 u-PA与 MMP1、MMP2、MMP3、MMP7、MMP8、MMP9、MMP10在翼状胬肉中的表达已经证实,u-PA对 MMP形成有促进作用[17-21]。TF受分化途径影响,能在具有间质特点的上皮肿瘤细胞中高表达。有研究表明,TF与肿瘤细胞的上皮细胞间质转化(epithelial-mesenchymal transition,EMT)有关,并在其发展中起作用[5]。EMT是具有极性的上皮细胞转化成具有活动能力、能够在ECM间自由移动的间质细胞的过程,它以上皮细胞极性的丧失及间质特性的获得为重要特征[22]。这种表型的转化可以使肿瘤细胞摆脱细胞与细胞间的连接,表现得更具侵袭性。而EMT是翼状胬肉进展的主要因素,EMT标志性改变在翼状胬肉上皮细胞可以找到[23]。因此,我们推测TF在翼状胬肉的发病机制中可能也起了一定的作用。
在本实验中,我们运用免疫组织化学的方法证实了TF在翼状胬肉组织中有表达,而且主要表达在翼状胬肉上皮细胞,其阳性表达率为76.67%,在正常眼结膜组织上皮细胞中阳性表达率15.00%。本结果表明,TF在翼状胬肉的发病机制中可能起了一定的促进作用,选择性的TF抑制剂有可能成为治疗翼状胬肉的新靶点。
1 Gebhardt M,Mentlein R,Schaudig U,Pufe T,Recker K.Differential expression of vascular endothelial growth factor implies the limbal origin of pterygia[J].Ophthalmology,2005,112(6): 1023-1030.
2 Spandidos DA,Sourvinos G,Kiaris H,Tsamparlakis J.Microsatellite instability and loss of heterozygosity in human pterygia[J].Br J Ophthalmol,1997,81(6):493-496.
3 Kase S,Takahashi S,Sato I,Nakanishi K,Yoshida K.Expression of p27(KIP1)and cyclin D1,and cell proliferation in human pterygium[J].Br J Ophthalmol,2007,91(7):958-961.
4 Kase S,Osaki M,Sato I,Takahashi S,Nakanishi K.Immunolocalisation of E-cadherin and beta-catenin in human pterygium[J].Br J Ophthalmol,2007,91(9):1209-1212.
5 Lee DH,Cho HJ,Kim JT,Choi JS,Joo CK.Expression of vascular endothelial growth factor and inducible nitric oxide synthase in pterygia[J].Cornea,2001,20(7):738-742.
6 Bluff JE,Amarzguioui M,Slattery J,Reed MW,Brown NJ.Antitissue factor short hairpin RNA inhibits breast cancer growth in vivo[J].Breast Cancer Res Treat,2011,128(3):691-701.
7 Milsom CC,Yu JL,Mackman N,Micallef J,Anderson GM.Tissue factor regulation by epidermal growth factor receptor and epithelial-to-mesenchymal transitions:effect on tumor initiation and angiogenesis[J].Cancer Res,2008,68(24):10068-10076.
8 Rickles FR.Mechanisms of cancer-induced thrombosis in cancer[J].Pathophysiol Haemost Thromb,2006,35(1-2):103-110.
9 Ruf W,Fischer EG,Huang HY,Miyagi Y,Ott I.Diverse functions of protease receptor tissue factor in inflammation and metastasis[J].Immunol Res,2000,21(2-3):289-292.
10 Yu JL,May L,Lhotak V,Shahrzad S,Shirasawa S,Weitz JI,et al.Oncogenic events regulate tissue factor expression in colorectal cancer cells:implications for tumor progression and angiogenesis[J].Blood,2005,105(4):1734-1741.
11 Fernandez PM,Rickles FR.Tissue factor and angiogenesis in cancer[J].Curr Opin Hematol,2002,9(5):401-406.
12 Francis JL,Biggerstaff J,Amirkhosravi A.Hemostasis and malignancy[J].Semin Thromb Hemost,1998,24(2):93-109.
13 Hayakawa Y,Tazawa S,Ishikawa T,Niiya K,Sakuraqawa N.Transcriptional regulation of tissue and urokinase-type plasmlnogen actlvator genes by thrombin in human fetal lung fibroblasts[J].Thromb Haemost,1995,74(2):704-710.
14 Shapiro SD.Matrix metalloproteinase degradation of extracellular matrix:biological consequences[J].Curr Opin Cell Biol,1998,10(5):602-608.
15 Engers R,Cabbert HE.Mechanisms of tumor metastasis:cell biological aspects and clinical implications[J].J Cancer Res Clin Oncol,2000,126(12):682-692.
16 Ott I,Fischer EG,Miyaqi Y,Mueller BM,Ruf W.A role for tissue factor in cell adhesion and migration mediated by interaction with actin-binding protein 280[J].J Cell Biol,1998,140(5): 1241-1253.
17 Girolamo ND,Wakefield D,Coroneo MT.Differential expression of matrix metalloproteinases and their tissue inhibitors at the advancing pterygium head[J].Invest Ophthalmol Vis Sci,2000,41(13):4142-4149.
18 Di Girolamo N,McCluskey P,Lioyd A,Coroneo MT,Wakefield D.Expression of MMPs and TIMPs in human pterygia and cultured pterygium epithelial cells[J].Invest Ophthalmol Vis Sci,2000,41(3):671-679.
19 Yang SF,Lin CY,Yang PY,Chao SC,Ye YZ,Hu DN.Increased expression of gelatinase(MMP2 and MMP9)in pterygia and pterygium fibroblast with disease progression and activation of protein kinase C[J].Invest Ophthalmol Vis Sci,2009,50(10): 4588-4596.
20 Tsai YY,Chiang CC,Yeh KT,Lee H,Cheng YW.Effect of TIMP-1 in pterygium invasion[J].Invest Ophthalmol Vic Sci,2010,51 (7):3462-3467.
21 Chao SC,Hu DN,Yang PY,Lin CY,Yang SF.Overexpression of urokinase-type plasminogen activator in pterygia and pterygium fibroblasts[J].Mol Vis,2011,6(17):23-31.
22 Thiery JP.Epithelial-mesenchymal transitions in tumor progression[J].Curr Opin Cell Biol,2003,15(6):740-746.
23 Kato N,Shimmura S,Kawakita T,Miyashita H,Ogawa Y.Betacatenin activation and epithelial-mesenchymal transition in the pathogenesis of pterygium[J].Invest Ophthalmol Vis Sci,2007,48(4):1511-1517.

