腺病毒与慢病毒载体转染离体兔角膜基质细胞的有效性对比研究
兰 芬 杜之渝 黄 正 吴宁玲
随着准分子激光角膜屈光手术方式由表及里而后又逐渐回归到表面切削,各种角膜表面屈光手术均不能完全避免角膜Haze的发生,因此,寻找一种新的安全有效的防治角膜Haze的方法意义重大,而基因治疗为角膜Haze的防治带来了新希望[1-2]。本研究通过比较腺病毒载体(adenovirus vector,AV)与新型慢病毒载体(lentivirus vector,LV)介导增强型绿色荧光蛋白(enhanced green fluorescent proteins,EG-FP)报告基因转染离体兔角膜基质细胞(rabbit corneal stroma cells,RCSC)的有效性,探讨较优一种病毒载体转染角膜基质细胞(corneal stroma cells,CSC)的可行性,为下一步依靠此载体介导目的基因转染角膜基质,抑制CSC增生及其相关的动物活体实验提供一定的实验基础。
1 材料与方法
1.1 材料
1.1.1 实验动物及主要试剂 健康新西兰大白兔6只,雌雄兼用,体质量为1.8~2.5 kg。LV-EGFP及AV-EGFP购于北京本元正阳基因技术股份有限公司;DMEM/F12培养基购自美国Hyclone公司;胎牛血清购自杭州四季青生物工程公司;鼠抗兔波形纤维蛋白一抗和羊抗小鼠IgG-FITC二抗购于武汉博士德生物工程有限公司。
1.1.2 主要仪器设备 超净工作台、细胞培养恒温箱、倒置荧光显微镜均由眼科学重庆市市级重点实验室提供;流式细胞仪由重庆医科大学生命科学院提供。
1.2 实验方法
1.2.1 RCSC的培养和鉴定 无菌条件下取出兔眼球,剪下角膜组织,然后分离出基质层,剪成10~20小块(大小约2 mm×2 mm)放入培养瓶中培养,待细胞融合后按1∶3传代。取原代和传代细胞按细胞密度为10×106L-1制备细胞爬片,然后应用细胞免疫荧光化学方法对培养细胞进行鉴定。
1.2.2 细胞转染 把浓度为20×106L-1的RCSC悬液接种于24孔培养板中,每孔500 μL,培养过夜。第2天取出,弃培养液,用PBS冲洗3次,然后将AV-EGFP与LV-EGFP按感染复数(即MOI)=0、1、10、50、100、500、1000、10×103用空白培养基稀释后加入培养板中(MOI是指每个细胞感染的病毒数,其中MOI=0为对照组,加入等量的空白培养基),每孔200 μL。培养6 h后换新鲜完全培养基(含体积分数10%胎牛血清500 μL)常规培养,在转染后24 h、48 h、72 h,倒置荧光显微镜下观察RCSC中EGFP的表达情况并拍照。
1.2.3 流式细胞仪检测细胞转染率 取0.1×109L-1的传2代细胞悬液1 mL接种于无菌培养瓶中,按照MOI=0、1、10、50、100、500、1000、10×103的上述方法分别转染细胞,转染后72 h取出,用胰酶消化后离心,加入PBS液制成细胞悬液,送流式检测。
1.3 统计学方法 转染率数据以均数±标准差表示,采用SPSS 16.0统计软件对计量资料进行小样本均数t检验及方差分析,对组间两两比较采用SNK两两比较分析,P<0.05为差异有统计学意义。
2 结果
2.1 细胞培养及鉴定结果 RCSC多呈长梭形,整体亦呈放射状或螺旋状,生长较快,一般3~5 d融合(图1)。细胞鉴定结果:RCSC胞浆中特异性表达波形纤维蛋白,胞浆发亮绿色荧光,细胞核呈圆形或椭圆形,不发亮荧光(图2)。
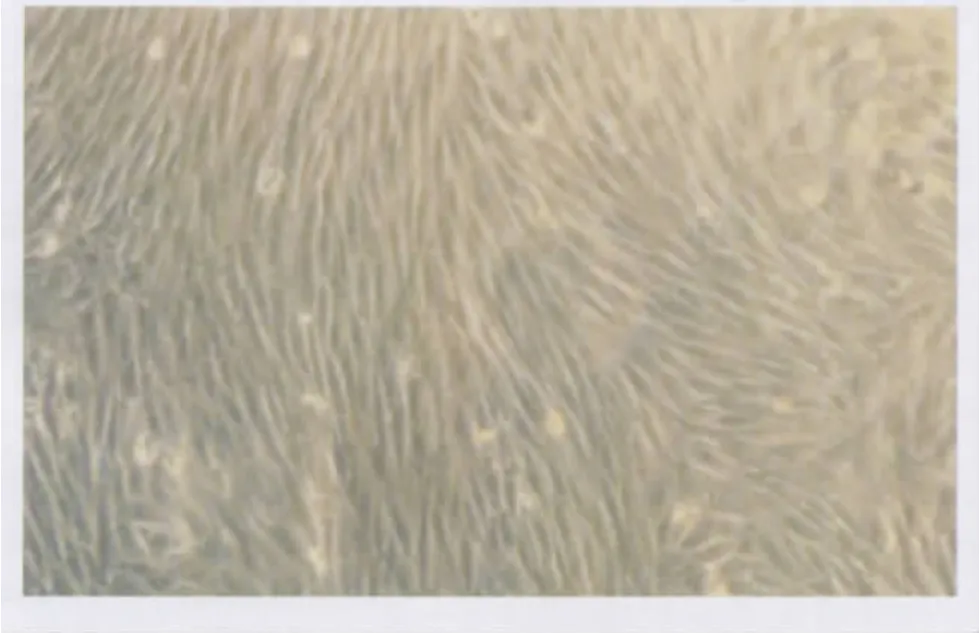
Figure 1 The condition of subculturing RCSC at the 5th day(× 50)RCSC传代培养第5天生长情况(×50)
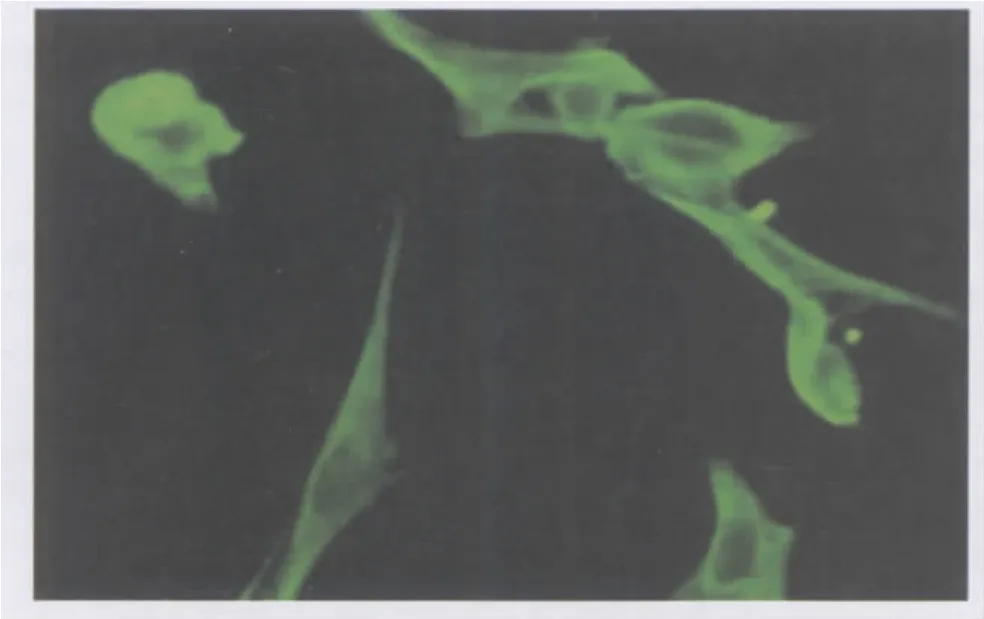
Figure 2 Positive expression of Vimentin in cytoplasm of RCSC(× 200) 波形纤维蛋白在RCSC胞浆阳性表达(×200)
2.2 转染结果
2.2.1 倒置荧光显微镜下观察转染起效时间及EGFP在RCSC的表达 AV-EGFP转染RCSC从24~48 h开始可见明显的绿色荧光,LV-EGFP转染RCSC 48 h后开始见绿色荧光,晚于AV-EGFP转染组。倒置荧光显微镜下观察EGFP在细胞中表达呈绿色或黄绿色,弥漫整个胞浆和胞核,细胞起始表达强度不一,随着时间延长及感染复数增强表达亦增强,对照组未见绿色荧光表达(图3-图4)。
2.2.2 流式细胞仪检测两组RCSC转染率结果转染后72 h流式细胞仪检测转染率结果与上述观察结果一致。LV-EGFP转染组在MOI≤1000时,随着MOI值增大,检测到的细胞转染率逐渐增大,两两比较差异均有统计学意义(均为P<0.05,见表1);在MOI=10×103与MOI=1000时,差异无统计学意义(P>0.05),说明LV-EGFP转染组在MOI为1000与10×103时对RCSC的转染率无差别,在MOI=1000时可达有效转染。在AV-EGFP转染组中,MOI=1与MOI=10时转染率比较,差异无统计学意义(P> 0.05),说明当感染复数为1与10时,AV-EGFP转染RCSC后72 h转染率无差别;MOI>10时,随着MOI值增大,检测到的细胞转染率逐渐增大,两两比较差异均有统计学意义(均为P<0.05,见表1)。
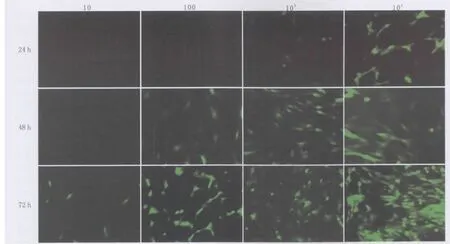
Figure 3 The expression of EGFP in RCSC at different MOI and different time points in AV-EGFP transfective groups(×50)AV-EGFP转染组在不同感染复数与不同时间时EGFP在RCSC中的表达(×50)
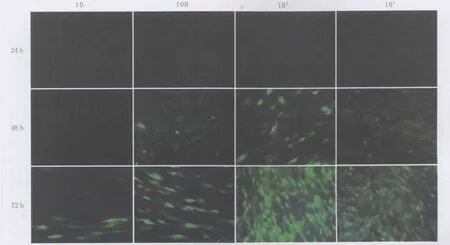
Figure 4 The expression of EGFP in RCSC at different MOI and different time point in LV-EGFP transfective groups(×50)LV-EGFP转染组在不同感染复数与不同时间时EGFP在RCSC中的表达(×50)
转染后72 h在同一MOI值下,当MOI=1时,AV-EGFP转染组与LV-EGFP转染组比较差异无统计学意义(P=0.35),说明在极低浓度下,两病毒载体均不能有效转染RCSC。当1000≥MOI>1时,AV-EGFP与LV-EGFP转染组比较,LV-EGFP转染效率明显高于AV-EGFP转染组,差异均有统计学意义(均为P<0.05,见表1)。
3 讨论
本研究在国内首次采用LV转染离体RCSC,并与AV进行比较,观察两病毒载体用于转染RCSC的可行性,本研究表明,LV与AV均能有效转染RCSC,且在同一感染复数下(MOI>1),LV转染RCSC的效率要高于AV。
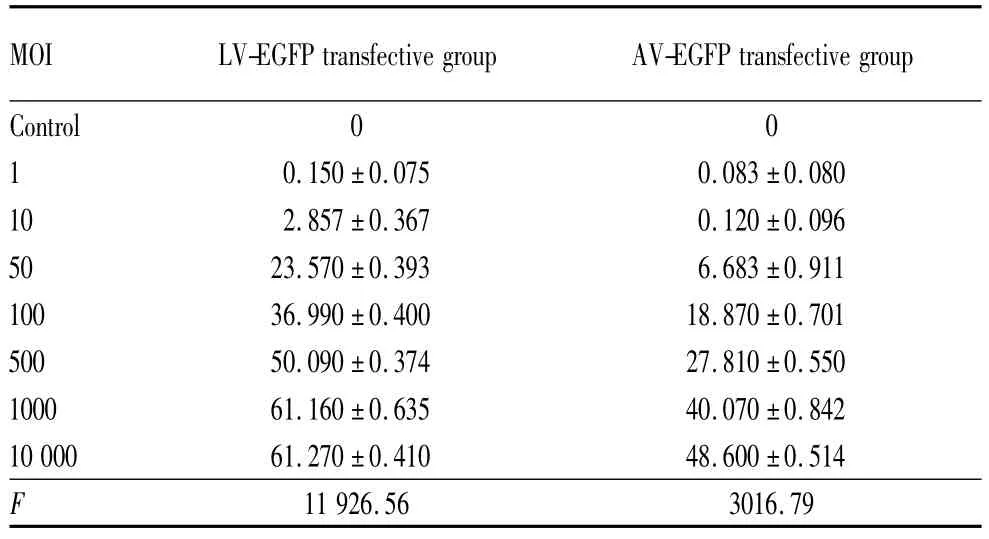
表1 流式细胞仪检测两组转染72 h细胞转染率Table 1 The transfection efficiency of transfective group and contrast group by flow cytometry (rate/%)
本研究显示,各转染组细胞起始表达荧光的时间及强度不一致,AV-EGFP组转染起始时间早于LV-EGFP组,可能是由于两种病毒载体各自的转染机制不同所形成。LV基因组是单链RNA,其基因组进入细胞后,在细胞浆中被其自身携带的逆转录酶逆转录为双链DNA,形成DNA整合前复合体,进入细胞核后,DNA整合到细胞基因组中,整合后的DNA转录mRNA,回到细胞浆中,表达目的蛋白[3]。而AV的基因组是双链DNA,其基因组进入细胞后,通过核孔直接将DNA释放到细胞核内,其基因组不整合到宿主细胞基因组中,而是自我进行一系列复杂有序的剪切和转录过程,并回到胞浆中表达目的蛋白[4],可能是由于AV未进行逆转录,也未将目的基因整合入宿主细胞基因组,故转染起效时间早于LV。
本研究显示,在同一MOI值(MOI>1)下AV的转染效率要明显低于LV,原因如下:(1)病毒载体要进入细胞,多数通过病毒与细胞表面的特定受体相结合。腺病毒感染也是通过受体介导的,腺病毒衣壳的球部对柯萨奇/腺病毒受体(coxsackie and adenovirus receptor,CAR)具有高亲和力,而上皮细胞可高表达CAR受体,因此,AV对上皮细胞有较高的感染率,具有嗜上皮性。有研究证实,AV对视网膜色素上皮细胞的转染率可达到100%[5]。Ulasov等[6]发现恶性胶质瘤细胞上缺乏Ad5的主要受体CAR,而Ad3受体CD46过表达,于是构建了Ad5/3嵌合体,明显增加了转染率及靶向性,提高了Ad5介导的胶质瘤基因治疗疗效。也有研究报道腺病毒对一些细胞表面,尤其是成熟肌细胞表面缺少腺病毒受体,从而影响AV转染的效率和靶向性[7]。而我们观察到AV对RCSC未体现其高转染率的优越性,可能与RCSC表面相关受体种类有关。(2)当外源基因进入细胞后,只有在适宜的启动子及调控基因作用下细胞才开始表达基因产物。常用的启动子为CMV启动子、SV40启动子和组织特异性启动子。而靶细胞的特异性启动子可使病毒载体保持相对稳定高效及特异的表达功能。有文献报道角蛋白-12启动子在体外实验中可在角膜细胞表达[8],而不在成纤维细胞表达,角蛋白-12/角蛋白-3启动子可在角膜上皮、基质和内皮细胞中表达,而不在其他细胞中表达。因此,我们推断AV转染RCSC效率低可能还与RCSC内特异性启动子种类与含量多少有关。
由于细胞生长受限,无法观察比较两种病毒载体转染后表达持续时间。有报道AV转染目的基因在动物活体上可持续表达约28 d[9],LV转染目的基因至眼部虹膜内可持续表达约90 d[10],而对于RCSC来说,两种病毒载体究竟能够持续稳定表达多久,我们在后续动物活体实验中将进行深入研究。同时,一种理想的基因载体除了能够有效地转染靶细胞外,还要求对靶细胞无毒副作用,因此,两种病毒载体用于CSC的转染安全性还有待深入研究探讨。
1 Klausner EA,Peer D,Chapman RL,Multack RF,Andurkar SV.Corneal gene therapy[J].J Control Release,2007,124(3):107-133.
2 李 臻,赵 敏.角膜病基因治疗的研究进展[J].中国实用眼科杂志,2006,24(4):345-348.
3 罗 望,张 泓,许 淼,顾 林,孙倍成.慢病毒-基因转移的潜在新载体[J].江苏药学与临床研究,2006,14(6):366-371.
4 范凌云,谢庆军.腺病毒载体的研究进展[J].中国生物制品学杂志,2008,21(2):153-157.
5 张关霞,吴 静,辛 梅,张军军,闫乃红,严 密,等.腺病毒介导人内皮抑素感染视网膜色素上皮细胞的可行性研究[J].眼视光学杂志,2009,11(4):265-268.
6 Ulasov IV,Tyler MA,Zheng S,Han Y,Lesniak MS.CD46 represents a target for adenoviral gene therapy of malignant glioma[J].Hum Gene Ther,2006,17(5):556-564.
7 Bramson JL,Grinshtein N,Meulenbroek RA,Lunde J,Kottachchi D,Lorimer IA,et al.Helper-dependent adenoviral vectors containing modified fiber for improved transduction of developing and mature muscle cells[J].Hum Gene Ther,2004,15(2):179-188.
8 刘宏伟,王香兰.外源基因在角膜中表达及基因治疗[J].眼科研究,2001,19(1):84-86.
9 Oral HB,Larkin DF,Fehervari Z,Byrnes AP,Rankin AM,Haskasd DO,et al.Ex vivo adenovirus-mediated gene transfer and immunomodulatory protein production in human cornea[J].Gene T-her,1997,4(7):639-647.
10 Stout JT.Gene transfer for the treatment of neovascular ocular disease[J].Trans Am Ophthalmol Soc,2006,104(4):530-560.

