葡萄糖氧化酶的有机相共价固定化
周涛,朱雄军,苏建华,姚冬生,刘大岭
1 暨南大学生命科学技术学院微生物技术研究所,广东 广州 510632
2 广东省生物工程药物重点实验室,广东 广州 510632
葡萄糖氧化酶 (Glucose oxidase,GOD) 属于氧化还原酶类 (EC 1.1.3.4),能专一性地将β-D-葡萄糖氧化成D-葡萄糖酸和过氧化氢,广泛存在于动、植物和微生物体内。该酶在食品、饮品发酵、饲料工业、医药卫生等方面有重要的应用价值。
酶是一类重要的高效生物催化剂,但是由于酶的不稳定性问题使其在工业应用和商业生产中受到限制。因此,众多学者尝试用固定化和化学修饰[1-2]的方法来提高酶的稳定性,其中共价结合法是目前研究最多的固定化方法之一[3]。固定化酶与载体结合牢固,即使在高底物浓度和高离子强度情况下,也不会导致酶与载体解离,因而具有良好的稳定性和重复使用性[4],广泛应用于生物医药、环境保护、食品卫生和轻纺化工等各个领域。但是,由于共价结合反应剧烈,酶在固定化过程中活性中心或者变构中心的构象发生不可逆的变化,导致酶与底物的结合能力及活性下降,一定程度上限制了酶的共价固定化技术的应用。
本文尝试利用蛋白质在有机溶剂中的“刚硬”特点,在有机相中对GOD进行共价固定化,考察有机相环境帮助GOD克服共价固定化过程中发生的化学反应引起的构象变化而导致酶失活的现象。
1 材料与方法
1.1 材料与试剂
葡萄糖氧化酶:(EC 1.1.3.4, 5.6 U/mg,Sigma-Aldrich);85%~90%脱乙酰度的壳聚糖、25%戊二醛溶液、冰乙酸、氢氧化钠、乙醇、1,4-二氧六环、乙醚等均为国产。
1.2 仪器与设备
TU-1900双光束紫外可见光分光光度计:北京普析通用仪器有限责任公司;PFDS8508型冷冻干燥机:韩国浩瀚有限公司;PB-10 pH计:北京赛多利斯仪器系统有限公司;超纯水系统:Sartorius公司。
1.3 方法
1.3.1 GOD在最适pH缓冲液中冻干预处理
将GOD溶于0.1 mol/L磷酸盐缓冲液 (pH 6.0)中制成10 mg/mL的酶液,冷冻干燥后备用。
1.3.2 壳聚糖微球的制备及活化
称取3 g壳聚糖粉末加入99 mL蒸馏水中,搅拌10 min,加入1 mL冰乙酸,室温下搅拌混合3 h,纱布过滤,制得浓度3% (W/V) 的壳聚糖溶液。将壳聚糖溶液注入含有 10%NaOH (W/V) 和 16.67%的 95%乙醇 (V/V) 的凝结液中,制成直径约2 mm的壳聚糖微球,蒸馏水冲洗至中性。按戊二醛溶液/壳聚糖微球 10 mL/g的比例混合加入对应一定浓度的戊二醛水溶液,活化2 h后洗至中性,充分干燥备用。
1.3.3 固定化GOD的制备
有机相固定化 GOD:微量水溶解冻干的GOD(水分比例:0.4%~ 1.8%),加入适量已活化的壳聚糖微球和预先干燥的有机溶剂,冰上震荡共价交联2 h后放入4 ℃冰箱过夜。用pH 6.0,0.1 mol/L磷酸盐缓冲液洗掉未交联的GOD,过滤干燥。
水相固定化GOD:取10 mL的0.1 mol/L磷酸盐缓冲液 (pH 6.0) 溶解冻干的GOD,加入一定量已活化的壳聚糖微球,冰上震荡活化2 h后放入4 ℃冰箱过夜。过滤,洗掉载体表面未交联的GOD,干燥备用。
1.3.4 GOD酶活力的测定[5]
定义一个GOD酶活力单位相当于在规定条件下,于温度25 ℃、pH 6.0,每分钟分解1 μmol邻-联二茴香胺时所需的酶量。固定化酶测活过程改进为将2.6 mL邻-联二茴香胺缓冲混合液、0.30 mL底物溶液和0.10 mL过氧化物酶溶液滴入1 cm比色皿中,调整温度至25 ℃,然后加若干 g固定化 GOD,其他操作同。单位:U/g载体。
1.3.5 GOD的固定化条件的优化
戊二醛浓度:使用戊二醛浓度 (0.05%、0.1%、0.2%、0.3%和0.4%) 将GOD固定在壳聚糖微球上,测定固定化酶活;使获得酶活最佳的戊二醛浓度,尝试加酶量/载体 (20 mg/1 g、40 mg/1 g、60 mg/1 g、80 mg/1 g和100 mg/1 g)进行水相和有机相固定化,以上述优化的戊二醛浓度和加酶量并分别在不同含水量的各种有机溶剂1,4-二氧六环、乙醚和乙醇中分别对GOD进行固定化。以各系列实验中酶活最高者为100%,以相对酶活和酶比活表示各实验结果。
1.3.6 固定化GOD的酶学性质分析
以下实验均按1.3.5的最佳优化条件进行有机相与水相固定化,酶活性测定按照1.3.4方法。
最适反应温度:分别在30 ℃、35 ℃、40 ℃、45 ℃、50 ℃和55 ℃测定固定化GOD的酶活力,以有机相酶活力最高值为100%,以酶比活力和相对酶活力来表示不同温度下固定化酶活性变化情况。
最适反应pH:固定化GOD分别在pH 4.5、5.0、5.5、6.0、6.5、7.0和7.5下测活。以有机相酶活力最高值为100%,以酶比活力和相对酶活力来表示不同pH下固定化酶活性变化情况。
热稳定性:60 ℃水浴孵化固定化GOD,每30 min取样测定残留酶活。以未处理前的固定化酶活力最高者为100%,以酶比活力和相对酶活来表示固定化酶随热处理时间不同的酶活变化情况。
pH稳定性:水相和有机相固定化GOD溶液置于pH 4.0-8.0的缓冲液中4 ℃处理5 h,倾去缓冲液,冲洗数次,以处理后残留酶活最高者为100%,以酶比活力和相对酶活表示固定化GOD酶活对pH的稳定性。
操作稳定性:固定化GOD酶活测定一次,倾去反应液将固定化酶用pH 6.0,0.1 mol/L磷酸盐缓冲液冲洗固定化酶,洗去表面残留的未反应的底物和反应后的产物,重新转入底物溶液测定残留酶活力,如此反复操作,考察随着使用次数的增加,固定化酶酶活的保留情况。
以上实验中把各自最高组的酶比活作为100%,以相对酶活表示不同浓度的戊二醛作为交联剂所得固定化酶活性的变化情况。
1.3.7 GOD蛋白固定率和有效酶活回收率的测定
按照Bradford法[6]建立标准曲线方程,在标准曲线范围内测定残液中酶蛋白的浓度。
1.3.8 固定化GOD的动力学参数测定
分别配制浓度为1 mmol/L、2 mmol/L、5 mmol/L、10 mmol/L、20 mmol/L、25 mmol/L的葡萄糖底物溶液,取0.002 g固定化GOD,按照1.3.4的方法分别测定并计算每分钟葡萄糖的分解量,连续测定5 min。以葡萄糖浓度和GOD分解底物的速度作图计算固定化GOD的Kmapp、Vmax、Kcat值。
2 结果与分析
2.1 固定化GOD条件的优化
2.1.1 戊二醛浓度对固定化GOD酶活的影响
图1显示,当戊二醛浓度为0.1%时,GOD的催化活力最高,继续增加戊二醛浓度,GOD活下降趋势明显。后续实验均采用最适戊二醛浓度0.1%。

图1 戊二醛浓度对固定化GOD活力的影响Fig. 1 Effect of glutaradehyde concentration on the covalently immobilized GOD.
2.1.2 加酶量对固定化GOD酶活的影响
图2表明,当加酶量在0~80 mg酶/g壳聚糖载体时,固定化GOD的相对酶活随着GOD加入量的增加而增大,当加入的酶量为80 mg酶/g壳聚糖时,固定化GOD的相对活力最高,固定化效果最好。当酶量增至100 mg酶/g壳聚糖载体微球时,固定化酶的相对活力有所下降。
2.1.3 有机溶剂含水量对固定化 GOD酶活的影响

图2 加酶量对固定化GOD酶活力的影响Fig. 2 Effect of dosage on the covalently immobilized GOD activity.
研究发现,水对有机介质中酶的催化作用影响巨大,它有利于酶构象结构刚性的维持,使其保持较好的催化活性。一方面,酶分子需要维持其分子完整的空间构象必需最低水量即必需水,而必需水与酶分子的结构和性质有密切关系,不同的酶所需的必需水的含量差别很大;另一方面,水影响酶催化反应速度:有机介质中水的含量对酶催化反应速度有显著影响,在水溶解度范围内酶促反应活力随溶溶剂中水含量的增加而增加[7]。在催化反应速度达到最大的含水量称为最适含水量,酶的必需含水量主要取决于溶剂而并非酶本身[8]。催化反应系统中的含水量与溶剂的亲水性、疏水性密切相关。Hailing[9]提出水活度 (Thermodynamic activity of water, aw) 描述水对有机相中脂酶酶促反应的影响,发现酶活性的大小依赖于水活度的变化。aw定义为系统中水的逸度与纯水的逸度之比,水的逸度在理想条件下用水的蒸汽压代替,因此aw可以用体系中水的蒸汽压和同样条件下纯水蒸汽压之比表示。aw=γwcw,其中γw为活度系数,cw为水的摩尔比。另外,Bell等[10]发现,在极性溶剂中,通常难以得到水活度 aw与酶活力的关系,这可能是由于溶剂对水的影响大于酶对水的结合作用。在实际应用时应当根据实际情况,通过实验确定最适宜的含水量,因此,我们尝试在有机溶剂中加入不同比例的微量水,将冻干的葡萄糖氧化酶在这些含有微量水的有机相中与壳聚糖微球进行共价交联。有机溶剂含水量对共价固定化GOD活力的影响见图3。
图3表明,分别在含水1.6%的乙醚、含水1.0%的1,4-二氧六环和乙醇有机介质中,固定化葡萄糖氧化酶的相对酶活最高。在低于或高于最适含水量的有机介质中固定化酶的相对酶活均较低,可能是因为酶经过真空干燥后几乎不含水,当加入的水低于该酶分子维持其活性构象所必需的最低含水量,这时酶分子的活性构象会丧失,直接的表象就是酶的活性降低,而当酶在高于最适含水量的有机介质中固定化时,微环境的改变可能使酶不能完全维持一个相对刚性的构象,经过剧烈的共价交联反应后,部分酶的构象发生不可逆的扭曲,最终这种微观的构象改变就以酶活的下降表现出来。
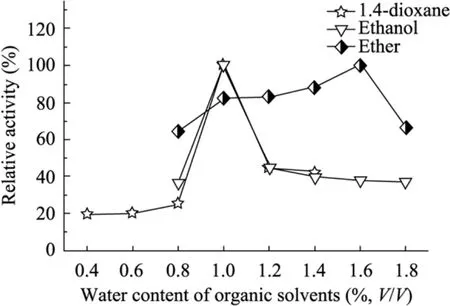
图3 有机溶剂含水量对固定化GOD酶活力的影响Fig. 3 Effect of water content with organic solvents on the covalently immobilized GOD activity.
2.2 固定化GOD的酶学性质分析
2.2.1 固定化GOD的最适反应温度
不同介质中共价固定化GOD在不同的反应温度条件酶活测定结果如图4所示。
从相对酶活力来看,图4中不同有机相固定的 GOD酶比活力整体上要高于水相固定的GOD。其中,1,4-二氧六环中固定的 GOD在其最适反应温度条件下酶比活是水相固定的 GOD的4倍,40 ℃时,1,4-二氧六环中固定的GOD酶比活力是对应水相固定化 GOD酶比活的 5.6倍。可见经过一定优选后,有机相中固定的酶比水相固定的酶显示了更好的耐热性。从不同有机相固定化GOD的最适反应温度 (图4) 来看,各有机相固定的GOD的最适反应温度相同 (乙醚)或略低于水相中固定的 GOD,产生这种差异的原因有待进一步探讨。

图4 固定化GOD的最适反应温度Fig. 4 Optimum temperature on the covalently immobilized GOD.
2.2.2 固定化GOD的最适反应pH
不同介质中固定化GOD在不同pH条件下催化反应GOD酶活测定结果如图5所示。

图5 固定化GOD的最适反应pHFig. 5 Optimun reaction pH on the covalently immobilized GOD.
图5可看出,在实验的pH范围内,有机相和水相固定化的GOD的最适反应pH值略有变化,产生pH偏移的原因可能是因为GOD催化的产物葡萄糖酸呈酸性,由于其扩散受到限制而使葡萄糖酸积累在固定化酶所处的催化区域内,此区域内的pH值降低,为抵御这种影响必须提高溶液的pH,才能使固定化GOD的具有最高的活性,因而导致固定化GOD作用的最适pH值有向碱性方向移动的趋势。但是有机相固定的GOD都比水相固定的酶表现出更高的比活力,其中在1,4-二氧六环有机相中表现最为显著。在pH 5.5时,水相固定的GOD仅是1,4-二氧六环中固定的GOD酶比活的20%。
2.3 有机相固定化GOD稳定性分析
2.3.1 不同有机相中固定化GOD的热稳定性
对各有机介质固定化的GOD进行热处理一定时间,观察酶活下降情况如图6所示。
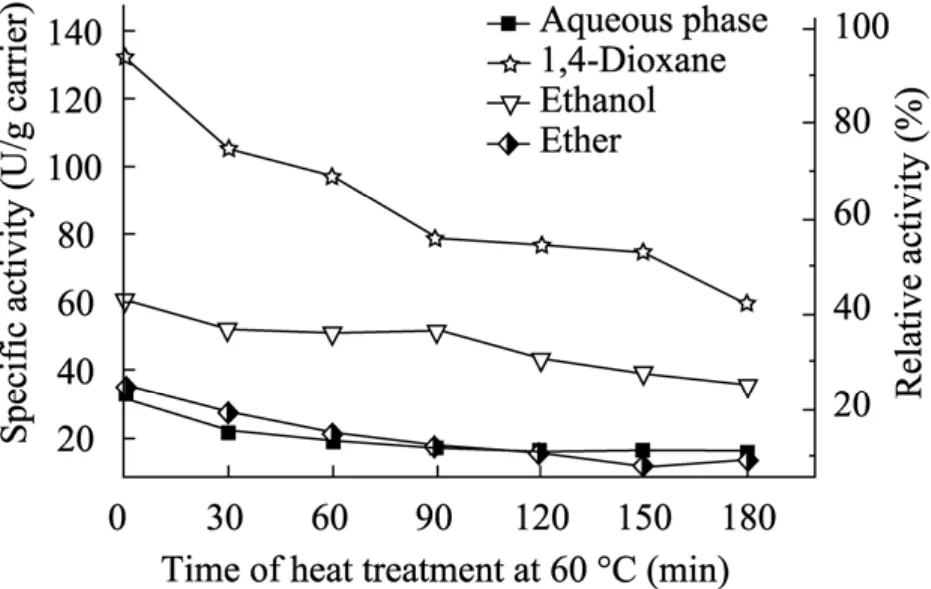
图6 固定化葡萄糖氧化酶的热稳定性Fig. 6 Thermal stability of covalently immobilized GOD.
三种有机相中固定的GOD热处理后,其固定化酶比活力均高于水相固定的该酶,即有机相固定GOD在热稳定性上比水相固定的GOD表现出优势。虽然这种效应在乙醚中固定的GOD上面并不明显。但从实际应用的角度来讲,在高温下使用酶时,有机相固定的酶有可能获得比传统的水相下固定的酶有更好的活性表现。但单从热稳定性即热处理后相对于该固定化酶热处理前的活性损失率来讲,1,4-二氧六环有机相中固定GOD其活力的下降还是比较显著的,相比较而言,乙醇相固定的GOD的热处理前后酶活损失较少,但整体上酶的活力仍不及1,4-二氧六环中固定的 GOD (尽管热处理使固定酶的酶活损失较为明显)。
根据固定化酶半衰期计算公式:
2.3.2 不同有机相中固定化GOD的pH稳定性
不同pH的缓冲液处理5 h后,固定化GOD
酶活变化情况如图7所示。

表1 不同介质中共价固定化GOD热稳定性半衰期Table 1 Half-life of immobilized GOD under different media

图7 共价固定化GOD的pH稳定性Fig. 7 pH stability of covalently immobilized GOD.
由图7可看出,经过不同的酸碱条件处理后,整体上有机相固定化GOD都仍然能保持比水相固定的GOD更高的酶比活。4种介质下固定的GOD对酸碱的处理酶活变化趋势都比较平缓,而且1,4-二氧六环和乙醇中固定的GOD能表现出更明显的耐受酸碱性优势。
2.3.3 有机相固定化GOD的操作稳定性
在实际应用中酶的重复使用效率是评价固定化酶的重要指标之一[11]。有机相共价固定的GOD重复使用多次过程中酶活损失情况如图8所示。
有机相共价固定的酶与传统的水相共价固定化GOD整体上没有太大的改善。但是由于有机相中共价固定化GOD有更高的酶比活,虽然重复使用多次后其残留比活下降的趋势与水相固定的酶活力相似,但绝对的残留酶比活相比于水相固定的酶仍然具有优势。如使用7次后,乙醚、1,4-二氧六环和乙醇中固定的GOD残留相对酶活分别比水相固定化 GOD高出 27.40%、23.45%、15.76%。这与该酶在三种有机溶剂的极性相关。酶分子表面少量的水对酶保持活性是必需的,不同的有机溶剂夺取酶必需水的能力不同。要达到一定的酶活性,不同溶剂所需的水量也不同。关于有机溶剂的生物兼容性问题,最终要通过实验才能确定适于维持酶的最佳活性的有机溶剂。

图8 共价固定化GOD的操作稳定性Fig. 8 Operational stability of covalently immobilized GOD.
2.4 GOD的固定率和有效固定化酶比活
由于交联到载体上的酶蛋白量和活性会因为介质的不同而有所差异,干扰了以固定化酶的酶比活来评估“有机相对维持蛋白质天然构象”的贡献。所以有必要了解交联到载体上的蛋白量和有效固定化酶比活。不同介质中固定化酶的有效比活力结果如表 2 所示。
表2表明,尽管有机相中蛋白质固定率或高或低,但有机相中固定的酶比活均高于水相中固定化酶的比活。扣除因蛋白载量的差异而引起的比活变化后的蛋白比活即有效固定化酶比活也表明有机相固定化酶比活均比水相固定化酶高。
2.5 固定化GOD动力学参数分析
通过双倒数方程作图法求的不同介质中固定化GOD的动力学参数见表3。表3结果显示,GOD经过水相和有机相固定化后,其Kmapp值较游离酶明显减小,说明固定化 GOD更有利于底物结合。综合来看,1,4-二氧六环有机相固定化 GOD效果最明显,其表观米氏常数和最大反应速率分别为:Kmapp=5.63 mmol/L、Vmax=1.70 μmol/(min·mg protein),水相固定化GOD的表观米氏常数和最大反应速率分别为:Kmapp=7.33 mmol/L、Vmax=1.02 μmol/(min·mg protein)。表明 1,4-二氧六环有机相固定化 GOD较水相固定化 GOD与底物葡萄糖的亲和力增加。这其中受到载体性质、固定化方法及固定化酶的应用环境等因素的综合影响,具体原因有待进一步探究;如表3所示,与水相固定化的GOD的转换数Kcat为0.221 S-1相比,三种有机介质中固定化的 GOD的转换数均优于水相固定化GOD,其中1,4-二氧六环有机相固定化GOD表现最佳,Kcat达到0.304 S-1。这其中可能是受到固定化酶催化性质的其他因素的影响,如空间位阻和扩散控制等。
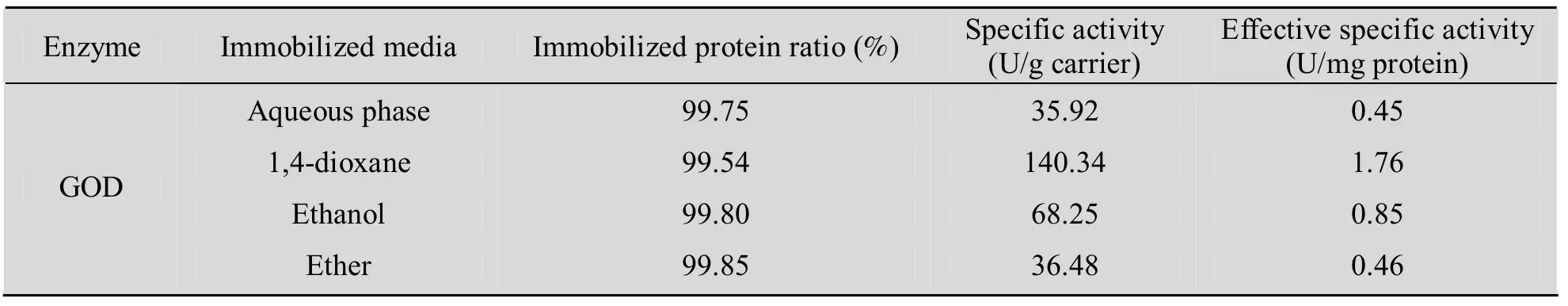
表2 不同介质中葡萄糖氧化酶的共价固定化效果比较Table 2 Comparison of covalently immobilized GOD under different media

表3 不同介质中共价固定化GOD的动力学参数Table 3 Kinetic parameters of immobilized GOD under different media
近年来关于GOD的水相共价固定化研究与本实验中GOD的有机相共价固定化的一些参数比较见表4。
影响因子 (Effectiveness factors,EF) 是固定化体系的重要的评价参数[16-18]。如果EF<1,则固定化体系中存在因固定化载体的传质作用而存在底物和产物的扩散阻碍效应;若EF≥1,则扩散阻碍可以忽略。如表4所示,本研究中GOD在水相、1,4-二氧六环中以戊二醛活化的壳聚糖上固定化后,固定化酶的Vmax要大于游离酶,不存在底物和产物的传质和扩散的阻碍作用,显示有机相中进行酶的固定化优势所在。这种现象和已报道的 GOD在水相中固定化的结果有所不同,具体原因有待考察。GOD在水相中固定化后,固定化酶的Km值因固定化材料的不同而存在差异。但是,通过GOD在水相和有机相的固定化酶的Km比较 (表4) 发现,GOD在有机相中以戊二醛活化的壳聚糖微球为载体进行共价交联固定化,固定化酶的Km值均小于GOD在水相中以其他材料为载体时共价交联固定化的结果,说明有机相固定化GOD较水相固定化GOD有良好的底物亲和力,固定化GOD的活性中心对底物的亲和力增大;由于酶被固定在载体上,刚性增加,在一定的空间内呈现闭锁状态,这种疏水环境中的动力学“刚性”一定程度上限制了酶活性中心构象的变化,GOD的催化产物H2O2因扩散阻碍及固定化酶在有机相共价交联过程中构象的相对稳定,使GOD的活力不仅不会丧失反而会表现出更好的催化活性,酶的动力学表现为固定化酶的Km减小。这也显示在有机相中GOD的共价交联固定化较水相有着很大优势。如表4所示,由于本工作是采用常规的材料作为载体共价交联固定化化 GOD,所以与纳米材料作为载体共价交联的GOD相比优势不明显[28-31]。纳米材料具有卓越的比表面积,能够非常显著地提高酶的分散度、传质性质和固定的酶量,酶在某些纳米材料上固定化表观出更优的Km值是多种因素影响的结果,有机相中进行的酶的共价固定化仅可以改善酶在进行共价化学反应时不会或较少程度上的因构象变化而引起的失活现象。
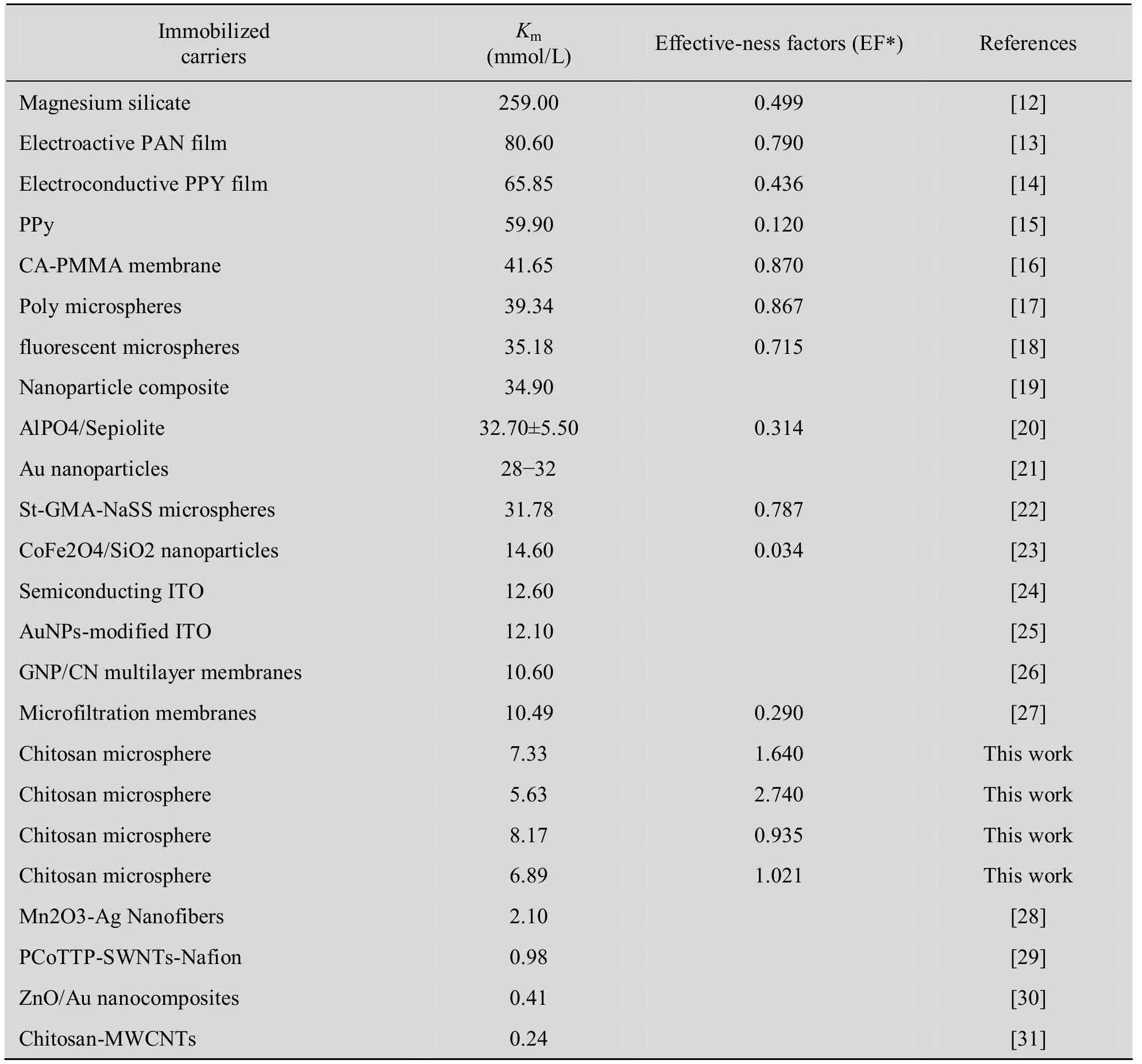
表4 不同的共价固定化葡萄糖氧化酶参数比较Table 4 Parameters of GOD based on different covalent immobilization
3 讨论
本研究利用酶在有机相中构象稳定的特点,尝试了在 1,4-二氧六环、乙醇、乙醚相对 GOD进行共价固定化。与传统水相共价固定化相比,有机相固定化使GOD在酶比活力、酶学性质及动力学参数方面均表现一定的优势。尤其是 1,4-二氧六环相固定化 GOD,其固定化酶比活力和有效酶活回收率提高3倍;在连续使用后,1,4-二氧六环有机相固定化GOD的酶活力仍为相应水相固定化酶的 3倍。在酶动力学参数方面,对于表观米氏常数,最大反应速度还是转换数,1,4-二氧六环有机相固定化的 GOD都优于水相共价固定化GOD。
由于酶的活性主要是靠酶蛋白的构象维持的,可以推断,在固定化过程中,有机相与水相相比,GOD在前者的环境中,有更多的酶分子保持了正确的蛋白构象,这也间接地说明 GOD在进行共价固定化操作过程中,经过优选有机相比水相能够更好地维系酶蛋白的天然活性构象,有利于提高固定酶的活性。因此,该研究可能为改善酶在共价固定化过程中的变性问题提供新思路。
[1] Bayramolğu G, Arica MY. Enzymatic removal of phenol and p-chlorophenol in enzyme reactor: horseradish peroxidase immobilized on magnetic beads. J Hazard Mater, 2008, 156(1/3): 148−155.
[2] Cabana H, Alexandre C, Agathos SN, et al. Immobilization of laccase from the white rot fungus Coriolopsis polyzona and use of the immobilized biocatalyst for the continuous elimination of endocrine disrupting chemicals. Bioresour Technol, 2009, 100(14): 3447−3458.
[3] Shi QQ. Enzyme Engineering. Beijing: Science Press, 2005.施巧琴. 酶工程. 北京: 科学出版社, 2005.
[4] Li Y. Enzymes immobilization and their applications. J Mol Catal, 2008, 22(1): 86−96.李晔. 酶的固定化及其应用. 分子催化, 2008, 22(1): 86−96.
[5] Stellmch B. Bestimmungsmethoden Enzyme. Qian JY, Translator. Beijing: China Light Industry Press, 1992. B. 施特尔马赫. 酶的测定方法. 钱嘉渊, 译. 北京: 中国轻工业出版社, 1992.
[6] Bradford MM. A rapid and sensitive method for the quantitation of microgram quantities of protein utilizing the principle of protein-dye binding. Anal Biochem, 1976, 72(1/2): 248−254.
[7] Zaks A, Klibanov AM. Enzymatic catalysis in nonaqueous solvents. J Biol Chem, 1988, 263(7): 3194−3201.
[8] Narayan VS, Klibanov AM. Are waterimmiscibility and apolarity of the solvent relevant to enzyme efficiency. Biotechnol Bioeng, 1993, 41(3): 390−393.
[9] Halling PJ. Thermodynamic predictions for biocatalysis in nonconventional media: theory, tests, and recommendations for experimental design and analysis. Enzyme Microb Technol, 1994, 16(3): 178−206.
[10] Bell G, Janssen AEM, Halling P J. Water activity fails to predict critical hydration level for enzyme activity in polar organic solvents: interconversion of water concentrations and activities. Enzyme Microb Technol, 1997, 20(6): 471–477.
[11] Bai YX, Li YF, Wang MT. Study on synthesis of a hydrophilic bead carrier containing epoxy groups and its properties for glucoamylase immobilization. Enzyme Microb Technol, 2006, 39(4): 540−547.
[12] Ozyilmaz G, Tukel SS, Alptekin O. Activity and storage stability of immobilized glucose oxidase onto magnesium silicate. J Mol Catal B: Enzym, 2005, 35(4/6): 154−160.
[13] Li ZF, Kang ET, Neoh KG, et al. Covalent immobilization of glucose oxidase on the surface of polyaniline films graft copolymerized with acrylic acid. Biomaterials, 1998, 19(1/3): 45−53.
[14] Liu X, Neoh KG, Cen L, et al. Enzymatic activity of glucose oxidase covalently wired via viologen to electrically conductive polypyrrole films. Biosens Bioelectron, 2004, 19(8): 823−834.
[15] Tirkeş S, Toppare L, Alkan S, et al. Immobilization of glucose oxidase in polypyrrole/ polytetrahydrofuran graft copolymers. Int J Biol Macromol, 2002, 30(2): 81−87.
[16] Rauf S, Ihsan A, Akhttar K, etal. Glucose oxidase immobilization on a novel cellulose acetatepolymethylmethacrylate membrane. J Biotechnol, 2006, 121(3): 351−360.
[17] Du TX, Liu BL, Hou XH, et al. Covalent immobilization of glucose oxidase onto Poly (St-GMA-NaSS) monodisperse microspheres via BSA as spacer arm. Appl Surf Sci, 2009, 255(18): 7937−7941.
[18] Hou XH, Liu BL, Deng XB, et al. Covalent immobilization of glucose oxidase onto poly (styrene-co-glycidyl methacrylate) monodisperse fluorescent microspheres synthesized by dispersion polymerization. Anal Biochem, 2007, 368(1): 100−110.
[19] Zhao R. Immobilization of glucose oxidase on Fe3O4-SiO2 nano-composite and its application [D]. Wuhan: Wuhan University of Technology, 2010.赵荣. Fe3O4-SiO2纳米复合固定化葡萄糖氧化酶及应用[D]. 武汉: 武汉理工大学, 2010.
[20] Bautista FM, Campelo JM, Garcia A, Jurado A, et al. Properties of a glucose oxidase covalently immobilized on amorphous AlPO4support. J Mol Catal B: Enzym, 2001, 11(4/6): 567−577.
[21] Tomonori H, Sagae N, Daikuhara K, et al. Multilayer membranes via layer-by-layer deposition of glucose oxidase and Au nanoparticles on a Pt electrode for glucose sensing. Mater Sci Eng C, 2007, 27(4): 890−894.
[22] Xiao Y. Application, characterization and preparation of immobilizing GOD on crosslinked Chitosan-Lysine resin [D]. Chongqing: Chongqing University, 2008.肖燕. 交联壳聚糖-赖氨酸树脂固定化 GOD制备、表征及应用[D]. 重庆: 重庆大学, 2008.
[23] Wang H, Huang J, Li DP, et al. Immobilization of glucose oxidase using CoFe2O4/SiO2nanoparticles as carrier. Appl Surf Sci, 2011, 257(13): 5739−5745.
[24] Fang AP, Ng HT, Li Yau Fong S. A highperformance glucose biosensor based on monomolecular layer of glucose oxidase covalently immobilised on indium−tin oxide surface. Biosensors Bioelectron, 2003, 19(1): 43−49.
[25] Wang JW, Wang LP, Di JW, et al. Disposable biosensor based on immobilization of glucose oxidase at gold nanoparticles electrodeposited on indium tin oxide electrode. Sen Actuat B: Chem, 2008, 135(1): 283−288.
[26] Liu Y, Wu S, Ju HX, et al. Amperometric glucose biosensing of gold nanoparticles and carbon nanotube multilayer membranes. Electroanalysis, 2007, 19(9): 986−992.
[27] Ying L, Kang ET, Neoh KG. Covalent immobilization of glucose oxidase on microporous membranes prepared from poly (vinylidene fluoride) with grafted poly (acrylic acid) side chains. J Membr Sci, 2002, 208(1/2): 361−374.
[28] Huang S, Ding Y, Liu YX, et al. Glucose biosensor using glucose Oxidase and Electrospun Mn2O3-Ag Nanofibers. Electroanalysis, 2011, 23(8): 1912−1920.
[29] Chen W, Ding Y, Akhigbeb J, et al. Enhanced electrochemical oxygen reduction-based glucose sensing using glucose oxidase on nanodendritic poly [meso-tetrakis (2-thienyl) porphyrinato] cobalt(II)-SWNTs composite electrodes. Biosensors Bioelectron, 2010, 26(2): 504−510.
[30] Wei YY, Li Y, Liu, XQ, et al. ZnO nanorods/Au hybrid nanocomposites for glucose biosensor. Biosensors Bioelectron, 2010, 26(1): 275−278.
[31] Tan XC, Li MJ, Cai PX, et al. An amperometric cholesterol biosensor based on multiwalled carbon nanotubes and organically modified sol-gel/ chitosan hybrid composite film. Anal Biochem, 2005, 337(1): 111−120.

