利用定点突变法研究精氨酸脱亚胺酶活性的影响机制
李利锋,倪晔,孙志浩
江南大学生物工程学院 工业生物技术教育部重点实验室,江苏 无锡 214122
目前,肝癌 (Hepatocellular carcinoma,HCC)已经成为世界范围常见的恶性肿瘤之一。全球每年约有600 000名病人患有肝细胞癌。亚洲东部、东南部该病发病率为18.3%~35.5% (每10万人),而在中美洲该病发病率仅有2.1% (每10万人)。肝癌患者在确诊后没有经过治疗其生存期平均为1~4个月[1]。通过手术治疗HCC效果不佳,且术后易复发,因此临床迫切需要一种治疗肝癌的新方法[2-3]。研究中发现,ADI在体内具有抑制精氨酸缺陷型肿瘤细胞的功效,且毒副作用较小[4]。ADI的抗癌机制是通过切断精氨酸对肿瘤细胞的供给,从而消灭或控制精氨酸营养缺陷型癌细胞 (如:肝癌细胞、黑素瘤细胞等) 的生长。精氨酸对于人类是一种非必需氨基酸,正常细胞可经尿素循环通过精氨酸-琥珀酸合成酶和精氨酸-琥珀酸裂解酶合成精氨酸[5-6]。
近年来,ADI作为新型抗癌药物的临床研究在国内外已经开展并引起了高度重视[7-10],美国肯塔基大学和美国凤凰生物科技公司对开发ADI作为抗癌药物做了大量研究[11-12]。经 PEG修饰的支原体Mycoplasma来源的ADI重组蛋白ADI-PEG-20,即PEG化重组支原体ADI,于1999年和2005年分别被美国食品药品管理局 (FDA)和欧洲药品审评署 (EMEA) 批准作为罕见病药物用于治疗恶性黑素瘤和 HCC。目前美国凤凰生物科技公司的 ADI-PEG-20在美国进行第 III期临床实验。在前期研究中,本研究室刘咏梅等在自然界筛选到产 ADI的变形假单胞菌Pseudomonas plecoglossicida,该ADI为同源二聚体,其最适pH为6.0,在人体生理pH (7.35~7.45)条件下的酶活力仅为最适条件下酶活力的 10%左右[13];刘咏梅等在改良的二乙酰一肟瓜氨酸测定方法的基础上,建立了高效灵敏的96孔板高通量筛选模型,采用易错PCR法构建ADI突变文库,由 600多株突变株中筛选获得了在生理pH条件下酶活力提高 20.5倍的 ADI突变株M314 (A128T/H404R/I410L)[14]。ADI突变株M314的最适pH为6.5,较野生型ADI的最适pH提高了0.5个单位,在生理pH条件下残余酶活力为40%。为了进一步探明M314中关键位点对精氨酸脱亚胺酶的影响,本研究采用定点突变法研究了精氨酸脱亚胺酶活性的影响机制。
定点突变是研究蛋白质结构与功能之间复杂关系的有效手段[15]。PCR介导的定点突变是目前广为采用的方法之一[16]。目前,QuikChange PCR法 (快速定点突变法) 最为简便快速,其原理为以环状全质粒为模板,使用两条含突变位点的反向互补引物进行 PCR扩增目的基因,其产物是含缺刻的环形质粒,由于来源于大肠杆菌的模板质粒几乎全为甲基化的质粒,因此,可以通过DpnⅠ限制性内切酶降解模板质粒,酶切后获得的为含突变的质粒,经转化大肠杆菌并修复环形缺刻最终获得突变菌株[17]。ADI突变株M314较野生型ADI在生理pH条件下酶活力提高20.5倍,最适pH提高了0.5个单位。为进一步了解M314中特定氨基酸位点对酶活力的影响机制,本研究通过定点突变研究了M314的3个突变位点A128T、H404R和I410L对ADI酶活力和酶学性质的影响。并对M314突变位点进行结构模拟分析,A128T有利于形成更多氢键,H404位点紧临催化中心 C405,两者均处于影响酶活力的重要位置;而I410位点则处于C末端的β折叠上,距酶催化中心较远,I410L对ADI三维结构无明显的改变。本研究首先对3个氨基酸位点A128、H404和I410进行单点突变以阐明其对酶活力的影响,为进一步双位点的突变研究提供依据。实验结果显示,A128T和H404R对ADI的酶活力有显著影响,而I410L对酶活力影响较小,因此选择了A128T和H404R作为组合进行双位点突变。通过定点突变法获得了突变株M1 (A128T)、M2 (H404R)、M3 (I410L) 和M4 (A128T/H404R),并对WT-ADI及其突变酶的酶学性质进行了研究,探讨了上述位点对ADI酶活力的影响及其分子机制,为阐明 ADI的酶促反应的作用机制和蛋白质的理性改造提供了实验依据。
1 材料与方法
1.1 菌株、质粒和培养基
野生型ADI (WT-ADI)、ADI突变株M314 (A128T/H404R/I410L) 及E. coli JM109和BL21 (DE3) 均为本实验室保藏。
LB培养基:胰蛋白胨1%,酵母膏0.5%,NaCl 1%,pH 7.0,115 ℃灭菌20 min。
1.2 主要试剂和设备
QuikChange 试 剂 盒 (210518) 购 自Stratagene公司;DNA marker、质粒小量提取试剂盒、蛋白marker、蛋白定量试剂盒、十二烷基硫酸钠 (SDS)、丙烯酰胺、双丙烯酰胺、β-巯基乙醇、苯甲基磺酰氟 (PMSF) 等购自上海生工生物工程有限公司;PCR引物合成及测序委托Invitrogen公司 (上海) 进行;其他试剂均采用国产分析纯试剂。
超净工作台 (苏州安泰空气技术有限公司),电子天平 (上海精天电子仪器有限公司),超声波破碎仪 (宁波新芝生物科技有限公司),3K15台式高速冷冻离心机 (Sigma 公司),蛋白电泳仪及凝胶成像仪 (Bio-Rad 公司),AKTA avant (GE healthcare公司),752型紫外可见分光光度计 (上海光谱仪器有限公司) 等。
1.3 定点突变法制备ADI突变株
将携带有质粒pET24a-ADI的E. coli BL21 (DE3) 基因工程菌接种于 LB/Kan (Kan终浓度30 µg/mL) 液体培养基中,过夜培养后提取质粒。具体操按照说明书进行。以变形假单胞菌ADI的编码序列 (GenBank Accession No. EU030267) 为模板,设计引物 (表1),突变位点处由下划线标出。
PCR扩增反应:总体积为 50 μL,其中QuikChange®Lightning DNA聚合酶 1 μL,10×反应缓冲液5 μL,待突变质粒模板 (20~50 ng/μL) 1 μL,正向引物 (125 ng) 1.25 μL,反向引物(125 ng) 1.25 μL,dNTPs混合物 1 μL,QuikSolution试剂1.5 μL,补ddH2O至50 μL。PCR反应程序:95 ℃ 2 min;95 ℃ 20 s,60 ℃10 s,68 ℃ 4 min,进行18个循环;68 ℃ 5 min。
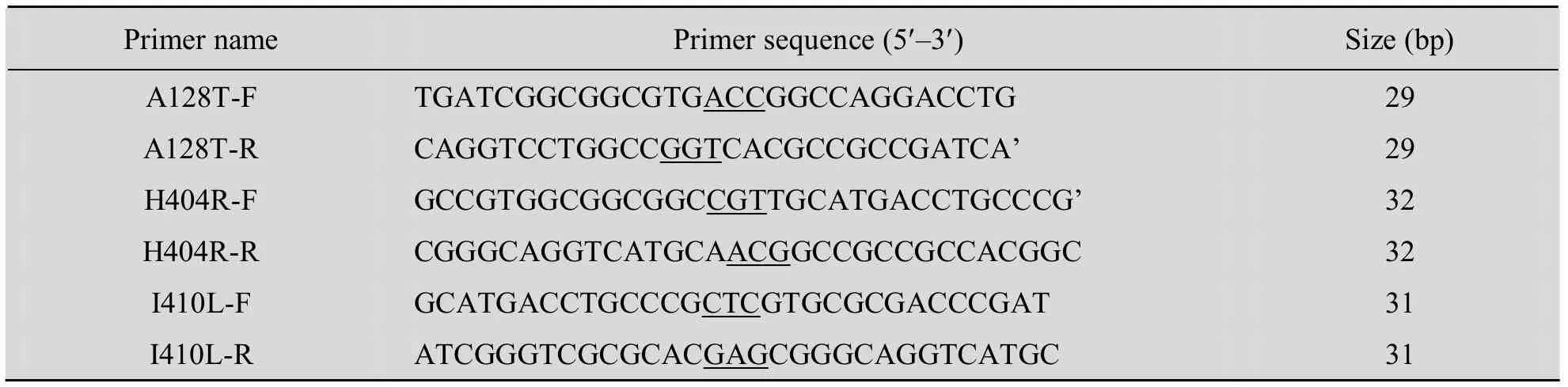
表1 定点突变引物Table 1 Primers for site-directed mutagenesis
取PCR产物进行琼脂糖凝胶电泳分析PCR的扩增情况,然后在剩余的PCR产物中加入2 μL的 Dpn Ⅰ限制性内切酶 (专一性消化甲基化质粒序列GATC),于37 ℃条件下反应5 min将原始模板序列彻底降解。
将酶切后的PCR产物转化大肠杆菌JM109,对转化子进行菌落 PCR验证,并提取质粒进行序列测定,最后将测序正确的质粒转化大肠杆菌BL21 (DE3),并保藏待用。
1.4 ADI的蛋白质纯化
将突变株 M1 (A128T)、M2 (H404R)、M3 (I410L)、WT-ADI及M314 (A128T/H404R/I410L)分别接入LB/Kan液体培养基,待OD600为1.0左右,加入终浓度为0.2 mmol/L的IPTG,30 ℃诱导5 h后,8 000 r/min离心15 min收集菌体,用磷酸钠缓冲液 (20 mmol/L,pH 7.0) 洗涤2次,并按菌体湿重/缓冲液1∶6将菌体悬浮,冰浴条件下进行超声破碎 (400 W,10~15 min,超声1 s,停止3 s)。将破碎液于12 000 r/min离心20 min,上清即为粗酶液。
用溶液A (20 mmol/L,pH 7.0,磷酸钠缓冲液) 平衡HiPrep DEAE FF离子交换层析柱,上样后用溶液 A洗脱未吸附蛋白,再用溶液 B (20 mmol/L,pH 7.0,磷酸钠缓冲液,1 mol/L NaCl) 进行线性洗脱。并将活性部分超滤浓缩脱盐后进行凝胶过滤层析。
用溶液C (20 mmol/L,pH 7.0,磷酸钠缓冲液,0.15 mol/L NaCl) 平衡SuperdexTM200凝胶过滤层析柱,将上步浓缩后的蛋白上样后以进行洗脱。将活性部分收集后于0~4 ℃冰箱保存,并进行SDS-PAGE分析。
1.5 ADI突变株的酶学性质研究
1.5.1 ADI的酶活力及比活力测定
ADI酶活力的测定方法同本研究室的文献报道[18],简述如下:
酶活力单位定义:37 ℃时,每分钟转化1 µmol精氨酸盐酸盐生成瓜氨酸的酶量定义为1 U。
瓜氨酸含量测定:于10 mL的比色管中依次加入0.5 mL二乙酰一肟-硫胺脲溶液,3 mL混酸溶液 (含 Fe3+),2 mL不同浓度瓜氨酸标准液(0~50 mg/L),空白以2 mL的去离子水代替。将混匀好的溶液沸水浴10 min后,冷却至室温。按文献[19]方法测定吸光值,并绘制标准曲线。
ADI酶活力测定:取50 μL适当稀释浓度的酶液并加入 950 μL底物 (10 mmol/L L-精氨酸,0.5 mol/L磷酸钠缓冲液,pH 6.0),终体积为1 mL,于37 ℃条件下反应30 min后,100 ℃沸水浴 5 min,使酶失活,终止反应。适当稀释后按文献[19]方法测定吸光值,根据标准曲线计算其中瓜氨酸含量,并计算酶活。计算公式如下:

蛋白质含量的测定:根据上海生工生物工程有限公司的 Bradford法蛋白定量试剂盒说明书进行操作。
1.5.2 最适反应温度和热稳定性的测定
取适量纯化后的 WT-ADI及其突变酶分别加入到两种不同pH的磷酸钠缓冲液 (0.5 mol/L,pH 6.0/pH 7.4) 中,并在不同的温度 (20 ℃~ 65 ℃,间隔5 ℃) 条件下进行酶促反应测定其最适反应温度,所使用的底物浓度为10 mmol/L L-精氨酸,参照 1.5.1部分测定其酶活力,重复测定3次。以WT-ADI及其突变酶在不同温度条件下所测得的最高酶活力为100%,其他值与之比较得到的相对值作图。
取适量纯化后的 WT-ADI及其突变酶于不同的温度 (25 ℃~65 ℃,间隔5 ℃) 条件下处理1 h后,分别在pH 6.0和pH 7.4磷酸钠缓冲液中测定其酶活力,所使用的缓冲液及底物的浓度均参照酶活力标准测定方法,重复测定3次。以所测得的最高酶活力为100%,其他值与之比较得到的相对值作图。
1.5.3 最适pH和pH稳定性的测定
将纯化后的 WT-ADI及其突变酶在不同的 pH (3.5~9.0) 条件下进行酶促反应测定其最适pH值,所使用的缓冲液为0.5 mol/L醋酸盐缓冲液,pH 3.5~5.5;0.5 mol/L磷酸钠缓冲液,pH 6.5~8.0;0.5 mol/L Tris-HCl缓冲液,pH 8.5~9.0。并参照1.5.1部分测定其酶活力,重复测定3次。以所测得的最高酶活力为100%,其他值与之比较得到的相对值作图。
取纯化后的 WT-ADI及其突变酶在上述中不同pH缓冲液中按相同的体积混匀后,于37 ℃处理1 h,在0.5 mol/L, pH 7.4磷酸钠缓冲液中参照1.5.1部分测定其酶活力,重复测定3次。以所测得的最高酶活力为100%,其他值与之比较得到的相对值作图。
1.5.4 不同突变株精氨酸脱亚胺酶动力学参数对比
按文献[14]的方法,以L-精氨酸为底物,分别在pH 6.0和pH 7.4,0.5 mol/L磷酸钠缓冲液中,于37 ℃条件下,按照1.5.1部分的酶活力测定方法,测定 WT-ADI及其突变酶在2~10 mmol/L底物浓度下产物瓜氨酸的生成量,重复测定3次。并按Lineweaver-Burk双倒数作图法求得Km和Vmax。
2 结果与分析
2.1 ADI的定点突变
为研究ADI关键氨基酸残基的作用,采用定点突变技术首先对ADI突变株M314中氨基酸位点A128、H404、I410进行单点突变以阐明这3个位点对精氨酸脱亚胺酶活性的影响,为进一步双位点的突变研究提供依据。以携带有WT-ADI的 pET24a-ADI质粒为模板,通过全质粒 PCR扩增,获得了长度约为6.5 kb的特异性条带,其中pET24a质粒的长度约为5 300 bp,ADI基因片段大小约为1 250 bp (图1)。经菌落PCR验证后,挑取单克隆过夜培养后提取质粒进行测序鉴定。
经序列比对,突变株序列正确。其中M1 (A128T)、M2 (H404R)、M3 (I410L) 和M4 (A128T/H404R) 分别对应DNA序列382位(G→A)、1 211至1 212位 (AC→GT)、1 228位(A→C)、382位 (G→A) 和 1 211至 1 212位(AC→GT)。说明通过快速定点突变法获得了正确的突变株。
2.2 WT-ADI和ADI突变株的纯化
WT-ADI及突变株M314、M1、M2、M3和M4经 HiPrep DEAE FF离子交换层析和SuperdexTM200凝胶过滤层析后均获得单一条带,纯化后的野生型及突变型ADI的分子量均为46 kDa。SDS-PAGE电泳 (图2) 显示了通过离子交换层析和凝胶过滤层析可以获得电泳纯级别的精氨酸脱亚胺酶。
2.3 ADI野生酶和突变株的酶学性质研究
2.3.1 酶活力比较
结果如表2所示,当pH由6.0升高至7.4时,WT-ADI的比活力从20.20 U/mg降至0.86 U/mg,剩余酶活力仅为4.25%;突变株M1和M2在pH 7.4时比活力分别为3.78 U/mg和8.19 U/mg,与 pH 6.0时相比剩余酶活力分别为 41.17%和76.82%;尽管 M3在 pH 6.0时有较高比活力15.65 U/mg,但在pH 7.4时,剩余酶活力仅为5.05%。鉴于突变位点A128T和H404R对酶活力的显著影响,因此选择了A128T和H404R作为组合进行双位点突变研究;同时,结果显示,M4突变株在pH 6.0时比活力为13.62 U/mg,在pH 7.4时剩余酶活力仍保留72.03%。因此推测,A128T与H404R对ADI在生理中性条件(pH 7.4) 下的酶活力均有显著的促进作用,而I410L对WT-ADI在pH 7.4条件下对酶活力提高无明显作用。
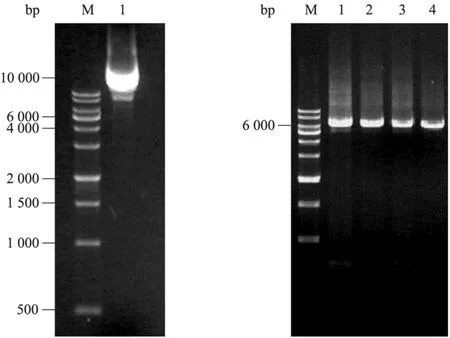
图1 WT-ADI质粒模板和QuikChange定点突变PCR扩增产物Fig. 1 Plasmid template and QuikChange PCR product. M: 1 kb DNA marker; 1: plasmid of WT-ADI; 2: PCR products of the A128T site-directed mutagenesis; 3: PCR products of the H404R site-directed mutagenesis; 4: PCR products of the I410L site-directed mutagenesis; 5: PCR products of the A128T/H404R site-directed mutagenesis.

图2 WT-ADI和ADI突变株M314、M1、M2、M3、M4蛋白质纯化SDS-PAGE电泳图谱Fig. 2 SDS-PAGE analysis of the purified WT-ADI, and ADI mutants M314, M1, M2, M3, M4. (A) 1–3: crude enzyme of WT-ADI, HiPrep 16/10 DEAE column of WT-ADI, SuperdexG-200 gelfiltration of WT-ADI; 4–6: crude enzyme of M314, HiPrep 16/10 DEAE column of M314, SuperdexG-200 gelfiltration of M314. (B) 1–3: crude enzyme of M1, HiPrep 16/10 DEAE column of M1, SuperdexG-200 gelfiltration of M1; 4–6: crude enzyme of M2, HiPrep 16/10 DEAE column of M2, SuperdexG-200 gelfiltration of M2. (C) 1–3: crude enzyme of M3, HiPrep 16/10 DEAE column of M3, SuperdexG-200 gelfiltration of M3; 4–6: crude enzyme of M4, HiPrep 16/10 DEAE column of M4, SuperdexG-200 gelfiltration of M4. M: protein marker.

表2 WT-ADI及其突变酶的酶活力比较Table 2 Specific activity of ADI mutants and WT-ADI
表3显示,在pH 7.4条件下,ADI突变株M1,M2和M4的Km值较野生酶均有显著降低,在pH 7.4时WT-ADI的Km值由4.41 mmol/L分别降至1.07 mmol/L,1.02 mmol/L和0.83 mmol/L。同时,突变株M1,M2和M4的kcat/Km较野生酶均有大幅度的提高,其中 M4在 pH 7.4时的kcat/Km由2 937 L/(mol·s)升至25 060 L/(mol·s)。从表中可以得出,突变株M1,M2和M4在酶与底物的亲和力以及对底物的催化效率方面均有较大提高。
2.3.2 最适反应温度与热稳定性
本实验分别考察了 WT-ADI及其突变酶在pH 6.0和pH 7.4条件下的最适反应温度和热稳定性,结果见图3A和3B。图 3A表明,在pH 6.0条件下WT-ADI及其突变株M314、M1、M2、M3和M4酶的最适反应温度均为40 ℃;在pH 7.4条件下WT-ADI及其突变酶的最适反应温度均为35 ℃ (图 3B)。值得注意的是,作为治疗精氨酸缺陷型癌症的药物,ADI突变株 M1、M2和M4在人体生理温度范围 (35 ℃~ 42 ℃)及生理中性条件下 (pH 7.4) 的酶活力较WT-ADI均有不同程度提高 (图3B)。
图4A表明,在pH 6.0时WT-ADI及其突变酶在低于40 ℃的条件下保温1 h后,ADI各突变酶相对剩余酶活力变化不明显,在40 ℃~60 ℃条件下,WT-ADI及其突变酶相对剩余酶活力下降显著。图4B表明,在pH 7.4时,在20 ℃~40 ℃条件下,WT-ADI及其ADI突变株的相对剩余活力下降幅度较小。在55 ℃~60 ℃条件下保温1 h后,野生型ADI和突变株M314、M1、M2、M3和M4的相对剩余酶活力迅速下降至最低点。因此,各突变位点对ADI的热稳定性无明显影响,WT-ADI及其ADI突变株均在20 ℃~40 ℃条件下表现出较好的热稳定性。

表3 pH 7.4条件下WT-ADI及其突变株的动力学参数Table 3 Kinetics parameters of ADI mutants and WT-ADI at pH 7.4

图3 pH 6.0 (A) 和pH 7.4 (B) 条件下温度对WT-ADI和ADI突变株酶活力的影响Fig. 3 Effect of temperature on activity of ADI mutants and WT-ADI at pH 6.0 (A) and pH 7.4 (B).
2.3.3 最适反应pH与pH稳定性
本实验考察了 WT-ADI及其突变酶的最适反应pH和pH稳定性,结果如图5A和5B。图5A显示,WT-ADI和M3的最适pH为6.0,M314、M1、M2和M4的最适pH均为6.5,并且M314、M1、M2和M4突变酶的活力较野生酶WT-ADI和突变酶M3有不同程度的提高。结果表明,A128T和H404R对ADI的最适pH的提高可能有一定的促进作用。
图5B表明,WT-ADI及其突变株在pH低于6.0时稳定性明显下降,相对剩余酶活力均在pH 5.0~5.5时降至最低点。与WT-ADI和其他突变株相比,M314在pH 5.5~8.5范围内表现出较好的pH稳定性,在pH 5.5时的相对剩余酶活力为90%。

图4 pH 6.0 (A) 和pH 7.4 (B) 条件下WT-ADI和ADI突变株的热稳定性Fig. 4 Thermostability of ADI mutants and WT-ADI at pH 6.0 (A) and pH 7.4 (B).
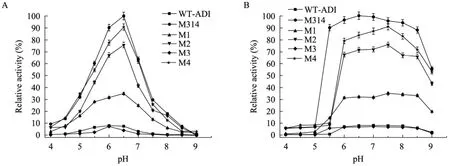
图5 (A) pH对WT-ADI和ADI突变株酶活力的影响;(B) WT-ADI和ADI突变株在不同pH条件下的稳定性Fig. 5 (A) The optimum pH of ADI mutants and WT-ADI; (B) Stability of ADI mutants and WT-ADI at different pHs.
3 讨论
以上结果表明:在酶活力方面,A128T和H404R对ADI在生理中性 (pH 7.4) 条件下的酶活力有显著促进作用,WT-ADI的比活力由0.86 U/mg提高至3.78 U/mg (M1,A128T),8.19 U/mg (M2,H404R) 和9.81 U/mg (M4,A128T/H404R)。在动力学方面,A128T和H404R对ADI在pH 7.4条件下与底物的亲和力以及催化效率均有较大提高,M4的Km值由4.41 mmol/L (野生酶) 降至0.83 mmol/L,kcat/Km由2 937 L/( mol·s)升至25 060 L/( mol·s)。在最适pH方面,A128T和H404R对ADI的最适pH的提高具有促进作用。
由于两者蛋白序列同源性约为84%,以来源于铜绿假单胞菌 Pseudomonas aerµginosa 的ADI蛋白质结构 (PDB: 1RXXX) 为模型,采用Swiss-Model对来源于变形假单胞菌 P. plecoglossicida的ADI突变株M314进行同源结构建模,并对M314各突变位点A128T,H404R和I410L的立体结构进行分析 (图6)。
突变株M1 (A128T) 的酶活力和酶学性质显示,M1在最适反应pH及其稳定性方面,与M314表现一致。在三维模拟结构中 (图 6B),Ala128位于a-螺旋区中的loop上,将其替换成Thr后,一方面,由于Thr较Ala更具亲水性,a-螺旋结构内局部基团间作用力加强,也可能通过盐桥稳定a-螺旋,b-折叠以及ab结构链接的区域,使酶对底物结合能力增强。另一方面,Thr的R基团含有一个羟基,加强了与相邻氨基酸残基Asp131之间的氢键,使酶的空间结构更加稳定。

图6 M314-ADI的立体结构模型 (A) 及其突变位点A128T (B)、H404R (C) 和I410L (D) 的局部立体图Fig. 6 Simulated three-dimensinonal structure of M314 and the stereoscopic view of mutations A128T, H404R, and I410L.
对于 M2 (H404R) 位点的酶活力和酶学性质的研究显示,其对ADI的最适pH的提高有一定的促进作用,使该ADI的最适pH由6.0迁移到6.5。Galkin等研究显示,在铜绿假单胞菌中紧邻催化中心的H405 (相当于本研究的H404位点) 有时会被Arg所取代,其推测H405R是支原体来源的ADI最适pH (6.5) 高于铜绿假单胞菌来源的ADI最适pH (5.6) 可能的原因之一[20],本研究结果也验证了这一推测。本研究中变形假单胞菌来源的 ADI催化中心与铜绿假单胞菌来源的ADI的催化中心一致,从ADI三维模拟结构 (图 6C) 上看,H404同样紧邻催化中心(His278-Cys406-Glu224)。由于His和Arg均属于碱性氨基酸,pI值分别为7.59和10.76,R基pKa分别为6.0和12.48,精氨酸的胍基较组氨酸的咪唑基更易质子化,因此在与底物结合催化的过程中更易形成氢键。此外,精氨酸的胍基基团与其附近的极性基团有很强的相互作用,H404R有可能起到对催化中间体起到稳定作用,并参与氢键网的形成,对2个催化的残基维持离子状态起重要作用。因此,H404R有利于提高ADI酶的最适pH值,及其在中性偏碱条件下的活性和稳定性。
突变株M3 (I410L) 的酶活力和酶学性质显示,M3突变酶与WT-ADI在pH和温度实验中,均与野生酶表现相似。如图6D所示,Ile和leu两者结构相似且均为疏水性氨基酸,且分子大小、等电点也十分相似,在这种情况下的氨基酸替代一般对ADI的最适pH的迁移没有显著影响。
定点突变是研究蛋白质及其功能的一种重要的手段[21],本研究通过快速定点突变,获得了ADI突变株M1 (A128T)、M2 (H404R)、M3 (I410L)、M4 (A128T/H404R),研究了不同突变位点对酶活力和酶学性质的影响,为阐明ADI的酶活力机制及蛋白质的理性改造提供了实验依据。
[1] Whang-Peng J, Cheng AL, Hsu C, et al. Clinical development and future direction for the treatment of hepatocellular carcinoma. J Exp Clin Med, 2010, 2(3): 93−103.
[2] Verhoef C, Visser O, de Man RA, et al. Hepatocellular carcinoma in the Netherlands incidence, treatment and survival patterns. Eur J Cancer, 2004, 40(10): 1530−1538.
[3] Curley SA Jr, Cusack JC Jr, Tanabe KK, et al. Advances in the treatment of liver tumors. Curr Probl Surg, 2002, 39(5): 449−572.
[4] Joshi M. The importance of L-arginine metabolism in melanoma: an hypothesis for the role of nitric oxide and polyamines in tumor angiogenesis. Free Radic Biol Med, 1997, 22(3): 573−578.
[5] Takaku H, Takase M, Abe SI, et al. In vivo anti-tumor activity of arginine deiminase purified from Mycoplasma arginini. Int J Canc, 1992, 51(2): 244−249.
[6] Zhu LL, Verma R, Roccatano D, et al. A potential antitumor drug (Arginine Deiminase) reengineered for efficient operation under physiological conditions. ChemBioChem, 2010, 11(16): 2294−2301.
[7] Feun L, Savaraj N. Pegylated arginine deiminase: a novel anticancer enzyme agent. Expert Opin Investig Drugs, 2006, 15(7): 815−822.
[8] Park IS, Kang SW, Shin YJ, et al. Arginine deiminase: a potential inhibitor of angiogenesis and tumour growth. Br J Cancer, 2003, 89(5): 907−914.
[9] Izzo F, Marra P, Beneduce G, et al. Pegylated arginine deiminase treatment of patients with unresectable hepatocellular carcinoma: results from phase I/II studies. J Clin Oncol, 2004, 22(10): 1815−1822.
[10] Ascierto PA, Scala S, Castello G, et al. Pegylated arginine deiminase treatment of patients with metastatic melanoma: results from phase I and II studies. J Clin Oncol, 2005, 23(30): 7660−7668.
[11] Ensor CM, Holtsberg FW, Bomalaski JS, et al. Pegylated arginine deiminase (ADI-SS PEG20,000mw) inhibits human melanomas and hepatocellular carcinomas in vitro and in vivo. Cancer res, 2002, 62(19): 5443−5450.
[12] Dillon BJ, Prieto VG, Curley SA, et al. Incidence and distribution of argininosuccinate synthetase deficiency in human cancers. Cancer, 2004, 100(4): 826−833.
[13] Ni Y, Li ZW, Sun ZH, et al. Expression of arginine deiminase from Pseudomonas plecoglossicida CGMCC2039 in Escherichia coli and its anti-tumor activity. Curr Microbiol, 2009, 58(6): 593−598.
[14] Ni Y, Liu YM, Schwaneberg U, et al. Rapid evolution of arginine deiminase for improved anti-tumor activity. Appl Microbiol Biotechnol, 2011, 90(1): 193−201.
[15] Ling MM, Robinson BH. Approaches to DNA mutagenesis: an overview. Anal Biochem, 1997, 254(2): 157−178.
[16] Kammann M, Laufs J, Schell J, et al. Rapid insertional mutagenesis of DNA by polymerase chain reaction (PCR). Nucl Acids Res, 1989, 17(13): 5404.
[17] Hogrefe HH, Cline J, Youngblood GL, et al. Creating randomized amino acid libraries with the QuikChange® Multi Site-Directed Mutagenesis Kit: Drug discovery and genomic technologies. Biotechniques, 2002, 33(5): 1158−1160, 1162, 1164−1165.
[18] Liu YM, Sun ZH, Ni Y, et al. Isolation and identification of an arginine deiminase producing strain Pseudomonas plecoglossicida CGMCC2039. World J Microbiol Biotechnol, 2008, 24(10): 2213−2219.
[19] Qian JN, Sun ZH, Liu YP, et al. Determination of L-citrulline in enzymatic conversion solution by diacetylmonoxime-thiosemicarbazide colorimetry. Chin J Pharm, 2007, 38(7): 519−522.钱嘉南, 孙志浩, 刘宇鹏, 等. 二乙酰一肟-氨基硫脲比色法测定酶转化液中的L-瓜氨酸. 中国医药工业杂志, 2007, 38(7): 519−522.
[20] Galkin A, Lu XF, Dunaway-Mariano D, et al. Crystal structures representing the Michaelis complex and the thiouronium reaction intermediate of Pseudomonas aeruginosa arginine deiminase. J Biol Chem, 2005, 280(40): 34080−34087.
[21] Leemhuis H, Kelly RM, Dijkhuizen L. Directed evolution of enzymes: library screening strategies. IUBMB Life, 2009, 61(3): 222−228.

