氧化葡萄糖酸杆菌生物催化1,3-丙二醇合成3-羟基丙酸
孙丽慧,于飞飞,郑裕国
浙江工业大学生物工程研究所,浙江 杭州 310032
3-羟基丙酸 (3-Hydroxypropionic acid,3-HP)是一种重要的有机合成中间体,由于其分子两端分别带有一个羟基和一个羧基,是较为活泼的分子,在合成新型生物可降解性聚合物、个人护理用品、胶黏剂和涂料等方面有着广泛的应用前景[1]。目前,3-HP的生产方法主要是化学合成法,但该方法存在技术难度较大、生产成本高、环境污染严重等缺点[1-2]。随着生物技术的迅猛发展,近年来很多学者研究了利用微生物发酵法生产3-HP,但目前所报道的采用发酵法生产3-HP的野生菌株,产量均较低,只能通过基因工程手段构建高效代谢途径,但需要较多基因的克隆,工程菌的构建具有一定的难度[3-5]。陈国强等将1,3-丙二醇脱氢酶和醛基氧化酶在宿主细胞中共表达,以1,3-丙二醇为原料发酵生产3-HP,最终发酵液中产物浓度最高为 12.1 g/L[6];Rathnasingh等将甘油脱水酶与醛脱氢酶偶联表达,以甘油为底物,最终在发酵液中3-HP产量能够达到38.7 g/L,这也是目前文献报道中利用发酵法能够取得最好的结果[7]。
本研究室前期成功筛选并经诱变得到了一株氧化葡萄糖酸杆菌 ZJB09112 (Gluconobacter oxydans ZJB09112)[8-10],该菌最显著的特点就是在其细胞膜上存在着多种脱氢酶,能够将众多糖醇类化合物不完全氧化,生成相应的产物醛、酮以及酸,这一过程的电子传递链由泛醌、细胞色素O和细胞色素O还原性酶组成,氧作为电子受体,并且该电子传递链与ADP氧化磷酸化形成ATP的过程相耦合[11-14]。由于膜系脱氢酶的氧化产物可以直接分泌到细胞外,催化过程无需跨膜运输,且氧化效率很高,因而近年来对G. oxydans在生物催化应用方面的研究,受到了极大关注。在前期实验中,本课题组已经利用该菌对以甘油为底物合成1,3-二羟基丙酮做了大量的研究工作,并将所取得成果成功地实现了产业化,现已在浙江海正药业股份有限公司构建了年产1 000 t的1,3-二羟基丙酮生产线,生产技术指标达到国际领先水平[12]。目前国内外已经有利用G. oxydans生物催化合成维生素C、米格列醇、葡萄糖酸、D-乳酸、1,3-二羟基丙酮、羟基乙酸等相关研究[11,15-21]。本文以G. oxydans ZJB09112静息细胞作为生物催化剂,利用其不完全氧化特性,催化1,3-丙二醇合成3-HP,反应过程如图1所示,考察了细胞加入量、底物抑制和产物抑制对催化反应的影响,并采取适当的补料方式和生物转化与分离相耦合的手段解除抑制,以提高目标产物终浓度。同时,本研究也能为加深了解G. oxydans不完全氧化醇类化合物的特性奠定一定的理论基础,有助于发现和开拓它在工业催化中的新用途。

图1 氧化葡萄糖酸杆菌生物催化1,3-丙二醇合成3-羟基丙酸Fig. 1 Biocatalysis of 1,3-propanediol to 3-hydroxypropionic acid by Gluconobacter oxydans.
1 材料与方法
1.1 菌种和试剂
氧化葡萄糖酸杆菌 ZJB09112 (G. oxydans ZJB09112),为本实验筛选保藏,于中国典型培养物保藏中心保藏,公共保藏编号为 CCTCC No: M208069。1,3-丙二醇购自Sigma-Aldrich公司;3-HP购自日本东京化成株式会社;树脂购于上海华振有限公司;其他化学试剂均为分析纯。
1.2 培养基
种子培养基 (g/L):酵母粉30,甘油5。
发酵培养基 (g/L):甘油24,甘露醇6,酵母粉 7,蛋白胨 1,MgCl21,(NH4)2SO41,KH2PO41。
1.3 菌体培养方法
从菌种斜面接种两环至装有 50 mL种子培养基的500 mL摇瓶中,于30 ℃、150 r/min振荡培养24 h作为种子。将种子液以10%接种量接入发酵培养基中,于30 ℃、150 r/min发酵培养22 h,离心收集菌体并用生理盐水洗涤2次用于生物转化。
1.4 树脂的选择和预处理
由于 3-HP为弱酸性有机酸 (pKa=4.5),根据离子交换理论,应选用碱性树脂作为原位分离介质。以往研究表明,弱碱性阴离子交换树脂对羟基酸的吸附容量远远超过强碱性阴离子交换树脂。所以,本实验代表性地选取了工业上应用广泛的几种弱碱性阴离子交换树脂,D301 (苯乙烯系)、D314 (丙烯酸系)、D315 (丙烯酸系) 和D335 (环氧系),比较了其对3-HP的吸附性能,并对洗脱剂进行了选择。
树脂预处理:首先将树脂用乙醇浸泡4 h,使其充分溶胀并除去有机杂质;然后用1 mol/L NaOH浸泡24 h,水洗至中性;再用1 mol/L HCl浸泡24 h,水洗至中性;最后用1 mol/L NaOH浸泡24 h,实现树脂转型,水洗至中性,抽滤后保藏备用。
1.5 生物转化反应
50 mL摇瓶中转化:取适量湿菌体,悬浮于缓冲溶液中,加入适量1,3-丙二醇,总反应体系为10 mL。在30 ℃、180 r/min下进行生物转化,反应初速度通过转化前10 min的产物量计算,所有实验均重复3次。
2 L鼓泡塔中转化:初始反应体系为1 L,在控制合适的通气量和pH条件下,定时取样分析底物浓度,通过流加补料的方式和产物原位分离手段解除抑制。
1.6 分析方法
1,3-丙二醇浓度用气相色谱 (GC-14B,日本岛津公司) 检测,色谱柱为HP-5,升温程序为:80 ℃保持2 min,然后以5 ℃/min升温至110 ℃,保持1 min,汽化室与检测器温度均为260 ℃,载气为N2,流速1 mL/min,进样量1 mL,采用外标法定量;3-HP采用高效液相色谱(1100 series,美国安捷伦公司) 检测,色谱柱为Hypersil ODS2,色谱分析条件:流动相为20 mmol/L KH2PO4缓冲液 (用磷酸调pH为2.4),流速0.8 mL/min,紫外检测波长210 nm,柱温35 ℃;进样量20 μL,采用外标法定量。
2 结果与分析
2.1 生物催化1,3-丙二醇合成3-HP
2.1.1 静息细胞浓度对转化反应的影响
在一定程度上,静息细胞的添加量代表着反应体系中的酶浓度,因此提高反应体系中细胞浓度,有助于加快酶催化反应速度。在30 ℃、100 mmol/L柠檬酸盐缓冲液pH 5.5条件下,添加1,3-丙二醇浓度20 g/L,考察细胞浓度对转化反应的影响。从图2结果可知,随着细胞浓度的增加,酶催化反应初速度逐渐增加,当细胞浓度达到6 g/L以后,产物得率和反应初速度均达到了较高水平,继续增加细胞浓度,成本会大大增加,然而对酶催化的转化率和反应初速度却不再有明显增加,一方面,这可能是由于该氧化反应需要较多的氧气参与,而转化瓶中的溶氧有限,从而限制了酶的催化活性,另一方面,反应体系中添加过多的细胞会随着摇床转动,细胞粘附在瓶壁上而未能发挥催化作用。因而综合考虑,选择该转化反应最适细胞浓度为6 g/L。
2.1.2 底物浓度对转化反应的影响
在 30 ℃、100 mmol/L柠檬酸盐缓冲液(pH 5.5) 条件下,细胞浓度6 g/L,考察不同初始底物浓度对转化反应的影响。从图3结果可知,在底物浓度低于15 g/L时,随着底物1,3-丙二醇浓度的增加,酶催化反应初速度及3-HP的终产量均在逐渐增加,而当底物浓度超过20 g/L时,随着底物浓度的增加,底物抑制作用开始显现,酶催化反应初速度及转化率明显下降且3-HP产量也不再增加。因此,需控制底物量不超过20 g/L。
2.1.3 产物浓度对转化反应的影响
在30 ℃、100 mmol/L柠檬酸盐缓冲液pH 5.5条件下,细胞浓度6 g/L,底物浓度20 g/L,考察在转化初始添加不同浓度产物对转化反应的影响。从图4结果可知,产物3-HP对细胞催化活力具有一定的抑制作用,并随着产物添加浓度的增大,抑制作用越来越明显。当初始产物添加量为40 g/L时,酶催化效率仅为对照组的40%,而当产物量达到60 g/L时,催化效率仅为对照组的1%,反应几乎接近终止。因此,反应过程中及时移除产物,减少产物抑制是提高产率的一种重要手段。
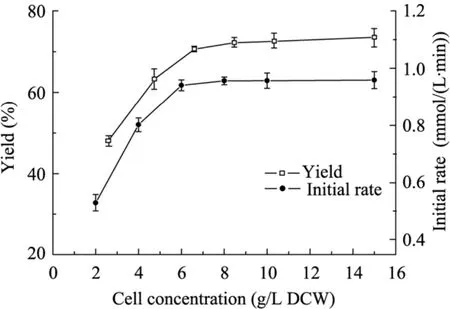
图2 细胞浓度对转化反应的影响Fig. 2 Effect of cell concentration on biotransformation reaction.
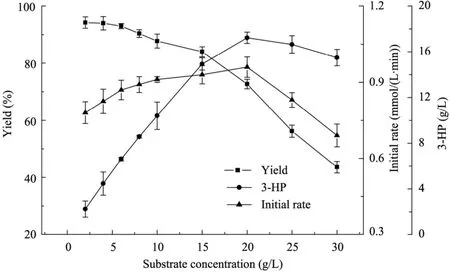
图3 初始底物浓度对转化反应的影响Fig. 3 Effect of initial substrate concentration on biotransformation reaction.
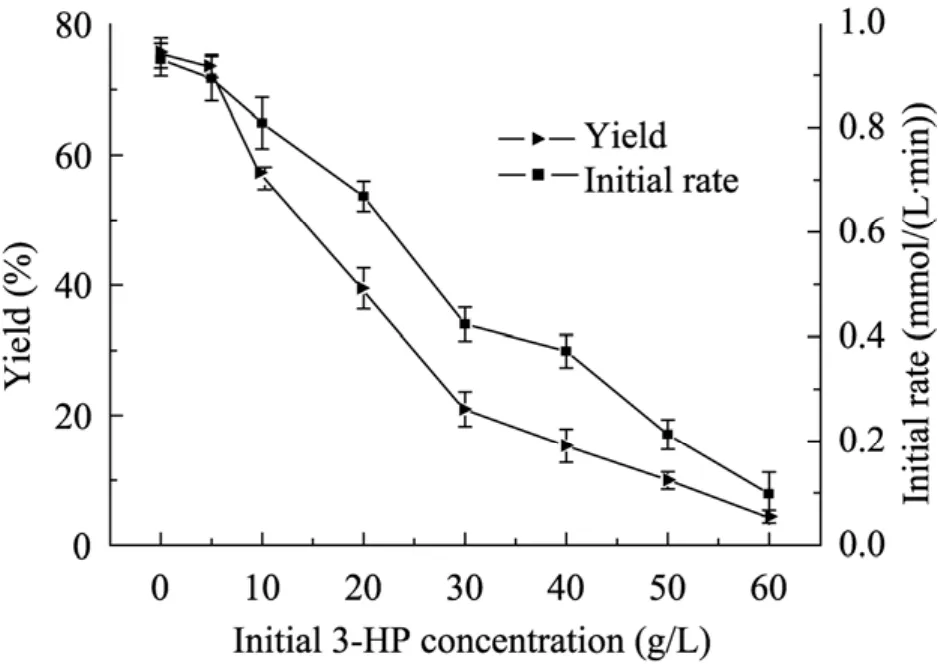
图4 产物添加量对转化反应的影响Fig. 4 Effect of different addition concentration of product on biotransformation reaction.
2.1.4 pH对转化过程的影响
反应体系中pH值不仅影响底物分子的离子化状态,也能够影响酶蛋白分子的离子化状态,从而影响酶催化反应的效率。在 30 ℃的条件下,选取柠檬酸盐缓冲液 (pH 3.0~6.0)、磷酸盐缓冲液 (pH 5.0~6.0) 和 Tris-HCl缓冲液(pH 6.0~8.0),缓冲液浓度均为100 mmol/L,在10 mL反应体系中,底物1,3-丙二醇加入浓度为20 g/L,细胞加入浓度6 g/L,反应20 min,考察不同缓冲溶液中pH值对酶催化活性的影响。从图5结果可知,当pH值在5.5时,酶表现出最大的活力,且在以柠檬酸盐缓冲液中酶活力相对最高,但考虑柠檬酸影响后期树脂吸附能力,因此选择转化体系为pH 5.5的磷酸盐缓冲液。
图6为在30 ℃、细胞浓度6 g/L,底物浓度20 g/L,通气量60 L/h,初始pH 5.5,1 L鼓泡塔体系中,考察pH控制与否对转化过程的影响。从结果可知,对于该转化反应,若不控制 pH,伴随着产物 3-HP的积累,会导致反应体系 pH的逐渐下降,当反应进行到6 h,pH就已迅速降到 4.0,而酶作为生物催化剂,都存在一个最适合的pH范围,当pH降到3.8时,目标产物基本不再积累,此时pH控制在5.5恒定组转化率已高达90.1%,而对照组仅为65.5%。实验结果表明pH维持在5.5时有利于3-HP的合成。
2.1.5 用流加补料方式转化1,3-丙二醇合成3-HP
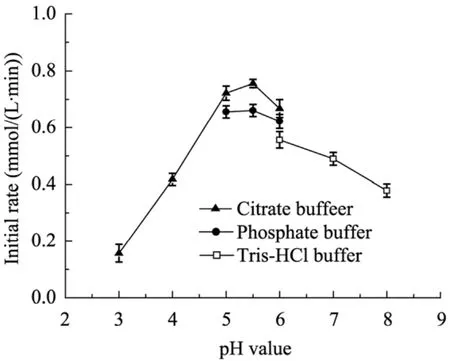
图5 缓冲液pH值对转化反应的影响Fig. 5 Effect of buffer pH on biotransformation reaction.
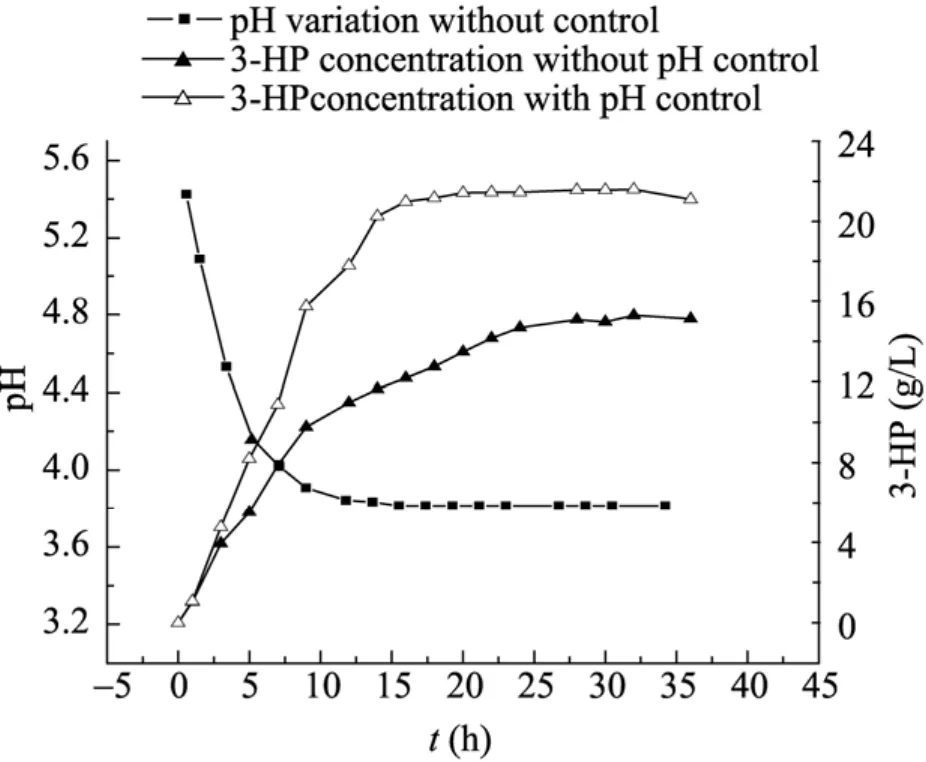
图6 pH对转化过程的影响Fig. 6 Effect of pH on biotransformation process.
摇瓶转化实验表明,当底物浓度超过20 g/L就会对细胞催化活性产生抑制作用,为了消除底物抑制作用,在30 ℃、细胞浓度6 g/L,初始底物浓度20 g/L,通气量60 L/h,pH 5.5条件下,1 L鼓泡塔体系中,定期取样,采取手动间歇补加底物1,3-丙二醇的方式,控制催化过程中底物浓度维持在15~20 g/L,结果如图7所示。在催化反应初期 (0~15 h),产物迅速积累,当产物达到40 g/L时,产物抑制效应逐渐显现,产物合成速率下降。由于在鼓泡塔中能够较好地控制通气条件和恒定的pH值,因此与摇瓶中转化反应相比,产物浓度和催化效率都有明显的提高,当产物浓度积累到60 g/L时,产物抑制效应明显,转化反应基本停止。经过60 h的催化反应,3-HP的浓度达到60.8 g/L,生产强度为1.0 g/(L·h),转化率为84.3%。
2.2 生物转化与分离相耦合合成3-HP
2.2.1 树脂的选择
离子交换树脂具有吸附容量大、吸附选择性强、速度快、易解析、易再生等优点,因而在转化体系中引入吸附树脂可以吸附产物以减轻转化液中的产物抑制效应。实验选取了几种对有机酸有较好交换容量的弱碱性阴离子交换树脂,配制成一定浓度的3-HP溶液,用氢氧化钠调节pH至5.5左右,分别加入相同质量的树脂于30 ℃、180 r/min条件下吸附120 min,从图8可以看出,树脂D335对3-HP吸附能力最强。
2.2.2 洗脱剂的选择
D335是一种弱碱性环氧系阴离子交换树脂,选择适合的洗脱剂,有利于提高目标产品的收率。向1.0 g吸附饱和3-HP的D335树脂中分别加入5 mL 1.0 mol/L的NaCl、HCl、H2SO4、NH4OH和NaOH溶液,静态洗脱24 h,考察了几种洗脱剂对3-HP的洗脱效果,如图9所示。可以看出,在该条件下 Cl-和 SO42-离子在树脂D335上的吸附力要强于OH-离子,选用NaCl、 HCl和 H2SO4作为洗脱剂,解析率都可达到80%以上,其中用HCl解析的效果最好,最终回收率可达 90%,因此选用 1.0 mol/L HCl作为3-HP的洗脱剂。
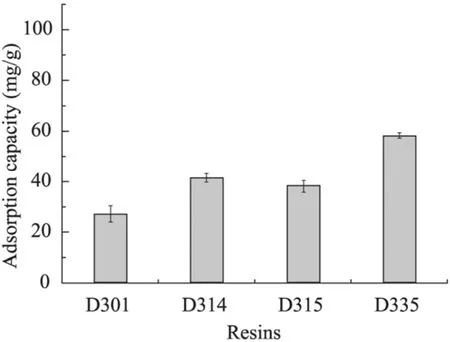
图8 不同树脂对3-羟基丙酸的吸附能力Fig. 8 The adsorption capacity of 3-hydroxypropionic acid by different resins.

图9 不同洗脱剂对吸附3-羟基丙酸的D335树脂的洗脱情况Fig. 9 Elution of 3-hydroxypropionic acid adsorbed on D335 by different eluants.
2.2.3 生物转化与分离相耦合合成3-HP
从上述结果可以看出,3-HP对该酶催化反应具有明显的抑制作用,当产物浓度积累到60 g/L时,产物抑制效应明显,转化反应基本停止。为减轻产物抑制,获得高浓度3-HP并提高生产强度,需要及时将生成的产物移除。因此,本实验选用如图10所示的生物转化与分离相耦合技术,利用中空纤维膜实现细胞的循环,同时利用阴离子交换树脂D335对反应产生的产物不断进行吸附,从而在一定程度上减少产物的抑制作用,提高产物浓度和转化效率。
由于在反应的起始阶段产物3-HP的产量较少,所以不启动分离耦合装置,待反应进行到12 h以后,开始进行生物转化与分离耦合。从图11结果可知,采用分批补料生物转化与分离耦合合成3-HP,在不计算树脂上吸附3-HP的量时,经过50 h的转化反应,3-HP的浓度可达59.8 g/L。若将 D335树脂上吸附的 3-HP充分洗脱,并与转化液中3-HP的量合并计算,目标产物总产量达76.3 g/L,转化率83.7%,生产强度为1.5 g/(L·h)。
陈国强等以1,3-丙二醇为原料,利用工程菌发酵生产 3-HP,可获得最高产物浓度为12.1 g/L[6];Rathnasingh等利用工程菌,以甘油为底物,可获得最高产物浓度为 38.7 g/L,该结果也是目前报道中的最高产量[7]。本文利用G. oxydans生物转化生产 3-HP,并获得了最终目标产物总产量达 76.3 g/L,生产强度为1.5 g/(L·h),本研究中的产物浓度远远超过了利用工程菌发酵法获得的最高产量38.7 g/L。由于在生物转化中存在底物和产物抑制效应,若能对本研究中的鼓泡塔中的放大催化工艺以及生物转化与分离相耦合的过程进一步优化,目标产物浓度和生产强度还有提升的空间和潜力。
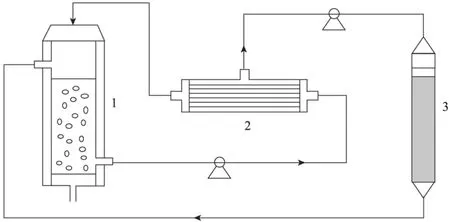
图10 生物转化与分离耦合装置图Fig. 10 Schematic diagram for bioconversion coupled with in situ product removal. 1: bubble column reactor; 2: hollow fiber membrane; 3: rein packed column.
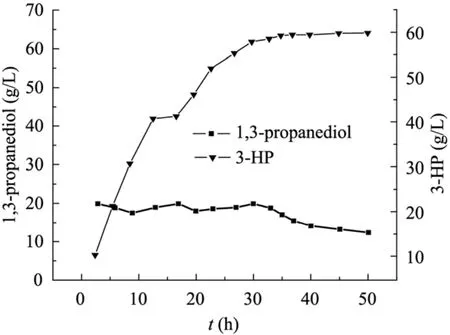
图11 分批补料生物转化-分离耦合转化产3-HPFig. 11 Fed-batch biotransformation of 1,3-propanediol to 3-hydroxypropionic acid coupled with in situ product removal.
3 结论
利用实验室保藏的G. oxydans ZJB09112生物催化 1,3-丙二醇合成 3-HP,在所考察的因素中,发现高浓度底物 (≥20 g/L) 和高浓度产物对细胞催化效率和产物合成有明显的抑制效应,并确定了最佳摇瓶催化反应条件:6 g/L (DCW)菌体量,pH 5.5。为消除底物抑制作用,在1 L鼓泡塔中,利用流加补料方式维持反应体系中底物浓度在15~20 g/L,经过60 h的催化反应,3-HP的浓度达到60.8 g/L,生产强度为1.0 g/(L·h),转化率为 84.3%。为同时减轻底物和产物抑制效应,本研究采用生物转化与D335阴离子交换树脂原位分离相耦合的方法,及时将部分生成的产物移除,经过50 h的转化反应,3-HP的总产量达76.3 g/L,生产强度为1.5 g/(L·h),转化率为83.7%。
[1] Jiang XL, Meng X, Xian M. Biosynthetic pathways for 3-hydroxypropionic acid production. Appl Microbiol Biotechnol, 2009, 82(6): 995−1003.
[2] Behr A, Botulinski A, Carduck F, et al. Process for preparing 3-hydroxypropionic acid: EP, 0579617. 1994-01-26.
[3] van Maris AJA, Konings WN, van Dijken JP, et al. Microbial export of lactic and 3-hydroxypropanoic acid: implications for industrial fermentation processes. Metab Eng, 2004, 6(4): 245−255.
[4] Gokarn Ravi R. 3-hydroxypropionic acid and other organic compounds: US, 20090053783. 2009-02-26.
[5] Jo JE, Raj SM, Rathnasingh C, et al. Cloning, expression, and characterization of an aldehyde dehydrogenase from Escherichia coli K-12 that utilizes 3-Hydroxypropionaldehyde as a substrate. Appl Microbiol Biotechnol, 2008, 81(1): 51−60.
[6] Chen GQ, Shi ZY, Zhang L, et al. Method for producing 3-hydroxypropionic acid: CN, 101445813A. 2009-06-03.陈国强, 石振宇, 张磊, 等. 一种生产 3-羟基丙酸的方法: CN, 101445813A. 2009-06-03.
[7] Rathnasingh C, Raj SM, Jo JE, et al. Development and evaluation of efficient recombinant Escherichia coli strains for the production of 3-hydroxypropionic acid from glycerol. Biotech Bioeng, 2009, 104(4): 729−739.
[8] Hu ZC, Liu ZQ, Zheng YG, et al. Production of 1,3-dihydroxyacetone from glycerol by Gluconobacter oxydans ZJB09112. J Microbiol Biotech, 2010, 20(2): 340−345.
[9] Hu ZC, Zheng YG, Shen YC. Dissolvedoxygen-stat fed-batch fermentation of 1,3-dihydroxyacetone from glycerol by Gluconobacter oxydans ZJB09112. Biotechnol Bioproc E, 2010, 15(4): 651−656.
[10] Hu ZC, Zheng YG. A high throughput screening method for 1,3-dihydroxyacetone-producing bacterium by cultivation in a 96-well microtiter plate. J Rapid Meth Aut Microbiol, 2009, 17(2): 233−241.
[11] Gao KL, Wei DZ. Asymmetric oxidation by Gluconobacter oxydans. Appl Microbiol Biotechnol, 2006, 70(2): 135−139.
[12] Sun LH, Hu ZC, Zheng YG, et al. Progress in metabolic engineering of microbial production of 1,3-dihydroxyacetone. Chin J Biotech, 2010, 26(9): 1218−1224.孙丽慧, 胡忠策, 郑裕国, 等. 微生物法生产1,3-二羟基丙酮代谢工程研究进展. 生物工程学报, 2010, 26(9): 1218−1224.
[13] Deppenmeier U, Hoffmeister M, Prust C. Biochemistry and biotechnological applications of Gluconobacter strains. Appl Microbiol Biotechnol, 2002, 60(3): 233−242.
[14] Li MH, Wu J, Lin JP, et al. Expression of Vitreoscilla hemoglobin enhances cell growth and dihydroxyacetone production in Gluconobacter oxydans. Curr Microbiol, 2010, 61(5): 370−375.
[15] Herrmann U, Merfort M, Jeude M, et al. Biotransformation of glucose to 5-keto-d-gluconic acid by recombinant Gluconobacter oxydans DSM 2343. Appl Microbiol Biotechnol, 2004, 64(1): 86−90.
[16] Claret C, Salmon JM, Romieu C, et al. Physiology of Gluconobacter oxydans during dihydroxyacetone production from glycerol. Appl Microbiol Biotechnol, 1994, 41(3): 359−365.
[17] Wei GD, Yang XP, Zhou WY, et al. Adsorptive bioconversion of ethylene glycol to glycolic acid by Gluconobacter oxydans DSM 2003. Biochem Eng J, 2009, 47(1/3): 127−131.
[18] Gao KL, Zhang SL, Wei DZ. Enhancement of Gluconobacter oxydans catalyzing D-lactic acid production by coupling of synthesis and separation. J Chem Technol Biotechnol, 2009, 84(11): 1742−1746.
[19] Wei GD, Wei DZ, Lin JP. Enantioselective oxidation of 2-methyl-1,3-propanediol tob-hydroxyisobutyric acid using whole cells of Gluconobacter oxydans DSM 2003. Food Fermen Ind, 2010, 36(8): 12−16.魏国栋, 魏东芝, 林金萍. 氧化葡萄糖酸杆菌立体选择催化 2-甲基-1,3-丙二醇合成(R)-b-羟基异丁酸. 食品与发酵工业, 2010, 36(8): 12−16.
[20] Wei LJ, Yang XP, Gao KL, et al. Characterization of enzymes in the oxidation of 1,2-propanediol to D-(-)-lactic acid by Gluconobacter oxydans DSM 2003. Mol Biotechnol, 2010, 46(1): 26−33.
[21] de Muynck C, Pereira C, Soetaert W, et al. Dehydrogenation of ribitol with Gluconobacter oxydans: production and stability of L-ribulose. J Biotechnol, 2006, 125(3): 408−415.

