大鼠骨髓间充质干细胞生物学特性的研究
徐金霞 李家锋 韩建国 管海虹 崔 群 孙秀英
1.徐州医学院口腔医学院,江苏徐州 221004;2.徐州医学院附属徐州市立医院口腔颌面外科,江苏徐州 221002
1968年,Friedenstein等[1]首先发现在骨髓的体外培养中含有少量梭形贴壁细胞,继续培养一段时间后,可见细胞形成类似骨和软骨的细胞团块。Owen等[2]研究也发现骨髓中存在贴壁的细胞集落,并将其命名为成纤维样细胞集落形成单位。经过大量的研究证实,骨髓中确实存在这类细胞,被称为骨髓间充质干细胞(bone marrow mesenchymal stem cells,BMSCs),它是一种未充分分化的类中胚层细胞,与骨、软骨及神经等组织的起源具有相关性,可在特定的条件下定向诱导分化为成骨细胞、软骨细胞、神经样细胞等,具有来源广泛,免疫排斥反应较轻,具有可自体移植和异体移植等优势[3-4]。但是,骨髓中BMSCs的含量极少。本研究采用密度离心法和全骨髓贴壁法,对BMSCs进行体外分离、培养,观察其增殖及生长的特性。旨在建立一种对BMSCs进行分离、培养及鉴定的实验方法,并对其生物学特征进行观察,为进一步体外BMSCs向成骨细胞分化奠定基础,现报道如下。
1 材料与方法
1.1 一般材料
低糖DMEM/F12培养基(10%胎牛血清+0.1%青链霉素,Gibco,Ameriean);胎牛血清(杭州四季青生物有限公司);胰蛋白酶(碧云天生物有限公司);青链霉素(碧云天生物有限公司);PBS缓冲液(北京中杉金桥公司);CD29-FITC、CD90-FITC、CD34-FITC兔抗鼠抗体(Biolegend公司,美国);CCK-8(同仁化学研究所,日本)。
1.2 实验动物
3周龄健康清洁级SD大鼠,4只,体重约18~20 g,由徐州医学院实验动物中心提供。
1.3 实验方法
1.3.1 大鼠BMSCs的分离培养 应用颈椎脱臼法处死大鼠,于0.5%的碘伏溶液中浸泡3 min,在无菌条件下取其双侧股骨和胫骨,PBS漂洗一遍,用含10%胎牛血清的PBS冲洗骨髓腔,收集冲洗液于15 mL离心管中,2 000 rpm离心10 min,吸取中间白色絮状单核细胞层,所得细胞按1×108/mL密度接种于25 cm×25 cm塑料培养瓶中,加入3~5 mL低糖DMEM/F12培养基,吹打均匀,于37℃,5% CO2培养箱孵育。
1.3.2 大鼠BMSCs原代培养 将培养瓶置于37℃,5%CO2饱和湿度下培养5 d,首次更换培养基,弃去未贴壁细胞,此后每2~3天换液1次,倒置显微镜下观察细胞形态变化。
1.3.3 大鼠BMSCs传代培养 倒置显微镜下观察,当原代细胞处于80%~90%融合阶段时进行传代培养,一般2~3 d传代1次。吸除培养瓶内培养基,加入2 mL PBS漂洗一遍,再向瓶内加0.25%的胰蛋白酶2~3 mL,消化收集细胞。在室温下,把培养瓶放在倒置显微镜下观察,当发现细胞质回缩至细胞近圆形时,直接加入5 mL DMEM/F12培养基,低糖DMEM/F12培养基立即终止消化。1 200 rpm离心5 min,弃上清液,加入低糖DMEM/F12培养基,混匀,把细胞悬液分成等份分装入数个培养瓶中,按1︰3的比例传代。
1.3.4 大鼠BMSCs表面标志物的检测 取生长良好的第3代细胞BMSCs,待细胞铺满培养瓶80%左右时,吸掉培养基,用0.25%胰蛋白酶室温消化1~2 min,将贴壁细胞消化分离,1 200 rpm离心5 min后收集细胞,用细胞计数板计数细胞量,PBS漂洗2遍,用PBS悬浮细胞,密度为1×106/mL,将收获的BMSCs按每支流式管2×104个分别和CD29-FITC、CD90-FITC、CD34-FITC单抗反应,设立1支空白对照组,在37℃水温箱中水浴、避光反应30 min,PBS漂洗1遍后,应用流式细胞仪(FCM)进行表面抗原的鉴定,应用WinMDI2.9软件分析结果。
1.3.5 大鼠BMSCs的生长与增殖曲线 取4块96孔板,将第1、3代细胞以5×103/cm2的密度各接种于每块培养板的6个孔中,每孔加入低糖DMEM/F12培养基100 μL,在其周围空白孔中只加入低糖DMEM/F12培养基100 μL作为空白对照孔,置于37℃,5%CO2培养箱中培养,实验孔和对照孔每3天换液1次。此后每2天固定时间,随机抽取1板,测定光吸收值(OD)。测量时每孔加入CCK-8溶液10 μL以后,继续在37℃,5%CO2培养箱中培养1~2 h后,观察培养基颜色变化,直至培养基变为橙色,酶联免疫测定仪设定检测波长492 nm,测定OD值。取6孔OD值的均值,以时间为横坐标,以实验孔OD值与空白对照孔OD值差值的均数为纵坐标,应用SPSS16.0软件绘制细胞生长曲线。
1.4 统计学处理
采用SPSS16.0统计软件建立数据库,计量资料采用(x ± s)表示,应用独立样本t检验,检验水准α=0.05,P<0.05为差异有统计学意义。
2 结果
2.1 大鼠BMSCs的细胞形态学观察
在原代培养换液之前,倒置显微镜下观察,可见大量血细胞悬浮在培养基中。第5天,首次换液见贴壁细胞大部分呈圆形、椭圆形、部分细胞伸出伪足变成纺锤形或梭形,见图1。随着换液非贴壁细胞被逐渐清除;随着细胞的生长、分化,第8~10天可见其形态大部分呈梭形,细胞呈单层生长并铺满整个培养瓶底。传代后细胞扩增分化,第3代呈梭形,排列规则,见图2。传至第8代时,细胞增殖能力有所下降,细胞形态发生明显改变,大部分呈不规则形,排列紊乱,呈树枝状,见图 3。

图1 大鼠BMSCs原代培养第5天观察结果(×100)

图2 大鼠BMSCs传代培养第3代观察结果(×100)
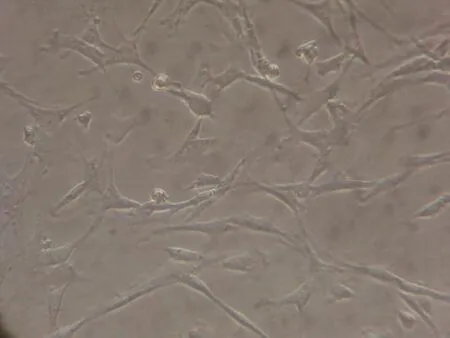
图3 大鼠BMSCs传代培养第8代观察结果(×100)
2.2 大鼠BMSCs的表面抗原的鉴定
对大鼠第3代细胞进行FCM检测,结果显示CD29的表达率为94.97%,CD90的表达率为88.50%,CD34的表达率为2.23%,见图4。结果表明分离培养的第3代细胞表型均一,基本符合BMSCs的表型特点。
2.3 大鼠BMSCs体外培养生长曲线的测定
CCK-8法测定细胞活性并绘制第1、3代细胞增殖曲线,两组生长曲线近似倒S形。接种后第2~4天细胞活性略降低,经过2~3 d的潜伏期后进入对数生长期,约在第6天到达平台期,第8天细胞出现生长抑制。实验组第3代细胞比对照组第1代细胞增殖速度显著加快,两组比较,差异有统计学意义(P<0.05)。见图5。
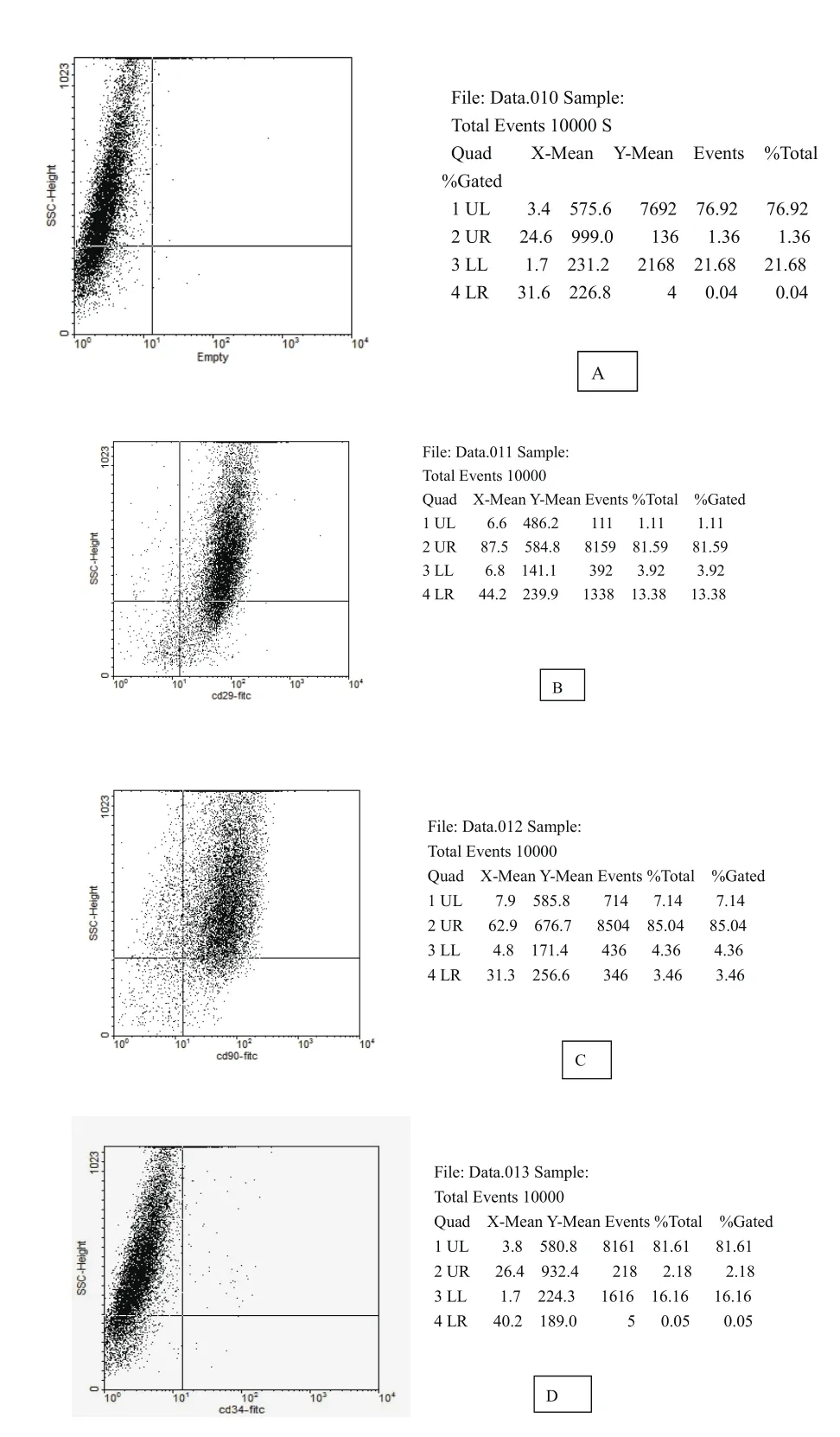
A:空白对照组;B:CD29;C:CD90;D:CD34图4 BMSCs表面抗原CD29、CD90及CD34的表达

图5 第1、3代BMSCs生长曲线
3 讨论
BMSCs是一类具有多向分化潜能的组织干细胞,具有强大的自我复制能力,在组织工程领域得到广泛应用[5]。对BMSCs研究的不断深入,为解决骨、软骨、神经细胞来源匮乏的难题提供了新领域。但是,骨髓中BMSCs含量很低,约为0.001%~0.010%,因此,BMSCs的诱导分化成功与否取决于是否能够实现其体外的分离、培养及扩增。近年来,BMSCs的常用分离方法包括密度离心法、全骨髓培养法、流式细胞仪法和免疫磁珠法。由于流式细胞仪法及免疫磁珠法成本较高、对细胞损伤大,较少使用。骨组织工程理想的种子细胞应该具备以下特点:(1)来源广泛,取材容易;(2)具有较强的自我更新能力;(3)在体外和体内易于向成骨细胞定向分化;(4)能适应支架材料和受区的微环境。本研究采用了密度离心法及全骨髓贴壁法,所得到细胞经传代培养,可获得形态均一,排列规则,生长稳定的第3代细胞,为实现BMSCs体外快速扩增提供实验依据,也为其成骨诱导分化奠定了基础。
然而,迄今关于BMSCs的鉴定尚无公认的金标准。尽管BMSCs与造血干细胞共同存在于骨髓中,却不表达造血细胞的表面抗原。已有研究报道,BMSCs的表面标志具有非专一性,主要有 CD29、CD44、CD71、CD90、CD106、CD105、SB-10、SH-3、SH-4等多种表面抗原标志呈阳性,不表达骨髓造血干细胞的表面标志,主要有CD34,CD45等[6-7]。本研究检测了分离得到的细胞的表面标志CD29的表达率为94.97%,CD90的表达率为88.50%,CD34的表达率为2.23%,此结果与以往文献报道相吻合[8-9],与细胞形态学相结合,表明分离培养的细胞为BMSCs。由于BMSCs表面标志的非特异性,还没有筛选BMSCs特异性的分子标志,因此其鉴别主要依据形态学和表面标志相结合的方法进行综合判断。总之,本研究所采用的密度离心与全骨髓贴壁法是一种行之有效的分离大鼠BMSCs的方法,该细胞具有增殖能力较强,纯度较高的特点,可以作为组织工程的种子细胞,为BMSCs成骨诱导分化提供理论依据,为骨组织工程的临床应用带来了曙光。
[1] Friedenstien AJ. Precursor cells of mechanocytes[J].Int Rev Cytol,1976,47:327-359.
[2] Owen ME,Cave J,Joyner CJ.Clonal analysis in vitro ofosteogenic differentiation of marrow CFU-F[J].J Cell Sci,1987,87:731-738.
[3] Caplan AI.Mesenchymal stem cells[J].J Orthop Res,1991,9(5):641-650.
[4] Arnold I,Scott P.Mesenchymal stem cells:building blocks formolecular in the 21st century[J].Trends Mol Med,2001,7(6):259-264.
[5] Weiss ML,Medicettya S,Bledsoe AR,et a1.Human umbilical cord matrixstem cells:preliminary characterization and effect of transplantation in arodent model of Parkinson’s disease[J].Stem Cells,2006,24(3):781-792.
[6] Colter DC,Sekiya I,Prockop DJ,et al.Identification of a subpopulation of rapidly self-renewing and multipotential adult stem cells in colonies of human marrow stromal cells[J].Proc Natl Acad Sci USA,2001,98(14):7841-7845.
[7] Liu TM,Martina M,Hutmacher DW,et al.Identification of common pathways mediating differentiation of bone marrow and tissue-derived human mesenchymal stem cells into three mesenchymal lineages[J].StemCells,2007,25(3):750-760.
[8] Pittenger MF,Mackay AM,Beck SC,et al.Multilineage potential ofadult human mesenchymal stem cells[J].Science,1999,284(5411):143-146.
[9] Mareschi K,Ferrero I,Rustichelli D,et a1.Expansion of mesenchymal stem cells isolated from pediatric and adult donor bone marrow[J].J Cell Biochemistry,2006,97(4):744-754.

