老年患者胃肠道间质瘤预后因素分析
乔静静 张保国 陈锦飞
胃肠道间质瘤(GIST)是一组来源于胃肠道间叶组织的软组织肿瘤,以c-kit(CD117)阳性为组织学标志,并且大部分GIST的c-kit基因都会发生突变[1]。GIST对于传统的放化疗并不敏感,临床上很多接受外科手术的GIST患者并没有进行特殊的药物治疗,酪氨酸激酶受体抑制剂伊马替尼(格列卫)的出现抑制了一部分术后GIST的复发。临床上对于GIST良恶性的判断很困难,本文就老年患者的GIST预后相关因素进行分析,以期为临床诊疗提供依据。
1 资料和方法
1.1 临床资料44例≥65岁老年胃肠道间质瘤患者,均为2001年1月至2010年12月南京医科大学附属南京第一医院住院患者。男25例,女19例,年龄65~82岁,平均(71.6±10.5)岁。肿瘤位于胃24例,位于小肠9例,位于结肠2例,位于食管2例,位于胃肠外7例。所有的患者均接受手术治疗,18例行完全切除手术,其中2例死亡,26例行局部切除治疗,其中9例死亡。肿瘤直径1~21 cm,平均(7.6±4.8)cm,14例发生转移。其中5例患者术后复发均接受伊马替尼治疗。术后未接受任何放化疗和分子靶向治疗。所有的标本均由病理科医师重新阅片确诊,临床病理资料均完整。44例均通过复阅HE染色切片,并都经过免疫组织化学染色检测确诊为GIST。
1.2 病理资料收集复阅HE染色切片,阅片同时选取肿瘤核分裂最明显的蜡块,全部病例均由本院病理科医师重新诊断,且对可疑病例均进行免疫组化染色检测。GIST的生物学行为分级参照Fletcher等[2]的分级标准:(1)极低危险组:肿瘤直径<2 cm,核分裂相<5/50高倍视野;(2)低危险组:肿瘤直径2~5 cm,核分裂相<5/50高倍视野;(3)中危险组:肿瘤直径<5 cm,核分裂相6~10/50高倍视野,或者肿瘤直径5~10 cm,核分裂相<5/50高倍视野;(4)高危险组:肿瘤直径>5 cm,核分裂相>5/50高倍视野,或者肿瘤直径>10 cm,任何核分裂相,或者不论肿瘤大小,核分裂相>10/50高倍视野。
1.3 免疫组织化学染色所有的病例标本均为4%甲醛固定,常规石蜡包埋,HE染色,光学显微镜观察。免疫组织化学检测采用三步法。试剂有CD117、CD34、VIM、Desmin、Actin、S-100、NSE。试剂全部购自福州迈新生物技术开发有限公司。
1.4 随访及统计学分析随访采用门诊复查、信访及电话的方式进行。生存时间为手术日到随访截止日或死亡的日期,以月为单位。统计学分析采用SPSS软件,单因素生存分析采用Kaplan-Meier法,多因素生存分析采用Cox比例风险模型。P<0.05为差异有统计学意义。
2 结果
2.1 临床病理资料44例GIST中,极低危险组26例,死亡2例;低危组4例,死亡1例;中危组5例,死亡2例;高危组9例,死亡6例。CD117阳性41例,CD34阳性30例,VIM阳性14例,Desmin阳性4例、Actin阳性4例,S-100弱阳性1例,NSE弱阳性1例。
2.2 生存分析结果≥65岁老年胃肠道间质瘤患者1年生存率为97.7%,3年生存率为59.1%,5年生存率为27.3%。其中肿瘤位于结肠的患者预后比肿瘤位于胃、小肠、食管、胃肠外的患者预后差(P<0.01)。肿瘤直径≥10 cm的患者预后比肿瘤直径<10 cm的差(P<0.01)。老年胃肠道间质瘤患者核分裂相6~10/50高倍视野和核分裂相>10/50高倍视野的预后比核分裂相≤5/50高倍视野的患者差(P<0.01)。根据GIST的Fletcher等的分级标准,低危组、中危组、高危组的预后比极低危险组差(P<0.01)。见表1。
3 讨论
GIST是临床上一种很少见的肿瘤,近年来众多学者都认为GIST起源于Cajal间质细胞(ICCS)[3],既不同于胃平滑肌瘤也不同于神经鞘瘤。GIST已被很多临床医生认为是具有潜在恶性的肿瘤,其良恶性很难界定,正确地评估预后对于患者的积极治疗和消除复发因素具有临床意义,特别是对于GIST发病率相对较高的老年患者[4]。近年来众多学者对胃GIST的预后进行了大量的研究,但是结果却并不是十分统一。
文献报道GIST最常来自于胃(60%~70%),其次是小肠(25%~35%),很少发生于结肠、直肠(5%)和食道(<2%)[4]。在本研究中,肿瘤位于胃的占54.5%,位于小肠的占20.5%,位于结肠的占4.5%,位于食道的占4.5%,还有位于胃肠道以外的占16%。44例老年GIST单因素生存分析发现位于结肠的患者预后最差(P<0.01)。Rutkowski等[5]发现位于胃以外的间质瘤比位于胃的间质瘤预后差。
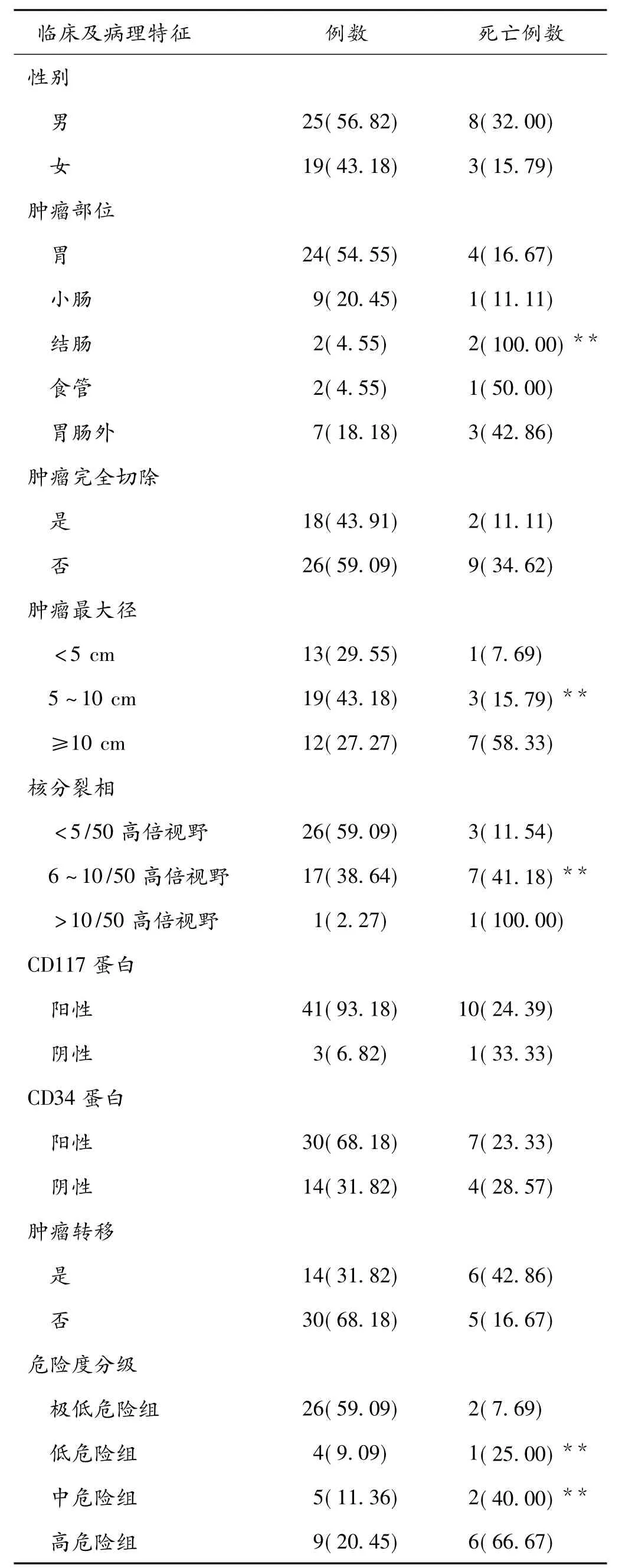
表1 44例GIST老年患者临床病理特征与预后的相关性分析结果(n,%)
近年来,GIST的肿瘤大小和核分裂相被大家公认为是评估预后的因素[6-8]。本研究发现,老年GIST患者中肿瘤直径≥10 cm的患者预后比肿瘤直径<10 cm的差(P<0.01),核分裂相6~10/50高倍视野和核分裂相>10/50高倍视野的预后比核分裂相≤5/50高倍视野的患者差(P<0.01)。
Fletcher等依据肿瘤大小和核分裂相建立起来的GIST的分级标准已在临床被广泛用于GIST的危险度分级,本研究也依据这个分级标准进行单因素生存分析发现低危组、中危组、高危组的预后比极低危险组差(P<0.01)。这个分级标准是建立在肿瘤大小和核分裂相的基础上的,GIST采用Fletcher等的分级标准评估预后更方便和全面。按照多因素分析,本研究发现肿瘤的大小、核分裂相、GIST的分级标准是独立的预后影响因素。都可以作为独立的因素应用于临床的预后评估。
目前GIST的治疗还是以手术为主,其对传统的放化疗不敏感,但是酪氨酸激酶受体拮抗剂伊马替尼的出现大大降低了GIST的复发和死亡率。本研究收集的病例全部接受了手术治疗但是都没有接受伊马替尼的治疗,有5位患者复发,复发率为11.4%,复发患者全部接受伊马替尼分子靶向治疗。但现在研究已发现有一部分患者已经对伊马替尼产生了原发及继发耐药,新一代的多靶点分子靶向治疗药物舒尼替尼已作为耐药患者的新药应用于临床[9]。
综上所述,很多因素都会影响GIST的预后,如肿瘤的发病部位、肿瘤直径>10 cm、肿瘤的核分裂相>10/50高倍视野以及其他的一些新的分子标志。正确地评估预后临床上还是依赖于相关的临床病理因素,Fletcher等依据肿瘤大小和核分裂相建立起来的GIST的分级标准仍是评估预后的好的工具,可以为临床医生提供合理的参考,有助于患者的合理治疗。
[1]Miettinen M,Kopczynski J,Makhlouf HR,et al.Gastrointestinal stromal tumors,intramural leiomyomas,and leiomyosarcomas in the duodenum:a clinicopathologic,immunohistochemical,and molecular genetic study of 167 cases[J].Am J Surg Pathol,2003,27(5):625-641.
[2]Fletcher CD,Berman JJ,Corless C,et al.Diagnosis of gastrointestinal stromal tumors:A consensus approach[J].Hum Pathol,2002,33(5):459-465.
[3]Wang L,Vargas H,French SW.Cellular origin of gastrointestinal stromal tumors:a study of 27 cases[J].Arch Pathol Lab Med,2000,124(10):1471-1475.
[4]Miettinen M,Majidi M,Lasota J.Pathology and diagnostic criteria of gastrointestinal stromal tumors(GISTs):a review[J].Eur J Cancer,2002,38(Suppl 5):S39-S51.
[5]Rutkowski P,Nowecki ZI,Debiec-Rychter M,et al.Predictive factors for long-term effects of imatinib therapy in patients with inoperable/metastatic CD117(+)gastrointestinal stromal tumors(GISTs)[J].J Cancer Res Clin Oncol,2007,133(9):589-597.
[6]Huang H,Liu YX,Zhan ZL,et al.Different sites and prognoses of gastrointestinal stromal tumors of the stomach:report of 187 cases[J].World J Surg,2010,34(7):1523-1533.
[7]Miettinen M,Lasota J.Histopathology of gastrointestinal stromal tumor[J].J Surg Oncol,2011,104(8):865-873.
[8]Rutkowski P,Bylina E,Wozniak A,et al.Validation of the Joensuu risk criteria for primary resectable gastrointestinal stromal tumour-the impact of tumour rupture on patient outcomes[J].Eur J Surg Oncol,2011,37(10):890-896.
[9]Reichardt P,Reichardt A,Pink D.Molecular targeted therapy of gastrointestinal stromal tumors[J].Curr Cancer Drug Targets,2011,11(6):688-697.

