小檗碱对OA拟AD大鼠额叶皮层的作用
杨吉平 罗秀成 杨石照 赵朝华 徐 曦
(西安医学院解剖学教研室,陕西西安710021)
神 经 原 纤 维 缠 结 (Neurofibrillary tangle,NFTs)是阿尔茨海默病(Alzheimer's disease,AD)患者脑内特征性的神经病理改变之一,可作为大脑早老化的标志,多出现在皮层、海马以及基底前脑的神经元中。目前认为,NFTs的形成与AD患者的认知功能障碍成明显的正相关[1],它的主要成分是过度磷酸化的tau蛋白。小檗碱(Berberine,Ber)又名黄连素,是从毛茛科植物黄连等干燥根茎中提取的一种苯并异喹啉类季铵型生物碱,已被广泛用于治疗胃肠炎、细菌性痢疾等感染性疾病。近年来,有研究表明Ber对Aβ25-35诱导的原代培养的大鼠皮层神经元具有明显的保护作用[2,3];对 H2O2和6-羟基多巴胺损伤的PC12细胞具有明显的抗氧化作用[4,5]。但到目前为止,国内外有关Ber影响AD动物模型或AD患者的相关研究尚少。因此,本研究利用冈田酸(Okadaic acid,OA)侧脑室微量注射建立AD大鼠模型,探讨Ber对其额叶皮层磷酸化tau蛋白表达的影响。
材料和方法
1.材 料
1.1 动物及分组
36只SD大鼠,雌雄各半,3-5月龄,体质量(240±20)g,由第四军医大学实验动物中心提供,许可证号SCXK(军)2002-005,随机分为3组:对照组、模型组和Ber组,每组12只。
1.2 试剂及仪器
OA购自美国Sigma公司;Ber购自中国药品生物制品检验所(批号:1107132200218);磷酸化Tau-Ser396和 Tau-Ser404单克隆抗体购自美国Cell Signaling公司;SABC免疫组化试剂盒购自武汉博士德生物公司。Morris水迷宫视频系统为北京吉安得尔科技公司产品。
2.方 法
2.1 模型建立及给药
将大鼠用10%水合氯醛(3.0ml/kg)腹腔注射麻醉后,固定于脑立体定位仪上,参照Paxinos等[6]的大鼠脑立体定位图谱,于前囟后0.8mm,中线右侧旁开1.3mm处用直径1mm三棱钢针钻穿颅骨,抽得脑脊液后进行侧脑室微量注射,深度3.5mm,模型组大鼠缓慢注射OA(用10%DMSO溶解配制成0.4mmol/L)1.5μl,5min注射完毕,留针10min;隔3d同样剂量再注射1次,共3次。对照组以同样方法注入等体积10%DMSO。术后创面涂抹磺胺粉预防感染。Ber组于AD模型制作后1周开始,每日给予Ber,按100mg/kg灌胃,共4周。对照组、模型组大鼠用同样方法等容积生理盐水灌胃。
2.2 行为学测试
各组大鼠于处死前6d进行Morris水迷宫行为学测试,以判定其学习和记忆的获取能力。第1d将大鼠放入水池(不含平台)自由泳2min,让其熟悉水迷宫环境。之后每天分上、下午2个时间段,每段分别训练4次。训练开始时,将平台置于SW象限,每个时间段分别从池壁4个起始点将大鼠面向池壁放入水池,记录每次找到平台的时间,即逃避潜伏期。如大鼠60s内找不到平台,由实验者将其引上平台,潜伏期为60s,每次间隔4min让大鼠休息,再进行下次实验。
2.3 灌注取材及免疫组化方法
行为学测试结束后,从各组随机取6只大鼠麻醉,开胸,经升主动脉相继灌入生理盐水150ml,4%多聚甲醛-0.1mol/L磷酸缓冲液(pH7.4)250ml,速度先快后慢,持续30min,取脑,石蜡包埋。采用SABC法对各组脑片进行免疫组化染色,切片脱蜡至水后,用3%H2O2灭活内源性过氧化物酶,5%BSA室温孵育封闭25min;滴加pTau-Ser396/404一抗(1∶1 000),4℃过夜;滴加生物素结合的二抗(1∶100),37℃孵育30min;滴加 SABC孵育30min;DAB显色约15min。用PBS代替一抗孵育作为阴性对照。光学显微镜下观察切片,以胞浆中出现棕黄色颗粒为阳性表达。采用随机方法,每组每种抗体分别取10张切片,在40倍物镜下,取同一部位采集图像,背景及曝光时间等条件均设一致,然后用图像分析软件进行分析,测定其OD值作为定量指标。
2.4 Western blot方法
将各组其余大鼠颈椎脱臼处死,剥离额叶皮层组织,剪碎,加入10倍于其体积预冷的脑组织裂解液,静置30min后,匀浆离心(4℃,13 000r/min,30min),取上清液,用Bradford法测定蛋白浓度。等量上样后进行SDS-PAGE电泳,半干转印到PVDF膜上,用5%脱脂奶粉室温封闭2h;分别加入稀释的pTau-Ser396/404一抗(1∶1 000),4℃孵育过夜,二抗37℃孵育2h;ECL化学发光显色。以βactin作为内参照。
2.5 统计学处理
各组数据以均值±标准差(¯x±s)表示,用SPSS 11.5软件单因素方差分析进行组间比较。
结 果
1.行 为学测试结果
在Morris水迷宫测试中,各组大鼠平均逃避潜伏期日渐缩短。与对照组相比,AD模型组平均逃避潜伏期均明显延长(P<0.01,P<0.05)。Ber组与模型组比较,平均逃避潜伏期在第2d直到第6d均明显缩短(P<0.01,P<0.05,Tab.1)。
2.各 组大鼠额叶皮层pTau-Ser396/404的表达
2.1 免疫组化结果
大鼠额叶皮层pTau-Ser396/404免疫反应阳性产物呈棕黄色细颗粒状,高倍镜下可见阳性产物主要定位于神经元胞浆和轴丘部位,胞核淡染。对照组可见少量的pTau-Ser396(Fig.1A)和pTau-Ser404(Fig.1D)阳性神经元,阳性产物着色较淡;模型组额叶皮层的阳性产物着色加深,其OD值均较对照组明显增加(Fig.1B,E;Tab.2)。而Ber组额叶皮层神经元内pTau-Ser396(Fig.1C)和 pTau-Ser404(Fig.1F)的表达量较模型组明显降低(P<0.05,P<0.01)。
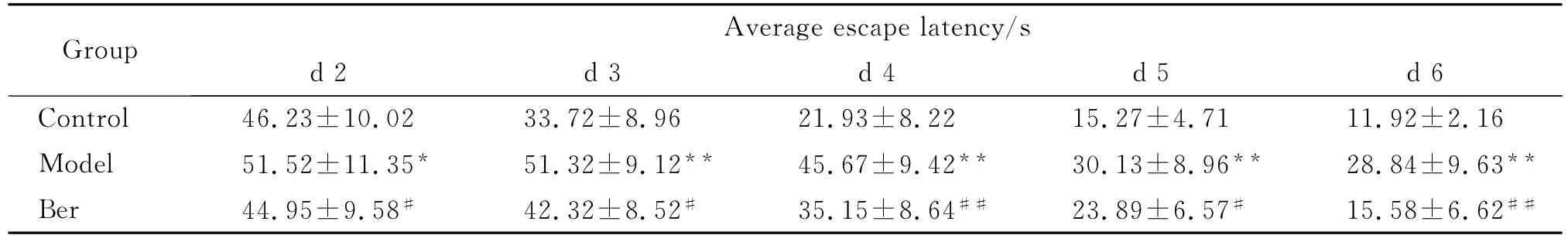
表1 各组大鼠平均逃避潜伏期的比较(¯x±s,n=12)Table 1 Average escape latency in each group(¯x±s,n=12)
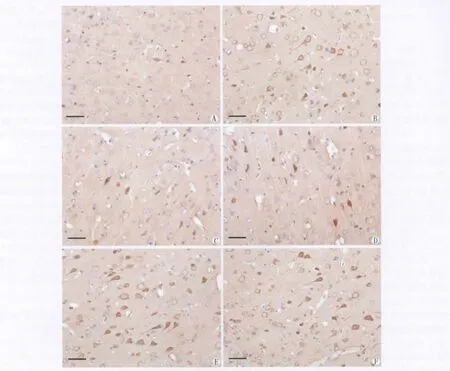
图1 各组大鼠额叶皮层pTau-Ser396(A-C)and pTau-Ser404(D-F)的表达。免疫组化染色。A,D 对照组;B,E 模型组;C,F Ber组。标尺=50μm.Fig.1Immunohistochemical staining showing the expression of pTau-Ser396(A-C)and pTau-Ser404(D-F)in the frontal cortex in control group(A,D),model group(B,E)and Ber group(C,F).Bar=50μm.

表2 各组大鼠额叶皮层pTau-Ser 396和pTau-Ser 404的表达(¯x±s,n=6)Table 2 Expression of pTau-Ser396and pTau-Ser404in frontal cortexin each group(¯x±s,n=6)
2.2 Western blot结果
各组大鼠额叶皮层神经元pTau-Ser396/404免疫印迹结果见Fig.2,灰度值半定量分析可见,AD模型组额叶皮层pTau-Ser396/404的表达较对照组明显升高(P<0.01);Ber组额叶皮层pTau-Ser396/404的表达较模型组明显降低(P<0.05,P<0.01)。
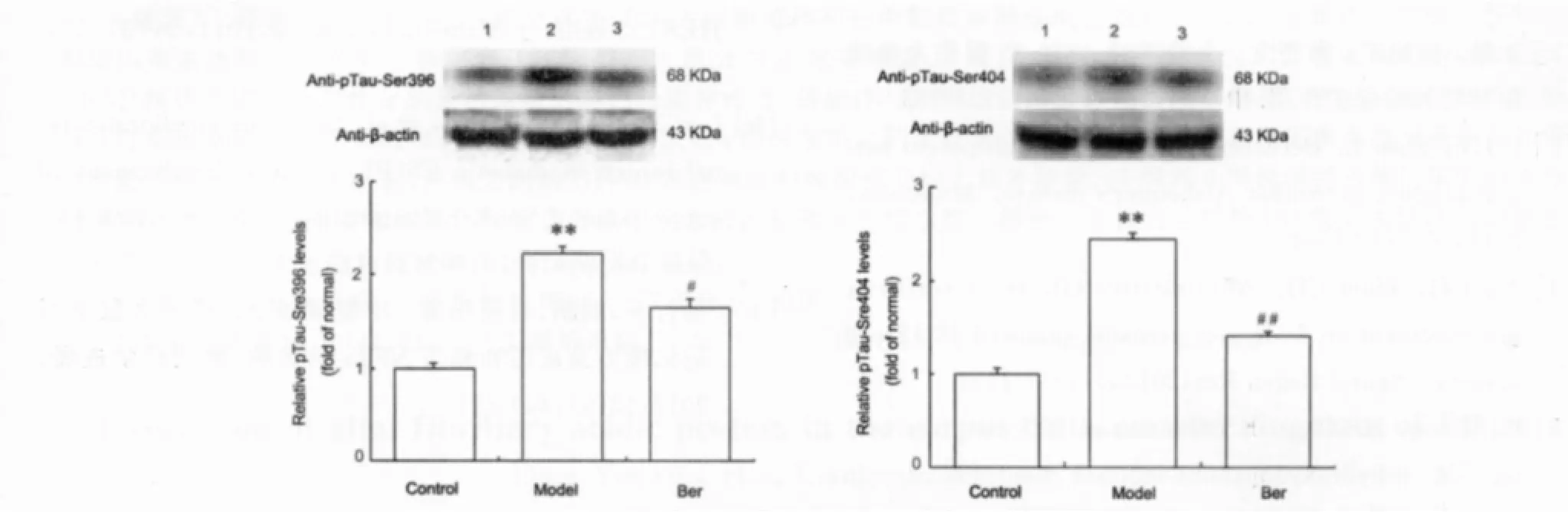
图2 各组大鼠额叶皮层pTau-Ser 396和pTau-Ser 404的表达(¯x±s,n=6)。免疫印迹法。1对照组;2模型组;3Ber组。Fig.2Expression of pTau-Ser396and pTau-Ser404was determined by western blotting in frontal cortex in the each group(¯x±s,n=6),1.Control;2.Model;3.Ber.
讨 论
正常的tau蛋白是一种亲水性、可溶性、非折叠的微管相关蛋白,主要分布于成熟神经元的轴突,具有稳定神经元微管的作用,在维持神经元生长、保持神经元极性及胞内物质转运等方面发挥重要作用。而过度磷酸化的tau蛋白则是不溶解的,扭曲变形的微管蛋白不能正常输送营养物质,导致神经元末端的树突和轴突发生营养不良性萎缩。受累神经元内蛋白激酶/蛋白磷酸酯酶动态平衡失调是导致AD样tau异常过度磷酸化的主要生化机制。蛋白磷酸酯酶2A(PP-2A)是主要的tau蛋白磷酸酯酶,OA是丝氨酸/苏氨酸蛋白磷酸酯酶PP-2A与PP-1的特异性抑制剂。本研究采用侧脑室多次微量注射OA,通过抑制PP-2A和PP-1的活性使激酶处于相对高活性状态,从而能使tau蛋白过度磷酸化并形成NFTs样改变。AD患者脑内磷酸化的tau是正常老年人的4-5倍,tau的磷酸化位点很多,其中Ser396/404、Ser198/199/202等都是在 AD 中常见的被磷酸化位点[7],在该实验中我们选取了Ser396/404位点作为磷酸化tau蛋白检测指标。免疫组化和 Western blot结果表明,模型组pTau-Ser396和pTau-Ser404蛋白表达较对照组明显增高。Morris水迷宫测试表明AD模型组平均逃避潜伏期均明显延长,这说明用OA侧脑室注射制作的AD模型已经造成了大鼠空间记忆和学习能力障碍,可以作为探讨AD治疗药物的理想模型。
Ber(C20H17ONO5)是一种毒副作用小、具有广泛用途的生物碱。有研究表明,Ber对H2O2、6-羟基多巴胺及Aβ诱导的细胞损伤均具有明显的保护作用[2-5];能减少花萼海绵体诱癌素 A(calyculin-A)诱导的HEK293细胞tau蛋白磷酸化[8]。最近有报道,Ber可通过改变糖原合成酶-3β(GSK-3β)的活性来控制糖尿病小鼠的血糖水平[9],而 GSK-3β是AD发病过程中起重要作用的一种蛋白激酶。但是,Ber对蛋白磷酸酯酶表达的影响尚未见文献报道。该研究用Ber作用于OA致AD模型大鼠,结果发现,Ber组大鼠额叶皮层内pTau-Ser396和pTau-Ser404蛋白表达较模型组明显下调,Morris水迷宫实验也检测到Ber可以显著提高受损大鼠的学习记忆能力。我们前期的研究已经证实了Ber能够使AD模型大鼠皮层和海马NFTs样改变的数量明显减少[10]。由此我们推测,Ber可能是通过激活蛋白磷酸酯酶(如PP-2A),从而对抗了OA对神经元的毒性作用,使蛋白磷酸激酶/磷酸酯酶比例又回归平衡,tau蛋白的磷酸化水平趋于正常,才使大鼠的学习记忆能力得以改善。
[1]Yasuhito W,Takeshi K,Mitsunori W,et al.Factors responsible for neurofibrillary tangles and neuronal cell losses in tauopathy.J Neurosci Res,2011,89(4):576-584
[2]王静,张艳军,常亮堂.小檗碱对Aβ25-35损伤大鼠皮层神经元的保护作用.中草药,2011,42(4):728-733
[3]Ji HF,Shen L.Berberine:A potential multipotent natural product to combat Alzheimer's disease.Molecules,2011,16:6732-6740
[4]Xu DH,Zhou CH.Antioxidative effects of berberine pre-treatment on hydrogen peroxide-induced PC12cell toxicity.Neural Regen Res,2010,5:1391-1395
[5]IH Kwon,HS Choi,KS Shin,et al.Effects of berberine on 6-hydroxydopamine-induced neurotoxicity in PC12cells and a rat model of Parkinson's disease.Neurosci Lett,2010,486:29-33
[6]Paxinos G,Watson C.The rat brain in stereotaxic coordinates.Academic press INC,2004:42-63
[7]沈建英,徐桂香,左斌等.冈田酸所致微管相关蛋白tau Ser396位点过度磷酸化抑制细胞凋亡.华中科技大学学报(医学版),2009,38(3):281-284
[8]Yu G,Li Y,Tian Q.Berberine attenuates calyculin A-induced cytotoxicity and tau hyperphosphorylation in HEK293cells.J Alzheimer's disease,2011,24(3):525-535
[9]Lan T,Shen X,Liu P,et al.Berberine ameliorates renal injury in diabetic C57BL/6mice:Involvement of suppression of SphK-S1Psignaling pathway.Arch Biochem Biophys,2010,502(2):112-120
[10]杨吉平,刘鹏,赵朝华等.小檗碱对AD模型大鼠学习记忆能力及皮层和海马NFTs的影响.解剖科学进展,2012,18(5):449-451

