无血清培养上调N2a细胞钙反应性反式激活因子的表达
王巧真 金真真 彭 挺 管英俊 李 和,*
(1潍坊医学院组织学与胚胎学教研室,山东261042;2华中科技大学同济医学院组织学与胚胎学教研室,武汉430030)
Aizawa于2004年在鉴定皮质神经元内钙离子调控的转录因子时用反式激活因子陷阱(transactivator trap)方法鉴定出一种具有钙离子依赖性反式激活作用的蛋白质,称为钙反应性反式激活因子(calcium-responsive transactivator, CREST)[1]。CREST是一种反式转录共激活因子SYT[2]相关蛋白,在人、大鼠、小鼠间高度同源[1,2],在脑内呈较高水平表达,主要定位于神经元核内[1]。脑内CREST的表达与神经元的发育密切相关[1],基因敲除实验证明,CREST在神经元树突的生长和分支发育中具有重要作用[1,3]。CREST 与神经元发育的关系和在神经元树突生长中的作用提示,CREST与神经元的分化有关,但目前未见CREST与神经元分化关系的报道。为了深入探讨CREST在神经元分化中的作用,本研究利用在促分化因素作用下具有分化为神经元能力的小鼠成神经瘤 (N2a)细胞[4],检测了促分化因素无血清培养[5]对 N2a细胞CREST表达的影响。
材料和方法
N2a细胞(华中科技大学同济医学院病理生理系王建枝教授惠赠);兔抗CREST(武汉三鹰生物技术有限公司),小鼠抗微管蛋白γ(γ-tubulin)、Hoechst33258、蛋白酶抑制剂(Sigma-Aldrich),辣根过氧化物酶(HRP)耦联的驴抗兔IgG、HRP耦联的驴抗小鼠IgG和Cy3标记的驴抗兔IgG(Jackson ImmunoResearch Laboratories),增强型化学发光试 剂 (enhancedchemiluminescence,ECL)、OPTIMEM 和DMEM、胎牛血清 (FBS)(Invitrogen)。
2.细 胞培养
将N2a细胞接种到6孔细胞培养板或放有盖玻片的6孔细胞培养板内,用DMEM和OPTIMEM 1:1混合的培养基(含5%FBS、100U/ml青霉素G、100μg/ml链霉素)于37℃、5%CO2培养箱内培养12~24h后,将细胞分为对照组和分化诱导组。对照组继续在含5%FBS的培养基中培养,分化诱导组用不含FBS的培养基培养。两组细胞分别继续培养12h、24h和48h。
3.蛋 白免疫印迹分析
培养相应时间后,收集细胞,冰上用细胞裂解液(50mmol/L Tris-HCL,pH 7.4,150mmol/L NaCL,1%Triton ×-100,1mmol/L EDTA,1 mmol/L PMSF,1∶1000蛋白酶抑制剂混合物)裂解30min,4℃离心(12000rpm/min)5min,取上清用BCA法检测蛋白浓度,并调蛋白浓度至2μg/μl。于蛋白样品中加入5×上样缓冲液后,取40μg蛋白用12%SDS-PAGE进行电泳,恒压将蛋白转至醋酸纤维膜。室温下,醋酸纤维膜于含5%脱脂奶粉的0.01mol/L磷酸盐缓冲液(PBS,pH7.4)中封闭抗原1~2h,含5%脱脂奶粉PBS稀释的第一抗体(兔抗CREST,1∶1000)4℃孵育过夜,含5%脱脂奶粉PBS稀释的第二抗体(HRP耦联的驴抗兔IgG,1∶10000)室温孵育2h,增强型化学发光试剂(ECL)反应5min;全自动化学发光成像系统Bio-Rad XRS+(Bio-Rad)曝光。接着以同样方法用小鼠抗γ-tubulin(1∶10000)和 HRP耦联的驴抗小鼠IgG (1∶10000)对γ-tubulin进行检测。
4.C REST的免疫荧光染色
细胞在放有盖玻片的6孔细胞培养板内培养相应时间后,冷PBS漂洗,0.1mol/L配制的4%多聚甲醛固定10min,含3%Triton×-100的PBS孵育10min,含1%正常驴血清的PBS封闭30min,兔抗CREST 抗体(1:100)4℃孵育过夜,用0.01 mol/L的PBS漂洗3×5min;Cy3标记的驴抗兔IgG (1:500)37℃避光孵育2h,10μg/ml的 Hoechst33258,37℃避光孵育30min,取出盖玻片,以荧光封片剂封片后激光扫描共聚焦显微镜(Olympus FV1000)观察、照像。
5.R T-PCR
培养相应时间后,收集细胞,用Trizol一步法常规提取总RNA,用紫外分光度计检测RNA浓度,取2μg总RNA在25μl反应体系中进行逆转录反应,然后取逆转录反应产物进行PCR扩增,以β-actin为内参对照。CREST引物序列:上游5'-AGATCGGTAACGGTCCAAACCACG-3',下 游5'-GCATGTTGATGTTGGTCCGAGACAC-3';βactin引物序 列:上游 5'-TTTCCAGCCTTCCTTCTTGGGTATG-3',下游5'-ATAGAGGTCTTTACGGATGTCAACG-3'。PCR 反应条件:预变性(94℃,30min),变性(94℃,30sec),退火(55℃,30sec),延伸(72℃,30sec),循环30次。反应结束后取PCR产物10μl在2%琼脂糖凝胶中120V电泳30min,紫外线下凝胶成像系统(JS-380自动凝胶图像分析仪)观察、照像。
6.统 计学分析
采用IPP5.1图象分析软件对RT-PCR和免疫印迹显示的条带进行光密度测定,以CREST条带和内参条带的光密度比值代表其相对水平。各种数据均来自至少3次独立实验,用平均数±标准差(¯x±s)表示,单因素方差分析,用SPSS12.0统计分析软件对数据进行显著性检验。
结 果
1.无 血清培养上调N2a细胞内CREST蛋白水平
免疫印迹检测显示(图1),对照组N2a细胞CREST蛋白水平在各时间点无明显变化;分化诱导组N2a细胞中CREST蛋白水平在无血清培养12h时无明显变化,在24h时明显升高,48h时升高更明显。免疫荧光检测显示(图2),CREST免疫反应产物主要定位于细胞核内;无血清培养12h后,CREST免疫反应产物水平无明显变化;无血清培养24h和48h后,CREST免疫反应产物水平均明显升高,变化趋势与免疫印迹检测结果相似。
2.无 血清培养上调N2a细胞内CREST mRNA水平
RT-PCR检测显示(图3),对照组 N2a细胞CREST mRNA水平在继续培养12h和24h后无明显变化,但在培养48h后略有升高,而分化诱导组细胞的CREST mRNA水平在无血清培养12h后即已升高,24h和48h后升高更为明显;在48h时间点,无血清培养的N2a细胞CREST mRNA水平明显高于用含FBS培养基培养的N2a细胞。
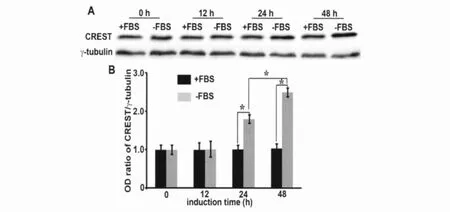
图1 无血清培养对N2a细胞CREST蛋白水平的影响。A,无血清培养对N2a细胞CREST蛋白水平影响的免疫印迹检测;+FBS,含FBS培养基培养的对照组细胞;-FBS,无FBS培养基培养的分化诱导组细胞。B,无血清培养不同时间对N2a细胞CREST蛋白水平影响免疫印迹检测的统计学分析;*P<0.01(n=3)。Fig.1The effect of serum-free culturing on protein level of CREST in N2acells.A,Western blotting detection for the effect of serum-free culturing on protein level of CREST in N2acells;+FBS,control cells cultured in medium containing FBS;-FBS,differentiation induction cells cultured in medium without FBS.B,statistical analysis of the effect of serum-free culturing on protein level of CREST in N2acells detected by western blotting;*P<0.01(n=3).
讨 论
对不同发育阶段小鼠脑内CREST蛋白和mRNA表达水平的检测显示,CREST高表达于正在分化和分裂后神经元内,而在胚胎晚期脑室带具有增殖能力的成神经细胞内和成年大鼠脑内无表达或低水平表达[1],提示CREST与神经元分化有关。CREST基因敲除小鼠出生后虽然可以存活,但其大脑体积较野生型小鼠显著缩小,皮质神经元和海马神经元树突生长发育异常,树突平均长度及分支都显著降低;在野生型小鼠原代培养神经元,去极化可诱导树突长度增长和分支增加,而在CREST敲除小鼠原代培养神经元,去极化不能诱导树突长度增长和分支增加,表明CREST为钙诱导的树突生长所必需[1]。在过表达缺乏核定位结构域的CREST的神经元中,由于核内CREST同源二聚体减少,去极化诱导的树突生长因此也被抑制[3]。因此,CREST在神经元树突的生长和分支发育中具有重要作用。
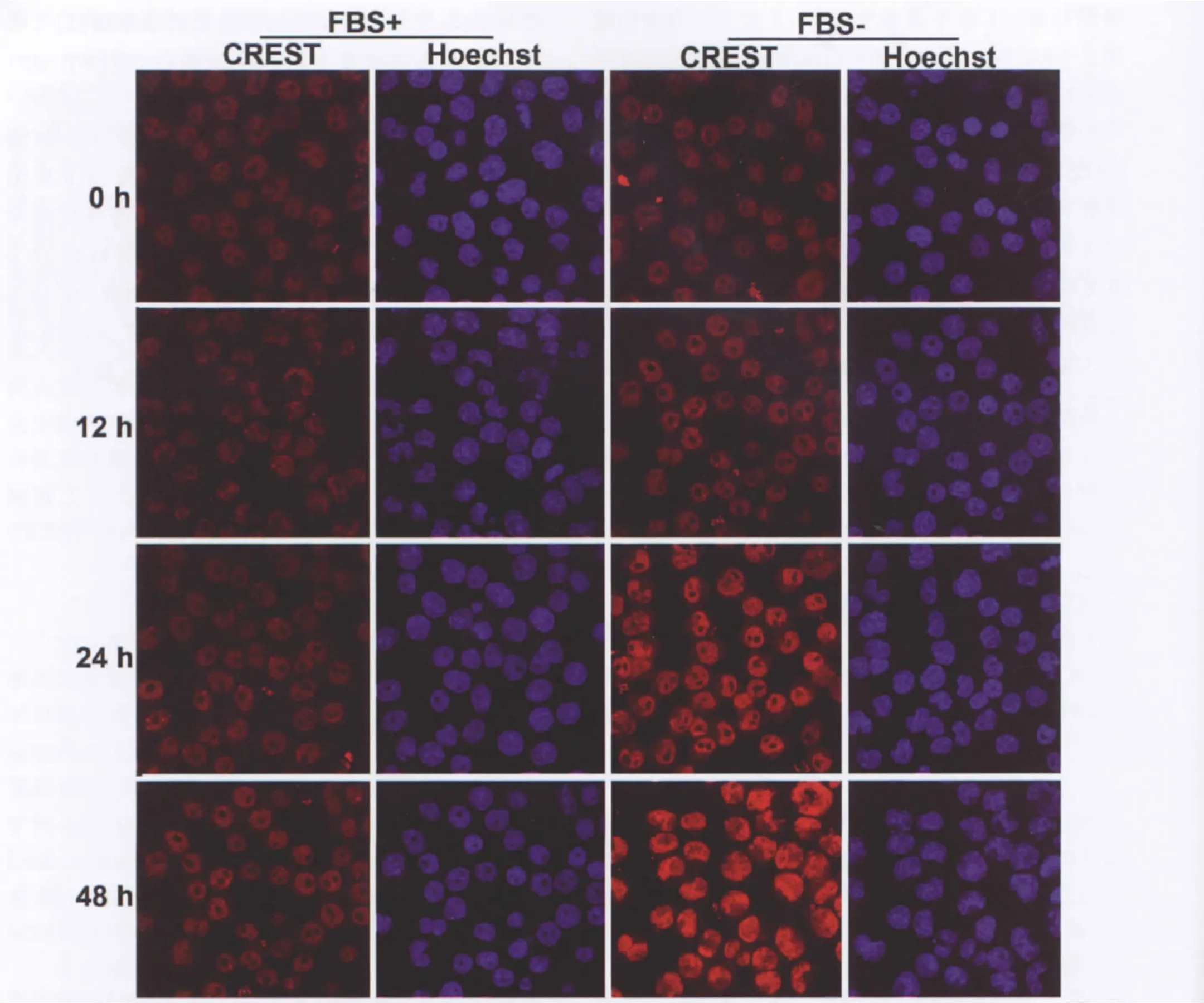
图2 无血清培养对N2a细胞CREST蛋白水平影响的免疫荧光检测。CREST,不同时间点(0h、12h、24h和48h)对照组(+FBS)或分化诱导组(-FBS)细胞CREST的免疫荧光染色 (×600)。Hoechst,对照组或分化诱导组相应时间点同一视野细胞核DNA的Hoechst33342染色。Fig.2Immunofluorescent detection for the effect of serum-free culturing on protein level of CREST in N2acells.CREST,CREST immunofluorescent staining of control(+FBS)cells or differentiation induction (-FBS)cells at different time points(×600).Hoechst,Hoechst33342staining of nuclear DNA in control cells or differentiation induction cells of the same fields as CREST immunofluorescent staining at the corresponding time points.
为了揭示CREST与神经元分化的关系,本研究观察了用无血清培养的N2a细胞后其CREST蛋白和mRNA水平的变化,结果显示,用不含FBS的培养基培养的N2a细胞,其CREST蛋白和mRNA水平呈培养时间依赖性增高。在用含FBS培养基培养较长时间(48h)的N2a细胞中,虽然CREST蛋白水平无明显上调,但CREST mRNA水平较用含FBS培养基培养较短时间(0-24h)的细胞明显上调。此时的CREST mRNA表达水平上调可能是随着培养时间的延长,培养基中FBS含量因消耗而相对缺乏,使N2a细胞呈一定程度分化的反映。因此,N2a细胞在促分化因素作用时其CREST的表达明显上调。
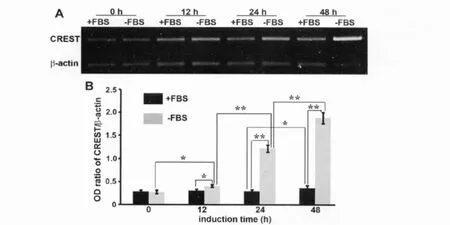
图3 无血清培养对N2a细胞CREST mRNA水平的影响。A,无血清培养对N2a细胞CREST mRNA水平影响的RTPCR检测。B,无血清培养不同时间对N2a细胞CREST mRNA水平影响RT-PCR检测的统计学分析;*0.01<P<0.05(n=3);**P<0.01(n=3)。Fig.3The effect of serum-free culturing on mRNA level of CREST in N2acells.A,RT-PCR detection for the effect of serum-free culturing on mRNA level of CREST in N2acells.B,statistical analysis of the effect of serum-free culturing on mRNA level of CREST in N2acells detected by RT-PCR;*0.01<P<0.01,compared with control cells(n=3);**P<0.01.
CREST的羧基末端含有核定位信号,其中最后9个氨基酸含有组蛋白乙酰化酶CBP、P300结合位点[1,3,6]。CBP、p300以及 p300-CBP 转录共激活因子(p300-CBP-associated factor,PCAF)等可通过促进p53乙酰化而使p53变得稳定和活化[7-11]。活化的p53能活化周期蛋白依赖性激酶(cyclin-dependent kinases,CDKs)抑制剂p21[12,13],p21通过与CDK4-周期蛋白D1和CDK2-周期蛋白E1等复合物结合抑制其活性并由此抑制视网膜母细胞瘤蛋白(retinoblastoma protein,Rb)的磷酸化[13-15],进而抑制周期蛋白的表达,导致细胞周期阻滞,诱导细胞分化[16-19]。因此,无血清或低血清培养的 N2a细胞上调的CREST可能通过募集更多的CBP、p300及PCAF而活化N2a细胞内的p53,活化的p53通过其下游信号通路抑制细胞周期,促进其分化。
[1]Aizawa H,Hu SC,Bobb K,et al.Dendrite development regulated by CREST,a calcium-regulated transcriptional activator.Science,2004,303(5655):197-202
[2]Ladanyi M.Fusions of the SYT and SSX genes in syno-vial sarcoma.Oncogene,2001,20(40):5755-5762
[3]Pradhan A,Liu Y.A multifunctional domain of the calcium-responsive transactivator (CREST)that inhibits dendritic growth in cultured neurons.J Biol Chem.2005,280(26):24738-24743
[4]Wu G,Fang Y,Lu ZH.et al.Induction of axon-like and dendrite-like processes in neuroblastoma cells.J Neurocytol,1998,27(1):1-14
[5]Valero T,Moschopoulou G,Kintzios S,et al.Studies on neuronal differentiation and signalling processes with a novel impedimetric biosensor.Biosens Bioelectron,2010,26(4):1407-1413
[6]Qiu Z,Ghosh A.A calcium-dependent switch in a CREST-BRG1complex regulates activity-dependent gene expression.Neuron,2008,60(5):775-787
[7]Grossman S R.p300/CBP/p53interaction and regulation of the p53response.Eur J Biochem,2001,268(10):2773-2778
[8]Grönroos E,Terentiev AA,Punga T,et al.YY1inhibits the activation of the p53tumor suppressor in response to genotoxic stress.Proc Natl Acad Sci USA,2004,101(33):12165-12170
[9]Roy S,Tenniswood M,Site-specific acetylation of p53 directs selective transcription complex assembly.J Biol Chem,2007,282(7):4765-4771
[10]Knights C D,Catania J,Di Giovanni S,et al.Distinct p53acetylation cassettes differentially i nfluence geneexpression patterns and cell fate.J Cell Biol,2006,173(4):533-544
[11]Wang H,Zhao Y,Li L.An ATM-and Rad-related(ATR)signaling pathway and a phosphorylation-acetylation cascade are in-volved in activation of p53/p21Waf1/Cip1in response to 5-aza-2'-deoxycytidine treatment.J Biol Chem,2008,283(5):2564-2574
[12]Weiss RH,Randour CJ.The permissive effect of p21(Waf1/Cip1)on DNA synthesis is dependent on cell type:effect is absent in p53-inactive cells.Cell Signal,2000,12(6):413-418
[13]Zhao Y,Lu S,Wu L.Acetylation of p53at lysine 373/382by the histone deacetylase inhibitor depsipeptide induces expression of p21(Waf1/Cip1).Mol Cell Biol,2006,26(7):2782-2790
[14]Ling Y,Chen Y,Chen P,et al.Baicalein potently suppresses angiogenesis induced by vascular endothelial growth factor through the p53/Rb signaling pathway leading to G1/S cell cycle arrest.Exp Biol Med(Maywood),2011,236(7):851-859
[15]Dimco G,Knight RA,Latchman DS,et al.STAT1interacts directly with cyclin D1/Cdk4and mediates cell cycle arrest.Cell Cycle,2010,9(23):4638-4649
[16]Shi H,Chen S,Jin H,et al.Downregulation of MSP58inhibits growth of human colorectal cancer cells via regulation of the cyclin D1-cyclin-dependent kinase 4-p21pathway.Cancer Sci,2009,100(9):1585-1590
[17]Liu J,Wang Y,Cui J,et al.Ochratoxin A induces oxidative DNA damage and G1phase arrest in human peripheral blood mononuclear cells in vitro.Toxicol Lett,2012,211(2):164-171
[18]Zhang L,Mori J,Wagg C,et al.Activating cardiac E2F1induces up-regulation of pyruvate dehydrogenase kinase 4in mice on a short term of high fat feeding.FEBS Lett,2012,586(7):996-1003
[19]Lim S,Kaldis P.Loss of Cdk2and Cdk4induces a switch from proliferation to differentiation in neural stem cells.Stem Cells,2012,30(70):1002-1114

