圆叶无心菜的组织培养技术研究
方其仙,祖艳群,李 元
(1.云南农业职业技术学院,云南 昆明 650031;2.云南农业大学资源与环境学院,云南 昆明 650201)
圆叶无心菜(Arenaria rotumdifolia Bieberstein)为石竹科(Caryophyllaceae)石竹目植物,分布较广,在海拔2 300~3 600 m的地区,如云南会泽、大理、洱源、镇康、丽江、维西、德钦等地都有生长。圆叶无心菜茎侧被短柔毛,其叶圆形或卵圆形;花瓣短于萼片,一年生或多年生野生植物,叶对生,花白色,排成顶生的聚伞花序;萼片5;花瓣5;常全缘,很少缺;蒴果卵球形或长圆形。
在云南会泽铅锌矿区,圆叶无心菜能顽强生长,经研究发现是Pb的一种超累积植物。但至还未见今国内外报道圆叶无心菜的人工繁育和栽培技术,且很难采到其种子。因此,通过组织培养技术,对圆叶无心菜的无性系进行研究,以期解决矿区植物所需大量种苗供应问题。
1 材料与方法
1.1 试验材料
以野生植物圆叶无心菜的顶芽和嫩茎为外植体。基本培养基选用MS,根据培养要求,添加不同浓度的细胞分裂素(6-BA)、生长素(NAA)。培养基pH值为5.8,蔗糖3%,琼脂为7 g/L,诱导生根的培养基用MS,蔗糖2%,微量元素适当降低。培养基在高压灭菌锅中 0.1×1012~0.101×1012Pa 气压下保持20 min灭菌。
1.2 试验方法
1.2.1 愈伤诱导 将小苗在自来水下冲洗10~20 min后,在接种室用70%的酒精浸泡消毒30 s,用10%NaClO消毒8~10 min,再用无菌水反复冲洗3次,在无菌条件下切取0.4~0.6 cm的顶芽和嫩茎,接种到诱导愈伤组织的培养基中。培养温度(25±2)℃,光照强度 1 600~2 400 lx,光照时间 12 d。培养30 d后,观察其愈伤组织的形成情况。
1.2.2 不定芽分化 将形成的愈伤组织接种到添加不同浓度的6-BA、NAA的MS培养基上,进行芽分化培养,30 d后观察统计不定苗长出的叶片数量、茎高、茎粗,观察其长势。
1.2.3 不定芽生根 将分化培养基中生长良好的不定苗,接种到MS或1/2 MS附加不同浓度6-BA、NAA的生根培养基中培养30 d时统计。
1.2.4 炼苗与移栽 试验在组培苗出瓶前2 d把瓶盖打开,其中20%完全去掉瓶盖,其余保持瓶盖半遮瓶口,2 d后将组培苗从瓶口取出,用清水洗净根部所沾的培养基,再用1‰KMnO4溶液浸泡30 s(防止根系腐烂),滤干后移栽到经高温灭菌的基质(珍珠岩∶沙土=1∶2)中,然后置于温室中 15 d,统计移栽成活率。
2 结果与分析
2.1 圆叶无心菜愈伤组织的诱导
由表1可见,不同浓度的生长素对圆叶无心菜愈伤组织的诱导具有不同的影响。添加0.2 mg/L 6-BA、0.02 mg/L NAA时,愈伤组织形成率达85%。该培养基诱导出的愈伤组织颜色嫩绿,外形光滑、较软,呈颗粒状,这样的愈伤组织具有分化能力。这表明MS+6-BA 0.2 mg/L+NAA 0.02 mg/L是诱导圆叶无心菜形成具有分化能力的愈伤组织较理想的培养基配方。
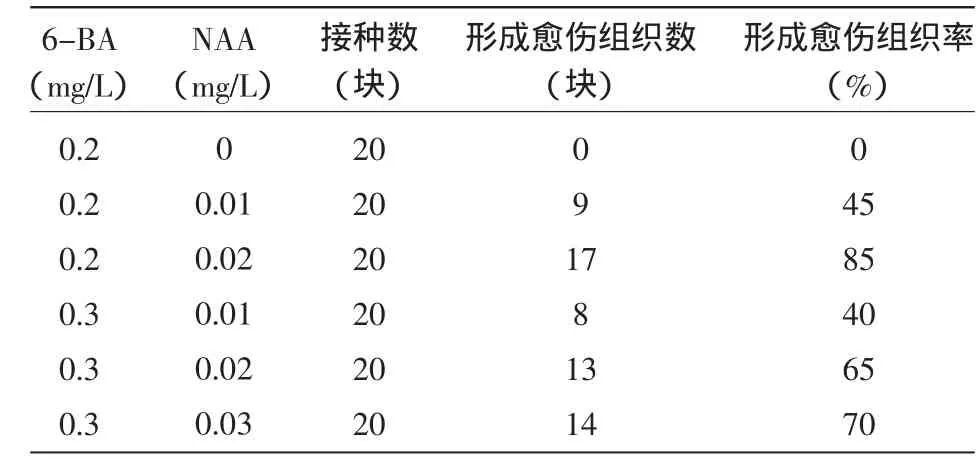
表1 不同浓度的生长素对圆叶无心菜愈伤组织的诱导影响
2.2 不同浓度激素对愈伤组织分化的影响
从表2中可以看出,这几种培养基都可以诱导分化出不定芽,但分化率不一样,在MS+6-BA 1.0 mg/L+NAA 0.1 mg/L培养基上,整个愈伤组织块上都布满了分化芽,平均每块愈伤组织可分化出9.90个不定芽,而且分化苗的长势也较好。因此,该培养基是诱导圆叶无心菜愈伤组织芽分化的理想培养基。
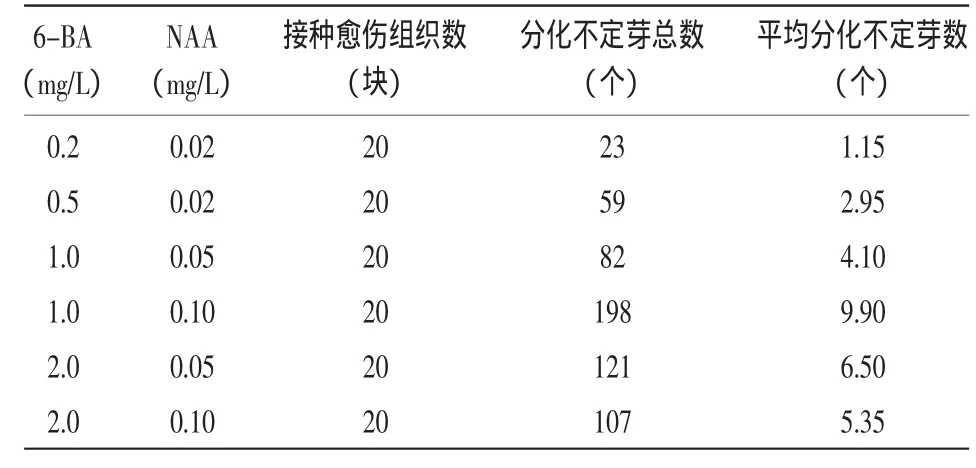
表2 不同浓度生长素对不定芽分化的影响
2.3 不同浓度激素对分化芽生长的影响
虽然愈伤组织在这几种培养基中都能诱导出分化芽,且数量也较多,但分化芽的长势不一样,30 d时观察结果见表3。由表3可见,几种培养基中,不定芽在MS+6-BA 1.0 mg/L+NAA 0.1 mg/L培养基中长势最好。因此,MS+6-BA 1.0 mg/L+NAA 0.1 mg/L是圆叶无心菜不定芽生长的理想培养基。
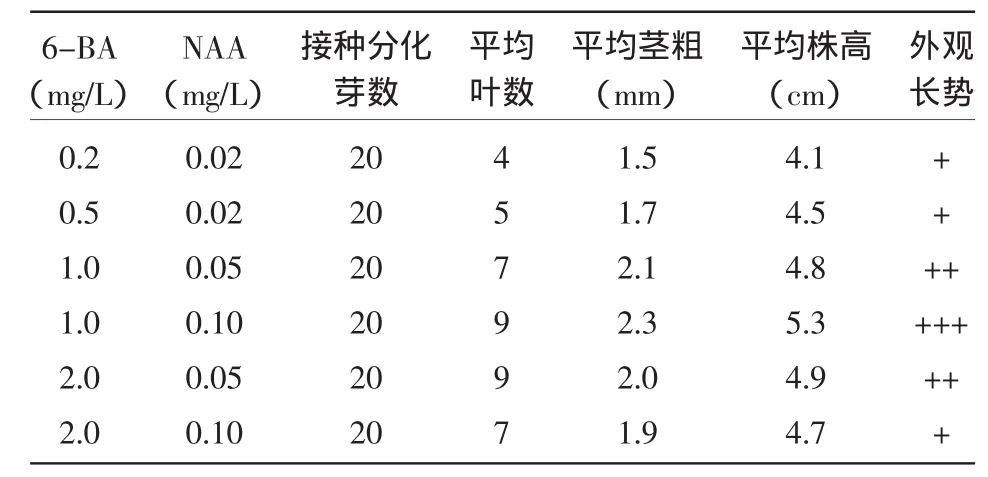
表3 不同浓度激素对分化芽生长的影响
2.4 不同浓度生长素对组培苗不定根生长的影响
由表4可见,组培苗在MS+6-BA 0.1 mg/L+NAA 0.5 mg/L培养基中生根率达11.70/株,接种一个星期后即可形成可见根,并且根系生长速度快,长势好。
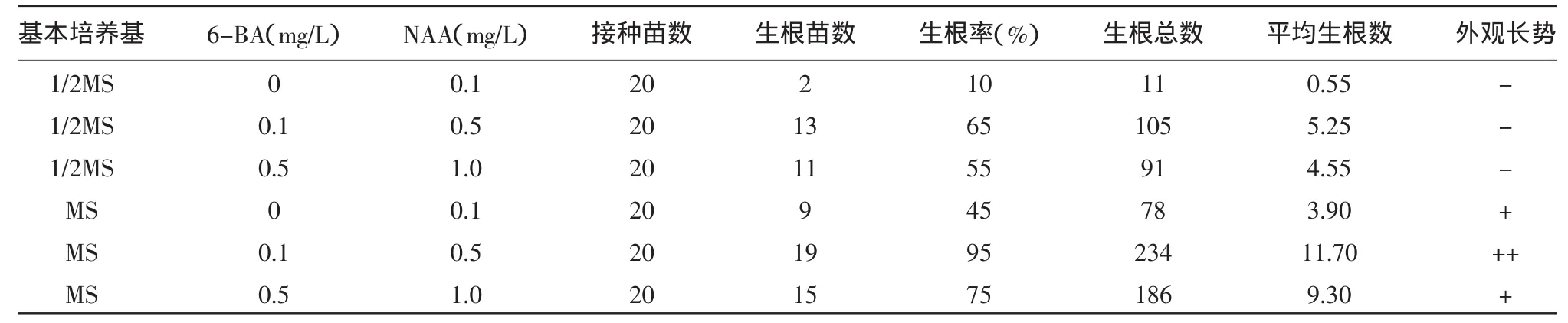
表4 不同浓度生长素对组培苗不定根生长的影响
2.5 炼苗及移栽
20%小苗完全去掉瓶盖,1 d内即萎蔫,其余小苗炼苗2 d后经清洁处理,栽到经高温灭菌的基质,温室中栽培15 d,成活率也很低,只有10%。
3 讨论
3.1 外植体的消毒
试验得知,最适合圆叶无心菜的消毒方法是:自来水冲洗干净,70%酒精浸泡30 s,10%NaClO消毒8~10 min,再用无菌水冲洗3次,如果浸泡时间不够,内部病毒难以灭净,会在1~2个星期以后出现污染,如果浸泡时间过长,则会引起外植体失绿而死亡。
3.2 污染苗的消毒再利用
试验过程中发现,长出丛生芽后,培养基出现污染迹象,并逐渐向上蔓延;还有一种现象:一瓶内多个外植体,只一个污染。暂把这些情况下培养瓶内还未被污染的外植体或小苗统称为准污染苗。试验表明:不经消毒,直接在无菌条件下转接准污染苗仍继续污染;若把准污染苗用酒精浸泡15 s,然后用无菌水冲洗干净,再转接可以正常生长。
3.3 炼苗及移栽
组培苗出瓶后,为适应外部环境,有一个炼苗的过渡阶段。从炼苗到移栽这一阶段,成活率很低,其原因可能是:①丛生芽转接直接诱导生根,小苗太弱,出瓶后适应力差;②有的组培苗根部移栽时带有愈伤组织,影响小苗生长;③出瓶操作不细致,若在生根液中浸泡1 min,再移栽,可提高成活率;④置于温室后可能温湿度控制不够、波动过大、管理不善所致。
4 小结
(1)以顶芽和带节的嫩茎为外植体,在MS+6-BA 0.2 mg/L+NAA 0.02 mg/L能较好的诱导出愈伤组织。
(2)培养基MS+6-BA 1.0 mg/L+NAA 0.1 mg/L芽的分化有较好的效果,平均每块愈伤组织可分化出9.90个不定芽,且分化苗的长势也较好。
(3)在培养基MS+6-BA 0.1 mg/L+NAA 0.5 mg/L中生根效果较好,生根率达11.7/株,接种一个星期后即可形成可见根,并且根系生长速度快,长势好。
[1]夏海武,万永霞,赵月玲.香石竹的脱毒快繁研究[J].昌潍师专学报,1999,18(5):16-18.
[2]王淑芬,衣彩洁.霞草的组织培养[J].北京工业大学学报,1999,25(1):68-71,81.
[3]宁淑香,张明宇,张洪英,等,羽衣甘蓝无性系的建立[J].辽宁大学学报,2002,29(4):375-381.
[4]周 音,张智奇,王少鸥,等,十字花科植物转基因技术研究进展及存在问题[J].吉林农业大学学报,1996,18(1):96-102.
[5]安利佳,姜长阳,植物组织培养导论[M].大连:辽宁师范大学出版社,1996.68-72.
[6]周国英,刘君昂,周德明.山嵛菜组织培养的研究[J].中南林学院学报,2002,20(1):65-67.
[7]邢 震,潘锦旭,郑维列,等.蓝玉簪龙胆茎段组织培养技术的研究[J].西藏植保,1999,87(5):65-68.
[8]陈 敏,白书农.拟南芥菜培养经验点滴[J].植物生理学通讯,1995,31(6):436-438.

