索拉菲尼对肝癌细胞的抑制作用及其对CDK5表达水平的影响
刘 冲 赵浩亮
1.太原市中心医院普外一科,山西太原 030009;2.山西医科大学第一医院普外科,山西太原 030001
原发性肝癌(PHC)是临床上常见的恶性肿瘤之一,其恶性程度高、容易转移和复发,严重威胁着人类的健康,因此寻找一种合理有效的治疗方案则具有重大的意义。随着基因工程技术和现代分子生物学的发展,以免疫治疗为基础的生物治疗及分子靶向药物治疗越来越受到关注,并逐渐成为肝癌治疗的重要手段,为肝癌的治疗提供了新思路[1]。索拉菲尼(sorafenib)是首个口服的多靶点、多激酶抑制剂,作为第1个在肝癌治疗中获得优势生存的靶向药物,已被美国食品与药品管理局(food and drug administration,FDA)确定用于肝癌患者的治疗。周期素依赖性激酶5(CDK5)是细胞周期调控网络的核心蛋白(CDK)家族中的一员,它通过影响细胞增殖和凋亡异常而导致肿瘤的发生发展。本实验观察索拉菲尼在体外对人肝癌HepG2细胞株的抑制作用及其对CDK5表达的影响。
1 材料与方法
1.1 材料
1.1.1 接种细胞 人肝癌HepG2细胞株:购自中国科学院上海生命科学研究院细胞库。
1.1.2 主要试剂 RPMI1640培养基(武汉博士德公司,批号:PYG0035);胎牛血清(杭州四季青公司,批号:040622);二甲基亚枫(DMSO,南京赛泓瑞生物科技有限公司,批号:D-5879)及四甲基偶氮唑盐(MTT,美国Sigma公司,批号:298-93-1);索拉菲尼(Sorafenib,德国拜耳公司,批号: FS10807 );兔抗人CDK5多克隆抗体和羊抗兔抗体( 二抗) (美国Santa Cruz公司,批号:sc-173)。
1.2 方法
1.2.1 细胞培养 将人肝癌hepG2细胞株培养于含10%胎牛血清的RMPI-1640 培养液中,于37℃,5%CO2饱和湿度的孵箱中培养,待细胞贴壁生长后,2 d传代1次,培养至对数生长期用于实验。
1.2.2 MTT法检测索拉菲尼对HepG2细胞增殖的影响 取对数生长期的HepG2细胞,以5×103/孔的密度接种于96 孔板中,培养24 h后加入药物。实验分成4组:索拉非尼(5、10、20 μmol/L)用药组和不加药的对照组。每个剂量设5个复孔,
应用SPSS17.0统计软件进行数据处理,数据以()表示。计量资料多组间比较采用单因素方差分析,两两比较采用LSD-t法,P<0.05为差异有统计学意义。加药后分别培养 12、24、48、72 h,再在每孔中加入 5 mg/mL的MTT 20 μL,继续培养4 h后终止培养,弃去上清液,每孔中另加150μL DMSO,振荡10 min,使结晶物充分溶解,最后用酶标仪测定各孔570 nm处的OD值,同时计算各组药物对细胞增殖的抑制率,抑制率(%)=(1-实验组OD 值/对照组OD 值)×100%。
1.2.3 各组细胞CDK5表达水平的检测 取对数生长期的HepG2细胞,用0.25%胰蛋白酶消化后制成浓度为1×106个/mL的单细胞悬液,接种在盖有玻片的6孔板中(2 mL/孔),24 h后细胞贴壁,弃去培养液;实验组中分别加入浓度为5、10、20μmol/L含索拉菲尼的培养液,而对照组中加不含索拉菲尼的培养液(2 mL/孔)。将4组细胞在37℃、5%CO2孵箱中培养48 h后在倒置显微镜下观察HepG2细胞的生长情况。拿出6孔板,分别用PBS洗涤3次(2min/次),之后用4%多聚甲醛室温固定30 min(2 mL/孔)。采用免疫细胞化学染色法测定各组细胞CDK5的表达水平,实验所有操作步骤均严格按试剂盒说明书进行。根据细胞着色的强弱程度反应CDK5的表达情况。
1.3 统计学处理
2 结果
2.1 索拉菲尼对人肝癌细胞HepG2 增殖的影响
MTT法结果显示,索拉菲尼能明显抑制人肝癌HepG2细胞的生长,且呈明显的时间-剂量依赖效应。随着用药时间的延长,抑制率明显上升; 随着用药浓度的提高,抑制率逐渐升高,各组间两两比较后差异均有统计学意义(P<0.05)。见表1、图 1。
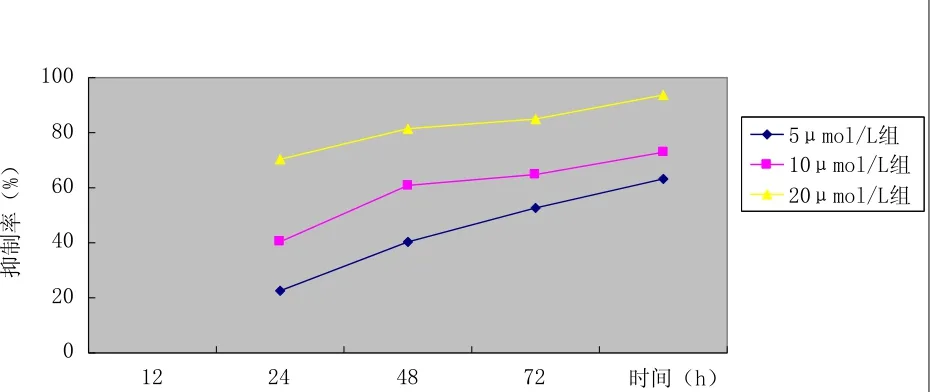
图1 不同浓度索拉非尼作用不同时间对HepG2细胞的抑制作用
表1 MTT 法检测不同浓度索拉菲尼对HepG2细胞增殖的抑制作用(OD 值,±s)
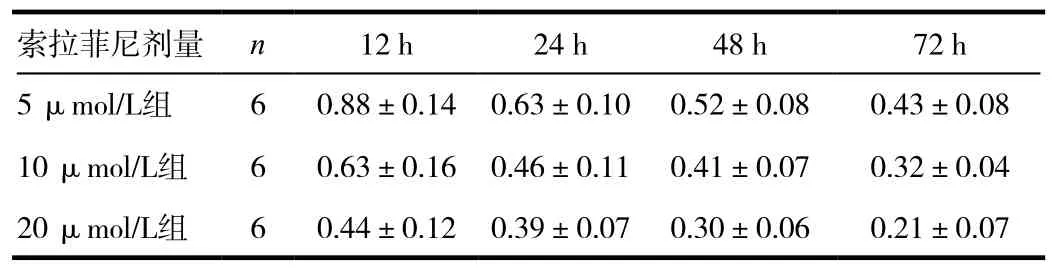
表1 MTT 法检测不同浓度索拉菲尼对HepG2细胞增殖的抑制作用(OD 值,±s)
?
2.2 CDK5 在人肝癌细胞株HepG2中的表达
在倒置显微镜下观察发现:实验组的HepG2细胞形态已发生改变,较多的贴壁细胞由多形性变为透亮的圆形细胞,而且悬浮细胞的比例较对照组明显增多(图2)。光镜下亦观察到CDK5阳性表达产物呈棕黄色颗粒,在细胞核和细胞质中呈弥漫均质分布,且各组细胞阳性着色颗粒的大小、分布密度及着色深浅亦有不同,随索拉菲尼的药物浓度增大,胞核淡染的比例增大且着色逐渐变淡(图3)。A:对照组;B:5 μmol/L组;C:10μmol/L组;D:20μmol/L组。
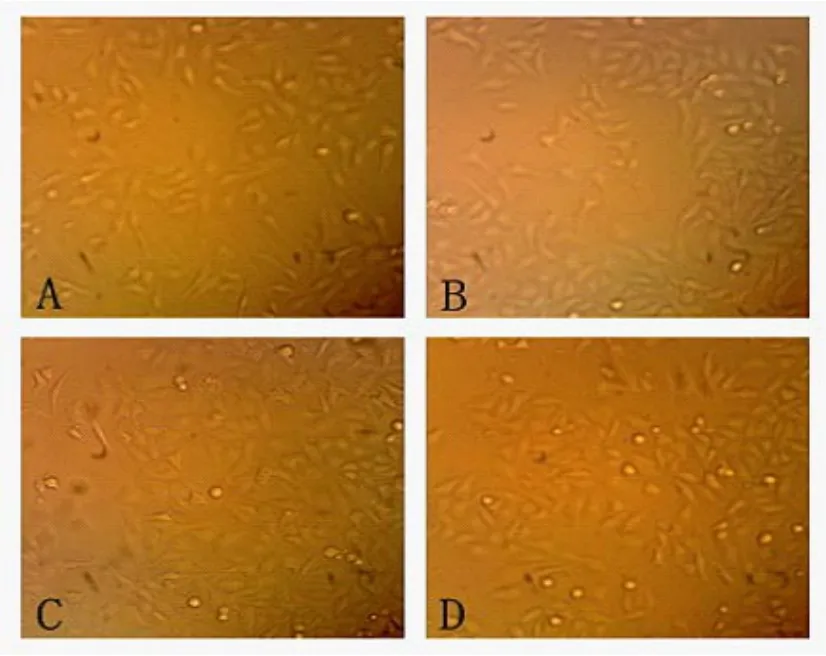
图2 倒置显微镜下观察
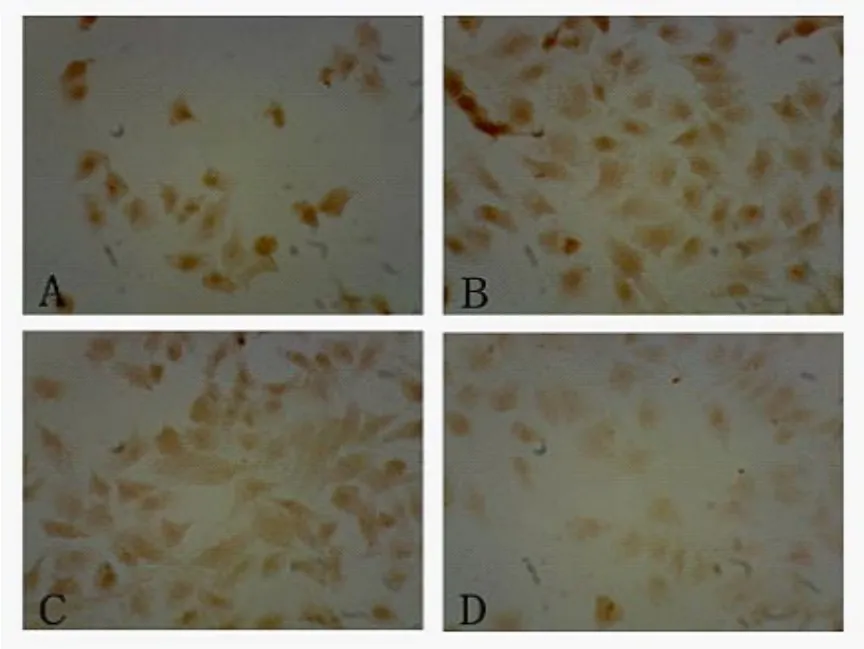
图3 光镜下观察
3 讨论
原发性肝癌的发生发展是一个多基因、多阶段的发展过程,随着分子生物学的不断发展,人们逐渐认识到肝癌的发生发展是由一系列分子事件构成的,比如:原癌基因和抑癌基因的平衡失调、生长因子受体的失调、信号转导的异常、血管生长因子以及基质金属蛋白酶分泌的异常等[2]。而分子靶向药物的飞速发展为治疗原发性肝癌提供了新的选择,并且新型分子靶向药物也在临床实践中取得了显著疗效。原发性肝癌的分子靶向治疗,主要是以肿瘤细胞过度表达的细胞受体、关键基因和某些标志性分子为靶点,通过选择特异性阻断剂对上述靶点和与其相关的信号通路进行有效的干预和调控,进而达到抑制肿瘤生长、发展及转移的效果,具有特异性强、疗效显著、基本不损伤正常组织等优势[3]。与其他恶性肿瘤一样,肝癌中调控细胞生长的信号系统也处于失衡状态,这样其细胞则无限制生长并产生恶性表型。已有研究发现其主要信号通路有:Raf/MEK/ERK信号通路、Janus激酶信号转导子及转录激活子通路、P13 K/Akt/mTOR信号通路、WNT/β-连环蛋白信号通路[4]和核因子кB等。其共同机制为将细胞外异常信号转入细胞核内,通过调控细胞生长、分化和周期等导致肝癌的形成和发展。
索拉非尼是一种新型多靶点信号转导抑制剂,一方面通过靶向作用于Raf/MEK/ERK信号转导通路中的Raf激酶来阻断肝癌细胞的增殖;另一方面通过抑制VEGFR-2/3受体激酶活性而发挥抗血管生成效应;亦有研究发现其还能诱导肝癌细胞凋亡[5-7]。临床Ⅱ期及Ⅲ期实验已表明索拉非尼对肾癌、肝癌、黑素瘤和非小细胞肺癌都有一定的治疗作用。FDA已批准索拉非尼用于肾癌、肝癌的治疗。索拉菲尼已被循证医学证实可以显著延长肝癌患者的中位生存时间[8-9]。
细胞周期素依赖性蛋白激酶(CDK)是细胞周期调控网络的核心蛋白,其表达活性的改变将直接影响细胞周期的长短,这与机体细胞的生长、分化、凋亡以及肿瘤的发生发展及转移密切相关[10-11]。CDK5作为CDK家族中的一员,有60%的序列与CDK2同源, 同时也包含了全部保守的蛋白激酶区域, 并且含有该家族成员共有的PSTAIRE结构域[12],但与其他成员不同,CDK5既非周期素依赖,也不参与细胞周期的调节,而是与p35、p39等调节亚基相互作用在有丝分裂后神经元复杂迁移、突触传递和神经细胞死亡等活动中起重要作用。然而,最新研究已发现CDK5并不仅仅存在于中枢神经系统,在甲状腺髓样癌、肺癌、乳腺癌、前列腺癌等多种肿瘤组织中均有异常表达, 其主要通过影响细胞增殖及凋亡而导致肿瘤的发生发展。董贾中等[13]研究亦发现CDK5在肝细胞癌中也呈上调表达趋势,且与肿瘤的分化程度相关。他们推测其原因可能为:(1)CDK5表达蛋白在肝癌细胞中发生了基因突变,导致CDK5蛋白结构表达异常,从而使CDK5蛋白产生跨膜运动,最终在细胞核内堆积;(2)CDK5作用于肝癌细胞内的转录因子MEF-2,导致其转录发生异常;(3) CDK5亦通过PIKE-A-Akt途径活化Akt,进而激活mTOR信号传导通路,最终引起肿瘤的发生发展;那么,如果应用CDK5的抑制剂则可以通过减少肝癌细胞核内CDK5/P35和磷酸化STAT3,进而延缓肝癌的发生发展。可见,CDK5的高表达在肝癌的发生发展过程中起着重要的作用,其可作为肝癌早期诊断的候选基因,但具体作用机制将有待于进一步研究。
本实验结果显示:索拉菲尼作用于肝癌细胞后,其增殖受到明显的抑制,且CDK5的表达阳性率亦显著降低。而CDK5表达水平下降可能的原因:一方面与阻断Raf/MEK/ERK信号通路有关,在信号转到过程中相关细胞因子发生改变,干扰相关信号转导通路的顺利进行,使得CDK5的表达下调;另一方面索拉菲尼本身可以诱导肝癌细胞凋亡,存活的肝癌细胞则减少,那么CDK5的合成水平则下降,其调节肿瘤发生发展的作用则减弱。可见,动态观察CDK5的水平变化可作为判断肝癌患者病情及疗效的一项重要的指标。
然而,原发性肝癌细胞中信号转导的过程是一个复杂的、多种因素相互交叉的蛋白网络系统,若只切断一个靶点进行治疗显然是不全面的。因此,必须寻找更多有效治疗靶点,如通过多分子与多通路靶点药物间的联合治疗、针对同一信息转导通路的接收器及其下游转导通路中任一阶段的干预进行的合并治疗以及不同分子靶向药物之间互相联合等,有待进一步探索。
[1] L lovet JM,B ruix J.Molecular targeted therapies in hepatocellular carcinoma[J].Hepatology,2008, 48(4):1313-1327.
[2] Villanueva A,Newell P,Chiang DY,et al.Genomlcs and signaling pathways in hepatoceilular carcinoma[J].Semin Liver Dis,2007,27(1):55-76.
[3] Vogelstein B,Kinzler KW.Cancer genes and the pathways theycontrol[J].Nat Med,2004,10(8):789-799.
[4] Thompson MD,Monga SP.WNT/beta-eatenin signaling in liver health and disease[J].Hepatology,2007,45(5):1298-1305.
[5] Flaherty KT.Sorafenib:delivering a targeted drug to the targets[J].Expert Rev Anticaneer Ther,2007,7(5):617-626.
[6] Hampton T.Cancer drug trials show modest benefit:drugs target liver,gastric,head and neck caners[J].JAMA,2007,298(3):273-275.
[7] Liu L,Cao YC,Chen C,et al.Sorafenib blocks the RAF/MEK/ERK pathway,inhibits tumor anglogenesis,and induces tumor cell apoptcsis in hepatocellular carcinoma model PLC/PRF/5[J].Cancer Res,2006,66(24):1851-1858.
[8] Lovet JM,Ricci S,Mazzaferro V,et al.Sorafenib in advanced hepatocellular carcinoma[J].NEngl J Med,2008,359(4):378-390.
[9] Cheng AL,Kang YK,Chen Z,et al.Efficacy and safety of sorafenib in patients in the AsiaPacific region with advanced hepatocellular carcinoma:a phaseⅢrandomisod,Double-blind,placebo-controlled trial[J].Lancet Oncol,2009,10(1):25-34.
[10] Liu L,Schwartz B,Tsubota Y,et al.Cyclindependent kinase inhibitors block leukocyteadhesion and migration[J].Immunol,2008,180:1808-1817.
[11] Cai D,Latham VM Jr,Zhang X,et al.Combined depletion of cell cycle and transcriptional cyclin-dependent kinase activities induces apoptosis in cancer cells[J].Cancer Res,2006,66:9270-9280
[12] Tarricone C,Dhavan R,Peng J,et al.Structure and regulation of the CDK5-p25(nck5a)complex[J].Mol Cell,2001,8:657-669
[13] 董贾中,杨玉秀, 白杨秋,等.CDK5在肝细胞癌中的异常表达[J].世界华人消化杂志,2010,18(10):1010-1015.

