基因工程丁肝抗原的获取和鉴定
丁军颖 邱 丰 苏秋东 卢学新 伊 瑶 毕胜利
随着人们对丁型肝炎病毒(HDV)研究的深入,采用基因工程技术获取具有生物活性的重组丁肝抗原(HDAg)成为解决丁肝诊断研究中HDAg来源困难的一个重要途径。丁肝抗原的测定是诊断和监测丁肝的主要手段,为提高检测丁肝抗原的ELISA诊断试剂质量,高效低成本制备纯度好且效价高的HDAg尤为重要。为此,本实验采用人工编码的小分子质量丁肝抗原(small-HDAg,S-HDAg)基因,以本室改造的 M48为载体,构建了表达质粒,并转化BL21筛选基因工程菌,最后,利用该载体自身具备的6个组氨酸标签进行纯化,以期得到有生物活性的基因工程丁肝抗原蛋白,供丁肝ELISA诊断试剂的研发使用。
材料与方法
1.材料:丁肝小抗原优化基因(北京六合通公司);表达载体M48由本室从商品化质粒PET43a改造并留存;T4DNA连接酶(北京六合通公司);限制性内切酶NcoⅠ和XhoⅠ(北京六合通公司);DNA提取试剂盒(美国,Promega);水平电泳系统(北京六一电泳仪厂);BL21感受态(北京六合通公司); DH5α感受态(北京六合通公司);XMTD-6000电热恒温水槽(北京长风仪器仪表公司);LB培养基(美国,Sigma);IPTG诱导剂(美国Sigma);TZ-2H台式恒温振荡培养箱(北京,沃德创新医药科技中心);垂直电泳系统(美国,Bio-rad);蛋白Marker(中国科学院上海生命科学研究院);His介质(美国,GE);蛋白预染Marker(北京纽英伦生物技术北京有限公司); Gel Doc XR+凝胶成像系统和Image Lab分析软件(美国,Bio-rad);H-15FR低温离心机(美国,KOKUSAN);GGT-900超净工作台(北京半导体设备一厂);半干转膜仪(美国,BIO-RAD);兔抗人IgG(北京乐博生物科技有限公司);牛血清白蛋白(北京毕特博生物技术有限责任公司);硝酸纤维素膜(北京欣经科生物技术有限公司);TMB(美国,Sigma);丁型肝炎病毒抗体诊断试剂盒(北京贝尔生物工程有限公司)。
2.优化密码并全基因序列合成:人工编码S-HDAg基因序列,并在两端加酶切位点(5'为NcoⅠ;3'为XhoⅠ)和保护碱基。全基因序列由北京六合通公司合成,命名为T-D。
3.质粒构建并鉴定:将T-D用NcoⅠ和XhoⅠ进行双酶切,获取目的基因,将此基因连接M48载体,构建质粒M48-D,转化感受态DH5α,挑选阳性克隆,过夜培养,提取质粒,进行双酶切,1%琼脂糖电泳鉴定。同时送至北京六合通公司测序鉴定。
4.蛋白表达并鉴定:将质粒M48-D转化BL21感受态,挑选阳性克隆接种于1.5m l含100mg/L Amp的LB培养基中,37℃,240r/min,培养3h,取菌留存;取该菌种按1∶1000分别接种于含100mg/L Amp的LB培养基中,30℃,240r/min,过夜培养;以含200mg/L Amp的LB培养基做倍比稀释,37℃,240r/min,培养1h后加IPTG至终浓度为0.25mmol/L,37℃诱导表达1h,收获菌液。取500μl上述菌液,10000r/min,离心1min,弃上清,以50μl双蒸水充分重悬,再加等体积2×Buffer,混匀,煮沸3min,取样20μl,以5%浓缩胶和12%分离胶进行常规SDS-PAGE
5.蛋白纯化并鉴定 :将上述菌液以4000r/min,离心10min,弃上清;以菌体裂解液(10mmol/L Tris-Hcl、0.5% Triton X-100、500mmol/L NaCl)重悬,在冰浴中以250W超声破碎15min(24个循环)。以12000r/min,离心10min,上清过镍柱,以咪唑梯度洗脱,收集各峰,进行常规SDS-PAGE,并以Image Lab软件分析。
6.Western blotting检测蛋白生物学活性:将SDS-PAGE分离胶中的蛋白转至硝酸纤维素膜上,以丁肝阳性血清为一抗,兔抗人IgG为二抗,以TMB显色,进行常规Western blotting。
7.ELISA验证蛋白生物学活性:将本研究表达的基因工程丁肝蛋白包被于聚丙乙烯板,以牛血清作为本底对照,将两种物质均用pH值为9.6的碳酸盐缓冲液稀释,依次以10.0,8.0,6.0,4.0,2.0和1.0μg/m l的浓度进行梯度包被和封闭,开展ELISA结合研究;以北京贝尔生物工程有限公司丁肝抗体ELISA诊断试剂作对照。
结果
1.密码子优化与全基因序列合成:对S-HDAg进行人工编码,并在5'和3'端设置酶切位点NcoⅠ和XhoⅠ,另加保护碱基,得到全基因,如下:
5'-CCCATGGGTC GTTCCGAATC ACGCAAACAT CGTGGTGGCC GTGAAGAAGC TCTTGAGCAA TGGATTTCTG GTCGTAAGAA ACTTGAAGAG CTTGAACGTG AGGCTCGTAA AATCAAAAAG AAAATCAAGA AACTTGAAGA CGACAATCCT TGGCTTGGTA ACGTTAAAGG TATTCTGGGC AAAAAGGACG AGGAAGGTGA AGGTGCACCT CCTGCTAAAC GCGCTCGTAC CGACCAGATG GAAGTTGACA CCGGTCCGCG TAAGCGTCCTCTGCGTGGCG GTTTCACAGA CAAAGAGCGT CAAGACCATC GCCGTCGTAA GGCTCTGGAA AATAAAAAGA AACAGCTTAC CGCAGGTGGT AAGTCTCTGT CTCGTGAGGA AGAGGAAGAG CTTAAACGTC TGACCGAAGA GGACGAACGT CGCGAGCGTC GTGTTGCGGG CCCCTCTGTT GGTGGTGTTA ACCCTCTGGA AGGTGGCTCC CGTGGTGCTC CTGGTGGTGG CTTCGTTCCT TCTATGCAAG GTATCCCTGA ATCTCCTTTT ACCCGTACAG GTGAAGGTCTGGACGTTCGT GGTGGTCAGG GTTTCCCGCT CGAGGC-3'。
2.重组表达质粒的构建:北京六合通公司合成含目的基因序列的质粒(T-D),酶切后回收目的基因,连接到M48载体上。连接成功的质粒(M48-D)双酶切鉴定符合预期结果(图1)。质粒送公司测序鉴定,连接框架和准确性均符合要求,说明成功构建了M48-D重组表达质粒。
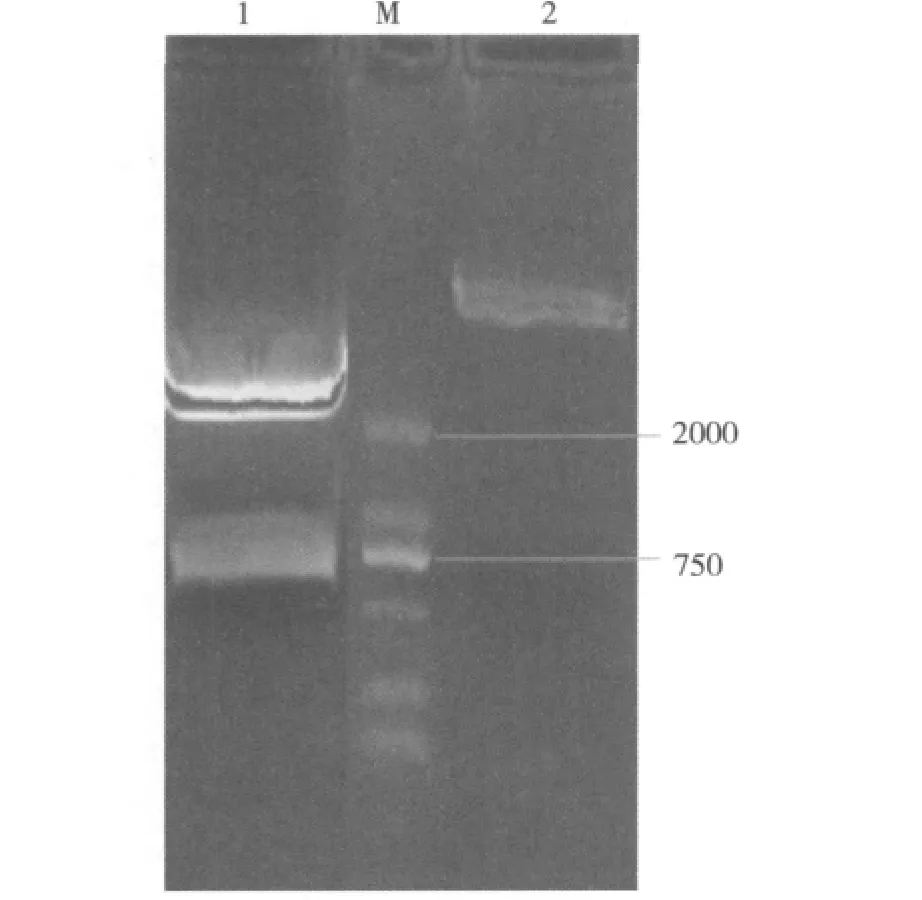
图1 M 48-D重组质粒及其双酶切产物1%琼脂糖凝胶电泳图1.双酶切产物;M.DNA标志(DL2000);2.M48-D质粒
3.蛋白表达与纯化:以重组质粒M48-D转化BL21感受态细胞,经IPTG诱导,SDS-PAGE显示有外源蛋白表达,表观分子质量与预期大小一致,约为35kDa(图2);经超声裂解证实,表达蛋白多为可溶性蛋白;裂解液重悬后离心收集上清,通过亲和层析以梯度咪唑洗脱,SDS-PAGE电泳验证,300mmol/L咪唑的洗脱峰主要是目的蛋白,收集此目的蛋白峰(图3)。经Image Lab软件分析,获得的蛋白浓度约为2g/L,纯度>90%。

图2 不同阳性克隆的蛋白表达SDS-PAGE结果M.蛋白标准;1~6.6个不同阳性克隆;C.阴性对照
4.蛋白生物学活性鉴定:Western blotting实验结果(图4)显示,表达和纯化的基因工程S-HDAg蛋白具备与丁肝抗体结合的生物活性。

图3 表达蛋白亲和层析的咪唑梯度洗脱SDS-PAGE结果

图4 表达和纯化蛋白的W estern blotting结果
5.蛋白生物学活性验证:ELISA结合试验结果显示,表达纯化的基因工程丁肝抗原蛋白与阳性血清能特异结合。梯度试验显示:显色浓度与包被蛋白浓度呈正相关,两者结合特异性较强。其中,当包被浓度为2μg/m l(1∶1000稀释度)时,可替代北京贝尔生物工程有限公司的相应诊断试剂成分,用于ELISA检测。
讨论
HDV是1977年意大利的Rizzetto等[1]首先发现的。当时曾被误认为是乙肝病毒新的抗原系统。1979~1980年经黑猩猩试验,证明是一种新病毒,需要嗜肝病毒(主要是乙肝病毒)辅助,尤其是外壳蛋白的合成,才能形成具有完整结构的病毒颗粒[2,3]。1984年被正式命名为丁型肝炎病毒[4]。HDAg存在小分子质量(24kDa)丁肝抗原(S-HDAg)和大分子质量(27kDa)丁肝抗原(long-HDAg,L-HDAg)两种形式,目前认为可能是转录过程中存在特殊RNA编辑所致[5]。通过RNA编辑,S-HDAg的终止密码子UAG变为UGG,从而翻译成为L-HDAg[6]。二者具有共同起始密码并具有共同氨基酸终末序列,具有不同的终止密码。除L-HDAg C端多19个氨基酸外,两基因在序列上完全相同,事实上两种形式来源于同一开放读码框(ORF),即反基因组RNA上的ORF5[7]。本研究是依据在大肠杆菌中蛋白质密码子的使用频率,对S-HDAg基因进行人工编码后开展的,以期构建能高效表达的质粒。
本研究选用含硫氧还蛋白(Trx)的原核表达系统,此系统尤其适用大量表达可溶性蛋白[8]。Trx相对分子质量为12kDa,属于进化保守的家族,具有多个活性中心。其中,两个半胱氨酸经过可逆的氧化过程可将自身巯基转化为二硫键,在与S-HDAg目的蛋白进行融合表达时,有利于目的蛋白空间结构的正确折叠,为其能具有生物活性提供有利条件[9~11]。即借助硫氧还蛋白的分子伴侣作用,确保大量表达的S-HDAg蛋白能正确折叠且表现出全部生物学活性[12]。
经过不同载体的尝试,本研究最终采用改装后仍带有组氨酸标签(His-tag)的M48载体来表达目的蛋白,以利于高效纯化。该载体多克隆酶切位点上游有编码6个组氨酸的基因序列,重组质粒经诱导表达后,组氨酸可与外源插入基因融合表达[13~16]。依据组氨酸与金属镍(Ni)之间的亲和力所产生的螯合作用而设计的亲和层析方法,是纯化此种融合蛋白高效而简单的方法[17]。表达蛋白的细胞沉淀经裂解液溶解,上清经镍柱吸附,因咪唑与组氨酸有类似的化学结构,可与组氨酸竞争性结合金属镍,所以咪唑置换可洗脱下特异结合的S-HDAg蛋白,从而获取高纯度的基因工程丁肝抗原。
本研究成功构建了含S-HDAg优化基因的重组表达质粒和相应的工程菌,并在含硫氧还蛋白的原核表达系统获得高效表达,通过亲和层析纯化得到可与丁肝抗体结合的S-HDAg蛋白,为丁肝的ELISA诊断试剂研发奠定了基础。
1 Rizzetto M,Canese MG,AricòS,etal.Immunofluorescence detection of new antigen-antibody system(delta/anti-delta)associated to hepatitis B virus in liver and in serum of HBsAg carriers[J].Gut,1977,18(12):997-1003
2 Rizzetto M,Hoyer B,Canese MG,et al.Delta Agent:association of delta antigen with hepatitis B surface antigen and RNA in serum of delta-infected chimpanzees[J].Proc Natl Acad SciU SA,1980,77 (10):6124-6128
3 Rizzetto M,Canese MG,Gerin JL,etal.Transmission of the hepatitis B virus-associated delta antigen to chimpanzees[J].J Infect Dis,1980,141(5):590-602
4 Novick DM,Farci P,Karayiannis P,etal.Hepatitis D virusantibody in HBsAg-positive and HBsAg-negative substance abusers with chronic liver disease[J].JMed Virol,1985,15(4):351-356
5 Volchkova VA,Dolnik O,Martinez MJ,et al.Genomic RNA editing and its impact on Ebola virus adaptation during serial passages in cell culture and infection ofguinea pigs[J].JInfectDis,2011,204(3): S941-946
6 Wong SK,Lazinski DW.Replicating hepatitis delta virus RNA is edited in the nucleus by the small form of ADAR1[J].Proceedings of the National Academy of Sciences of the United States of America,2002,99(23):15118-15123
7 Shih KN,Chuang YT,Liu H,et al.Hepatitis D virus RNA editing is inhibited by a GFP fusion protein containing a C-terminally deleted delta antigen[J].The Journal of General Virology,2004,85(4):947-957
8 刘雷,尹钧.硫氧还蛋白的研究[J].东北农业大学学报,2003,34 (2):210-218
9 Roos G,Foloppe N,Van Laer K,et al.How thioredoxin dissociates itsmixed disulfide[J].PLoSComput Biol,2009,5(8):e1000461
10 Carvalho AT,Swart M,van Stralen JN,et al.Mechanism of thioredoxin-catalyzed disulfide reduction.Activation of the buried thiol and role of the variable active-site residues[J].JPhys Chem B,2008,112(8):2511-2523
11 Bauer H,Massey V,Arscott LD,et al.The mechanism of high Mr thioredoxin reductase from Drosophilamelanogaster[J].JBiol Chem,2003,278(35):33020-33028
12 黎明,宋馨宇,王晓娟,等.双顺反子翻译偶联表达载体的构建及蚓激酶基因F238在大肠杆菌中的可溶性表达[J].微生物学通报,2011,38(7):1056-1062
13 夏海锋,张显,金雄华,等.镍离子亲和层析介质的制备及其用于组氨酸标记蛋白质的纯化[J].江南大学学报,2010,9(6):685-689
14 Randolph TW.The two faces of His-tag:Immune response versus ease of protein purification[J].Biotechnol J,2012,7(1):18-19
15 Medrano G,Dolan MC,Condori J,etal.Quality assessmentof recombinant proteins produced in plants[J].Methods Mol Biol,2012,82 (4):535-564
16 Fujishima SH,Nonaka H,Uchinomiya SH,et al.Design of a multinuclear Zn(ii)complex asa newmolecular probe for fluorescence imaging of His-tag fused proteins[J].Chem Commun(Camb),2011,48(4):594-596
17 张培因,王燕媚,卫红飞,等.金属螯合亲和层析填料的制备及其在重组六聚组氨酸融合蛋白中的应用[J].吉林大学学报,2008,34(2):340-342
——一道江苏高考题的奥秘解读和拓展

