地西他滨联合丙戊酸钠体外诱导1例AM L-M 2复发患者原始细胞凋亡分化的作用研究
陈琼娜 王晔恺 周吉航 李翊卫 曾 芳 刘晓光
地西他滨(decitabine,DCA)主要成分为5-杂氮-2'-脱氧胞苷,为一种去甲基化药物,目前获批用于中高危骨髓增生异常综合征(myelodysplastic syndrome,MDS)的治疗。在先前的研究中,我们发现体外AML细胞株中利用DCA可引起其生长抑制、促其凋亡和分化[1]。在国外临床试验中,DCA联合某些组蛋白去乙酰化酶抑制剂药物如丙戊酸钠(valproic acid,VPA)对难治/复发性AML患者往往能收到较好的疗效[2]。由于国内 DCA尚未正式获批用于AML的治疗,因此我们通过分选一例难治/复发性的AML-M2患者的原始细胞,体外观察两药物对其促凋亡和分化的影响,为两药联合治疗AML提供更多的实验依据。
材料与方法
1.仪器和试剂:地西他滨(5-氮杂-2'-脱氧胞嘧啶核苷粉剂)购自Sigma,丙戊酸钠粉剂(德巴金针)购自赛诺菲-安万特,AnnexinⅤ/PI凋亡试剂盒、CD14-FITC、CD117-PE均购自美国BD公司,流式细胞仪为美国BD FACSCalibur带分选模块。
2.病例简介:患者,女性,2010年5月初发AML-M2a,47岁,经阿糖胞苷联合柔红霉素联合化疗后获得初步缓解,10个月后复发。复发时仍为M2a,外周血WBC 1.7×109/L,RBC 2.74×109/L,Hb 101g/L,PLT 123×109/L。原始细胞群主要流式髓系免疫表型:CD117:76.33%,CD14:11.13%,CD11b: 18.12%,CD13:37.32%,CD33:3.62%。
3.流式分选:使用患者复发时的骨髓2ml,溶血后以CD45-SSC设门(图1),选取中等CD45表达和低SSC的原始细胞群(图1),分选至50ml分选管,分选多管(分选模式为得率优先),高速离心富集。
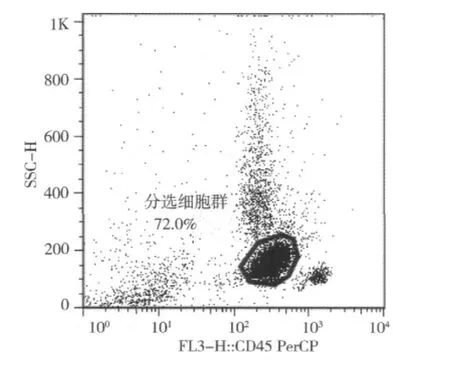
图1 AM l-M 2a原始细胞分选
4.细胞培养及药物处理:将富集后的细胞采用含10%小牛血清的RPMI 1640培养液在37℃、5%CO2的培养箱中培养,同时加入药物(药物设立分组见表1),配制浓度为1×105个/毫升的细胞悬液接种于6孔培养板,2毫升/孔,置37℃、5%CO2、饱和湿度的培养箱中培养,,作用48h后各孔吸出培养液,分为3份进行以下各步实验,每份设置6个药物浓度组,每组设3复孔。
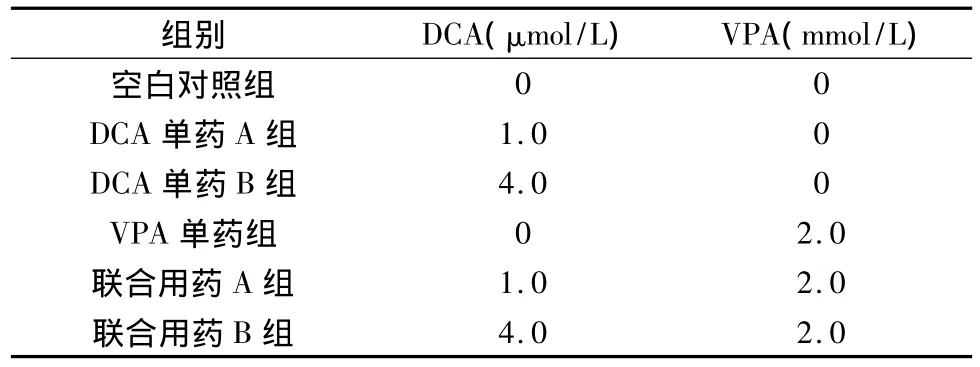
表1 药物浓度组设立(其中药物浓度均为终浓度)
5.AnnexinⅤ/PI标记法观察凋亡:取“细胞培养及药物处理”步骤中第1份细胞,用预冷PBS洗涤弃上清,残渣细胞收集至流式管。每管加10μl Annexin V和5μl PI,避光静置15min,加200μl预冷的PBS,振荡混匀,上机检测其早期凋亡率。
6.CD117、CD14检测:细胞培养及药物处理步骤第2、3份细胞用预冷PBS洗涤弃上清,残渣细胞收集至流式管。第2份加CD117 10μl,第3份加CD14各10μl,避光静置15min上机,计算CD117和CD14表达率。
7.统计学方法:采用SPSS 13.0软件,对各组中早期凋亡率、CD117和CD14表达率做单因素方差分析和LSD两两检验,以P<0.05为具有显著统计学意义。
结果
1.AnnexinⅤ/PI标记法检测凋亡:见图2,空白对照组、DCA单药A组、DCA单药B组、VPA单药组、联合用药A组、联合用药B组的早期凋亡率分别为12.12%±0.84%、15.32%±0.75%、24.11%± 2.10%、14.11% ±2.13%、38.14% ±2.10%、44.11%±2.12%,联合用药A组高于DCA单药A组和VPA单药组,差异具有显著统计学意义(P<0.01),联合用药B组高于DCA单药B组和VPA单药组,差异具有显著统计学意义(P<0.01)。
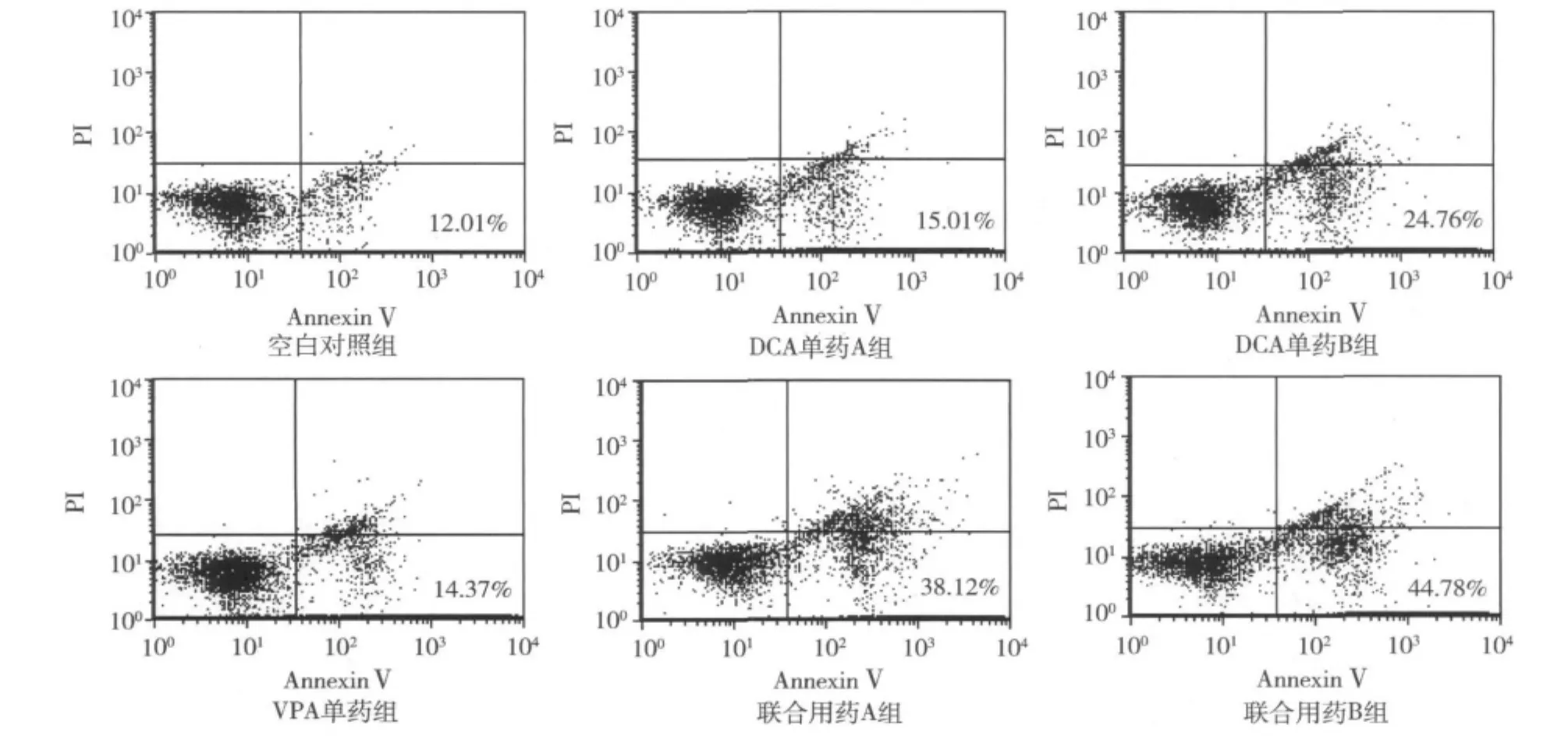
图2 各药物浓度组早期凋亡率(Annexin V+/PI-)
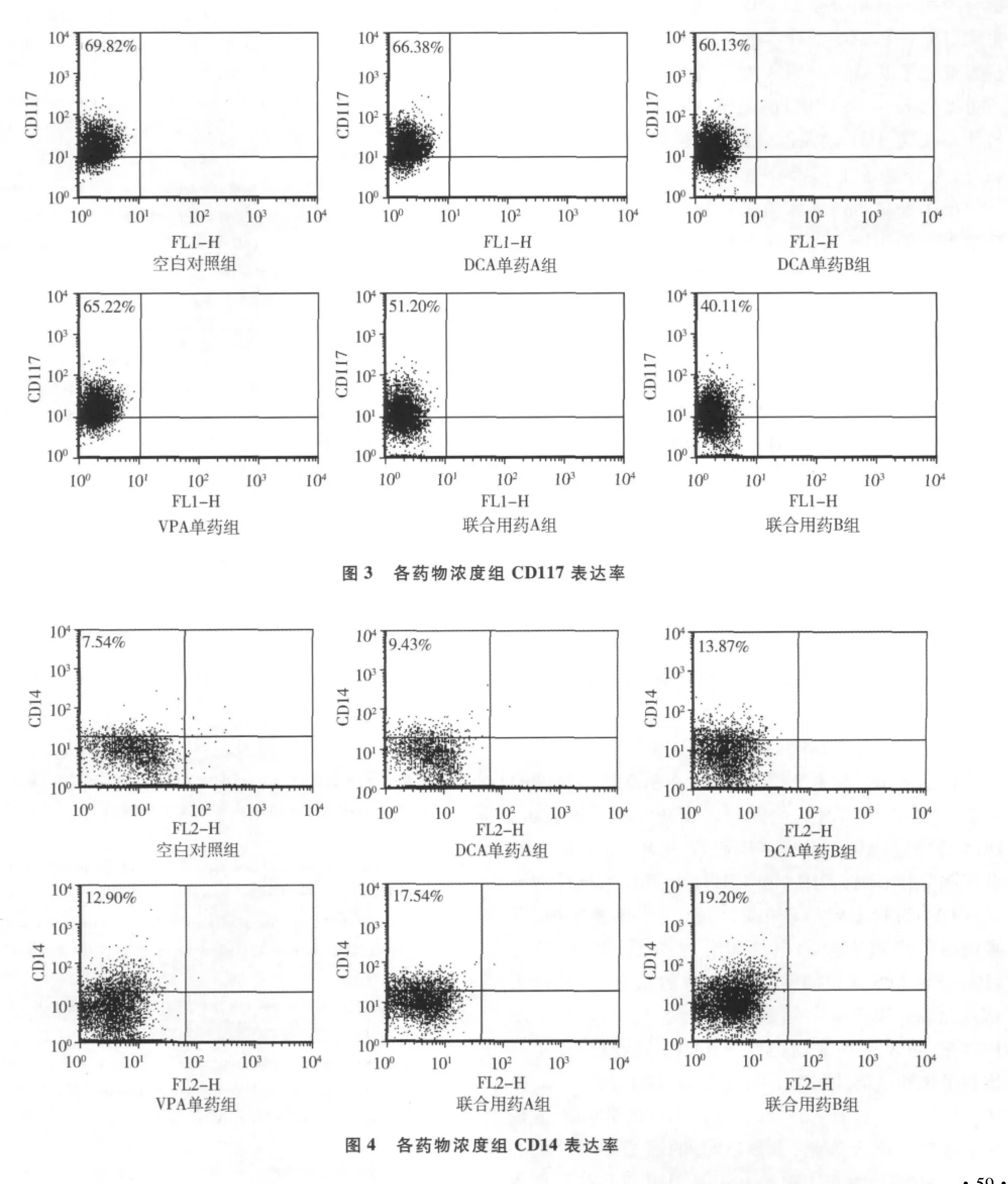
2.CD117、CD14分化抗原检测:见图3、图4,空白对照组、DCA单药A组、DCA单药B组、VPA单药组、联合用药A组、联合用药B组的CD117表达率分别为70.22%±1.92%、66.90%±1.23%、60.32%± 2.10%、65.17% ±1.09%、51.19% ±1.46%、40.30%±2.18%,联合用药A组低于于DCA单药A组和VPA单药组,差异具有显著统计学意义(P<0.01),联合用药B组低于DCA单药B组和VPA单药组,差异具有显著统计学意义(P<0.01)。DCA单药A组、DCA单药B组、VPA单药组、联合用药A组、联合用药 B组的 CD14表达率分别为7.32% ± 0.32%、9.11%±0.47%、13.45%±1.02%、12.22%± 0.91%、17.13%±1.45%、19.11%±1.69%,联合用药A组高于DCA单药A组和VPA单药组,差异具有显著统计学意义(P<0.01),联合用药B组高于DCA单药B组和VPA单药组,差异具有显著统计学意义(P<0.01)。
讨论
DCA作为一种甲基转移酶抑制剂,主要通过抑制DNA甲基转移酶,逆转DNA的甲基化过程,激活多种抑癌基因表达,诱导肿瘤细胞凋亡或向正常细胞分化[3]。DCA单用治疗骨髓异常增生综合征(myelodysplastic syndrome,MDS)效果已超越传统治疗手段[4~6]。MDS一般在数月至数年内转化为AML,且部分类别的核型异常的MDS进展为AML的可能性更大,DCA在MDS治疗中的积极成果给治疗AML的探索奠定了基础[7]。DCA对于部分不能接受标准化疗方案(Ara-C+DNR)的老年AML患者、部分MDS转化而来的AML以及部分难治/复发AML患者效果较好,充分显示了其治疗AML的巨大潜力[8,9]。但从目前国外总体的临床情况来看,DCA对于AML治疗效果不如MDS稳定,存在较大的个体差异。国外研究表明DCA和VPA联用在体外多种肿瘤细胞中均体现出较佳的抗肿瘤活性和恢复抑癌基因表达的效果,如卢等[10]联用DCA和VPA对U266细胞恢复抑癌基因RASSF1A基因的表达,Luszczek等[11]联用DCA和VPA作用于小细胞肺癌引起其DNA损伤。这都说明表观遗传学调控中,组蛋白去乙酰化和DNA甲基化两种机制可以相互协调,共同调控细胞活性。由于目前国内DCA尚未正式获批用于AML患者的治疗,因此我们通过流式分选出AML患者的骨髓原始细胞体外与药物作用观察其对白血病细胞的促凋亡分化作用。本研究显示DCA和VPA体外显示出协同促原始细胞凋亡的能力,其中空白对照组的早期凋亡率达到了10%左右,可能和细胞经流式电极分选后的表面轻度损伤有关。
在临床治疗MDS的应用中,DCA主要的不良反应为骨髓抑制导致血三系降低,进而引起感染风险的增加,一般需要口服抗生素加以预防。有报道显示,DCA能促进MDS-RAEB细胞株SKM-1向成熟髓系细胞分化,增强CD14和CD11b成熟髓系抗原的表达,CD14为脂多糖(LPS)受体,存在于单核细胞、巨噬细胞等细胞表面的白细胞分化抗原,识别、结合LPS,介导LPS性细胞反应,在LPS性炎症反应、内毒素休克等病理反应中起重要作用[12,13]。本研究显示DCA和VPA体外联用能促进CD14的表达,提示其增强了体外抗革兰阴性菌能力。CD117作为c-kit受体膜外区分子表面抗原标志,表达于造血祖细胞、不成熟粒细胞和肥大细胞,多数AML的原始细胞中均有CD117的表达,并且CD117的高表达和细胞的恶性程度相关,往往预示着预后不良。本研究还显示VPA协同DCA降低CD117的表达,从分化抗原角度说明它们能共同作用于降低肿瘤细胞的恶性程度。但是体内两药联用是否也存在类似的效应,尚需进一步研究。
1 王晔恺,周吉航,周世权,等.急性髓系白血病患者hPer3基因启动子甲基化状态及其去甲基化对白血病细胞增殖的影响[J].中华血液学杂志,2011,32(5):317-321
2 Blum W,Klisovic RB,Hackanson B,et al.Phase Istudy of decitabine alone or in combination with valproic acid in acute myeloid leukemia[J].JClin Oncol,2007,25(25):3884-3891
3 Bryan J,Kantarjian H,Garcia-Manero G,et al.Pharmacokinetic evaluation of decitabine for the treatment of leukemia[J].ExpertOpin Drug Metab Toxicol,2011,7(5):661-672
4 Lubbert M,Suciu S,Baila L,et al.Low-dose decitabine versus best supportive care in elderly patients with intermediate-or high-risk myelodysplastic syndrome(MDS)ineligible for intensive chemotherapy:final results of the randomized phase IIIstudy of the European Organisation for Research and Treatment of Cancer Leukemia Group and the German MDS Study Group[J].J Clin Oncol,2011,29(15): 1987-1996
5 Santos FP,Kantarjian H,Garcia-Manero G,et al.Decitabine in the treatment ofmyelodysplastic syndromes[J].Expert Rev Anticancer T-her,2010,10(1):9-22
6 Steensma DP.Decitabine treatment of patientswith higher-risk myelodysplastic syndromes[J].Leuk Res,2009,33 Suppl 2:S12-17
7 CuiW,Sun J,Cotta CV,et al.Myelodysplastic syndrome with inv (3)(q21q26.2)or t(3;3)(q21;q26.2)has a high risk for progression to acute myeloid leukemia[J].Am J Clin Pathol,2011,136 (2):282-288
8 Cashen AF,Schiller GJ,O'Donnell MR,et al.Multicenter,phase II study of decitabine for the first-line treatment of older patients with acutemyeloid leukemia[J].JClin Oncol,2010,28(4):556-561
9 Lubbert M,Minden M.Decitabine in acutemyeloid leukemia[J].Semin Hematol,2005,42(3 Suppl 2):S38-42
10 卢菲,刘传方,马道斯,等.丙戊酸钠协同5-杂氮-2'-脱氧胞苷对U266细胞RASSF1A基因表达调控的影响[J].中华血液学杂志,2010,31(4):223-227
11 Luszczek W,Cheriyath V,Mekhail TM,et al.Combinations of DNA methyltransferase and histone deacetylase inhibitors induce DNA damage in small cell lung cancer cells:correlation of resistance with IFN-stimulated gene expression[J].Mol Cancer Ther,2010,9(8):2309-2321
12 杨力,徐瑞容,黄红铭,等.地西他滨对MDS细胞株SKM-1的作用研究[J].交通医学,2007,21(1):34-35
13 Dessing MC,Knapp S,Florquin S,et al.CD14 facilitates invasive respiratory tract infection by Streptococcus pneumoniae[J].Am JRespir Crit Care Med,2007,175(6):604-611