新型八核铜配合物乳剂的体内外抗肿瘤作用*
葛蓓蕾,徐 霞,陈小让
(郑州大学:1.实验动物中心;2.药学院,郑州 450052)
新型八核铜配合物乳剂的体内外抗肿瘤作用*
葛蓓蕾1,徐 霞2,陈小让2
(郑州大学:1.实验动物中心;2.药学院,郑州 450052)
目的探讨新型八核铜配合物乳剂(N-Cu)的体内、外抗肿瘤作用。方法 采用甲基噻唑基四唑(MTT)法检测不同浓度N-Cu对HT29、HeLa、SGC7901和EC9706肿瘤细胞增殖的影响。利用S180腹水瘤小鼠模型观察不同浓度N-Cu的体内抗肿瘤作用。采用流式细胞仪测定不同浓度N-Cu对S180细胞周期的影响。结果N-Cu作用4种肿瘤细胞24h后,细胞增殖均受到了不同程度的抑制,且呈浓度依赖性。N-Cu对荷S180小鼠的肿瘤生长有明显的抑制作用。N-Cu能使G0/G1期细胞明显增多,S期细胞减少,细胞被阻滞于G0/G1期,差异具有统计学意义(P0.05)。结论N-Cu在体内、外具有抗肿瘤作用。
抗肿瘤药;细胞周期;肿瘤细胞,培养的;小鼠;八核铜配合物
恶性肿瘤是危害人类健康的严重疾病之一。随着对肿瘤形成机制研究的深入,化疗在肿瘤的治疗中日益重要。由于传统的抗肿瘤药价格昂贵,且对机体均有明显的毒副作用[1],因此,研究开发廉价、低毒的抗肿瘤药物已成为当前面临的迫切问题。本实验所用的新型八核铜配合物乳剂(new eight-copper complex emulsion,N-Cu)是由郑州大学化学系无机教研室合成的新型铜配合物的纳米材料,具有特殊的双螺旋结构。它是以抗高血压药替米沙坦为配体,和8个铜离子配合在一起的相对分子质量为8 723的大分子化合物。它在甲醇、乙醇中的溶解 度 很 小,在 二 甲 基 甲 酰 胺 (N,N-dimethylformamide,DMF)、二甲基亚砜(dimethyl sulfoxide,DMSO)、乙腈、二氯甲烷中溶解度较大。用一定比例的DMSO促溶后,溶解在0.1mmol/L Tris-HCl中 比 较 稳 定,该 溶 液 在 238nm 和296nm处有较大的吸收度,可以用紫外分光光度法定量。
本组在进行了急性毒性研究的基础上,对N-Cu的体内外抗肿瘤作用进行了研究,目的在于探讨将其开发成为廉价、低毒的抗肿瘤药物的可能性。
1 材料与方法
1.1 实验材料
1.1.1 供试品与试剂 N-Cu为化学合成物,相对分子质量为8 723,由郑州大学化学系无机教研室合成提供;顺铂(5mg/mL)注射液(DDP),云南生物谷灯盏花药业有限公司提供,批号:20081203;细胞周期检测试剂盒为南京凯基生物科技有限公司产品,批号:KGA511。
1.1.2 实验细胞株及动物 本实验所用细胞株分别为人结肠癌细胞HT29、人宫颈癌细胞HeLa、人胃癌细胞SGC7901和人食管癌细胞EC9706,均为贴壁生长的细胞购自中国科学院上海细胞生物研究所,在郑州大学药学院长期传代培养。小鼠S180腹水瘤细胞,引自中国科学院上海细胞生物研究所,在郑州大学实验动物中心传代保存。无特定病原体级昆明种小鼠90只,体质量(20.0±2.0)g,雌性,由河南省实验动物中心提供,动物生产合格证号:SCXK(豫)2005-0001。普通环境条件下进行该实验,温度20~22℃,相对湿度45%~50%,自由进食和饮水[2]。
1.1.3 实验仪器 电子天平,德国赛多利斯有限公司,BP211D型;离心机,上海安亭科学仪器厂,TDL80-2B型;倒置显微镜,日本Olympus公司,BH-2型;CO2培养箱,德国 Hereaus公司生产,W1-TS606/2-I型;医用净化工作台,苏州市冯氏实验动物设备有限公司,CJ-2F型;酶标仪,DYNEX技术有限公司,ISPA-0045型;流式细胞仪,美国Coulter公司,EPICXU型。为100.00、50.00、25.00、10.00、5.00μg/mL;实验阳性对照组用顺铂浓度为5.00μg/mL,阴性对照选用空白乳剂,
1.2 实验方法
1.2.1 甲基噻唑基四唑(methyl thiazolyl tetrazolium,MTT)法测定N-Cu对肿瘤细胞增殖的影响[3-6]取对数生长期的HT29、HeLa、SGC7901、EC9706细胞,制成单细胞悬液,接种于96孔培养板内,每孔200μL;待细胞贴壁后,实验组加不同浓度N-Cu溶液200μL/孔,使终浓度分别空白对照用DMSO,每组、设6个平行复孔。置5%CO2培养箱内分别培养24h后,每孔加入20μL浓度为5mg/mL的 MTT;继续培养4h后弃全部上清液,每孔加DMSO 200μL,37℃震荡孵育10min;用酶标仪检测490nm处的吸光度(absorbance,A)值。抑制率计算公式:抑制率(%)=(对照组A490-加药组A490)∕对照组A490×100%。采用半数抑制浓度(inhibitory concentration 50,IC50)计算软件计算IC50,以上实验重复3次。
表1 N-Cu对肿瘤细胞增殖的抑制率(±s,%,n=3,24h)

表1 N-Cu对肿瘤细胞增殖的抑制率(±s,%,n=3,24h)
抑制率DDP 5.00(阳性对照)药物浓度(μg/mL) HT29抑制率 HeLa抑制率 SGC7901抑制率 EC9706 10.70±2.41 3.88±0.37 4.42±0.09 15.44±1.47 N-Cu 5.00 5.26±1.77 6.52±1.18 5.68±3.11 10.20±1.06 10.00 21.43±0.42 9.45±0.58 10.46±2.04 23.50±0.99 25.00 48.07±2.31 56.29±0.06 22.29±0.71 37.82±2.22 50.00 78.50±4.00 86.57±1.89 66.57±1.45 59.68±0.55 100.00 86.80±0.84 91.01±3.01 77.13±0.21 74.03±4.86
1.2.2 N-Cu对荷S180腹水瘤小鼠的体内抑瘤实验 选择接种S180腹水瘤后6~8d的健康小鼠,无菌条件下抽吸腹水,用生理盐水1∶3稀释后,倒置显微镜下计数活细胞,调整其浓度至1×107个/mL[7],用75%乙醇消毒小鼠腹腔外表面,以0.5mL/只(含腹水瘤细胞5×106个)[8]接种到腹腔。接种次日,称量每只小鼠的体质量后,随机分成生理盐水阴性对照组、溶剂对照组、顺铂阳性对照组及 N-Cu高(0.80mg/mL)、中(0.40mg/mL)、低(0.20mg/mL)浓度组。每组15只。S180腹水瘤模型建立24h后,尾静脉注射不同浓度N-Cu 0.2mL/10g治疗,每日1次,连续给药7d。用药期间每隔一天称量小鼠的体质量并记录。第7天给药后24h,每组随机挑取5只小鼠,抽取全部腹水,测量腹水体积。停药次日将每组剩余的10只小鼠正常饲养,每日观察小鼠的状况并记录死亡时间,计算存活天数(存活超过30d的按30d计算)及生命延长率[9]。
生命延长率(%)=(治疗组平均存活天数/对照组平均存活天数-1)×100%。
1.2.3 流式细胞仪检测N-Cu对S180细胞周期的影响 第7天给药后24h,每组随机抽取5只动物的瘤液,混合后留取1 mL。取留取的腹水细胞置入培养液(含10%胎牛血清、青霉素100μg/mL及链霉素100μg/mL)中37℃培养。等到细胞生长到对数生长期时,用磷酸盐缓冲液(phosphate buffer saline,PBS)冲洗并加入0.25%的胰酶适量消化[10],吹打使团块细胞分离,细胞分布均匀,制成单细胞悬液。置入离心管离心后待测定。
1.3 统计学处理
应用SPSS13.0统计软件进行统计分析,数据以±s表示。组间样本均数比较采用单因素方差分析。检验水准α=0.05。
2 结 果
2.1 N-Cu体外实验 N-Cu分别作用于4种肿瘤细胞24h后,细胞增殖均受到了不同程度的抑制。且在药物浓度为100.00μg/mL时,抑制率都达到了70%以上,其中,对 HeLa细胞的抑制作用最明显,高达91.01%。在5~100μg/mL实验浓度范围内呈剂量依赖性,作用时间在24h内抑制率上升。见表1。N-Cu对4种肿瘤细胞增殖的IC50值均小于35.00μg/mL,其中对HeLa细胞作用的IC50最小,对SGC7901细胞作用的IC50最大。见表2。
2.2 N-Cu体内实验 体内实验结果表明,N-Cu各剂量组小鼠平均体质量与对照组比较,差异均无统计学意义;N-Cu各剂量组腹水体积与生理盐水组相比,差异均有统计学意义(P0.05),各用药组与生理盐水组相比,生命延长率差异均有统计学意义(P0.05)。结果见表3~5。
表2 N-Cu对不同肿瘤细胞增殖的IC50(±s,μg/mL,n=3,24h)

表2 N-Cu对不同肿瘤细胞增殖的IC50(±s,μg/mL,n=3,24h)
肿瘤细胞 IC50(μg/mL)HT29 23.50±0.32 HeLa 17.50±0.02 SGC7901 34.50±1.04 EC9706 31.95±0.51
表3 N-Cu对荷瘤小鼠体质量的影响(n=15,±s)
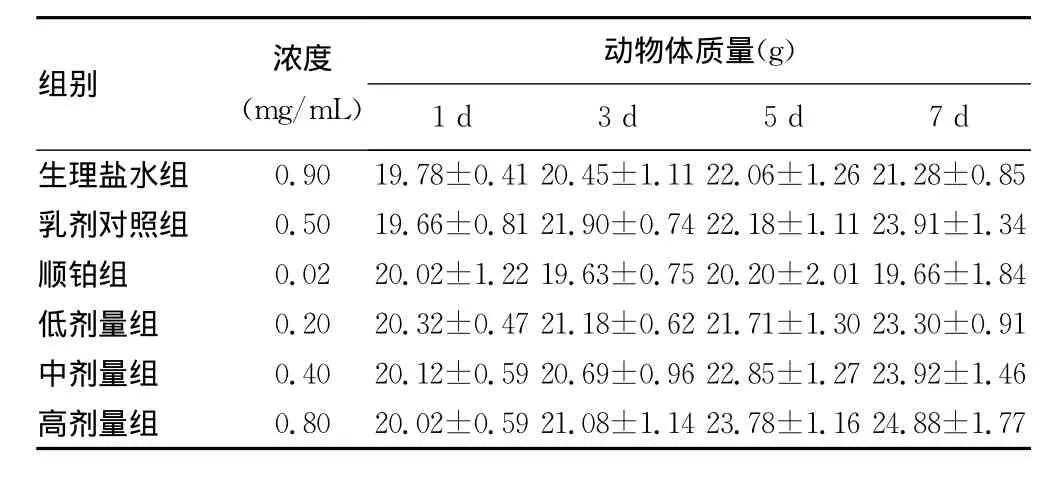
表3 N-Cu对荷瘤小鼠体质量的影响(n=15,±s)
组别 浓度(mg/mL)动物体质量(g)1d 3d 5d 7d生理盐水组 0.90 19.78±0.41 20.45±1.11 22.06±1.26 21.28±0.85乳剂对照组 0.50 19.66±0.81 21.90±0.74 22.18±1.11 23.91±1.34顺铂组 0.02 20.02±1.22 19.63±0.75 20.20±2.01 19.66±1.84低剂量组 0.20 20.32±0.47 21.18±0.62 21.71±1.30 23.30±0.91中剂量组 0.40 20.12±0.59 20.69±0.96 22.85±1.27 23.92±1.46高剂量组 0.80 20.02±0.59 21.08±1.14 23.78±1.16 24.88±1.77
表4 N-Cu对荷瘤小鼠腹水量的影响(n=5,±s)
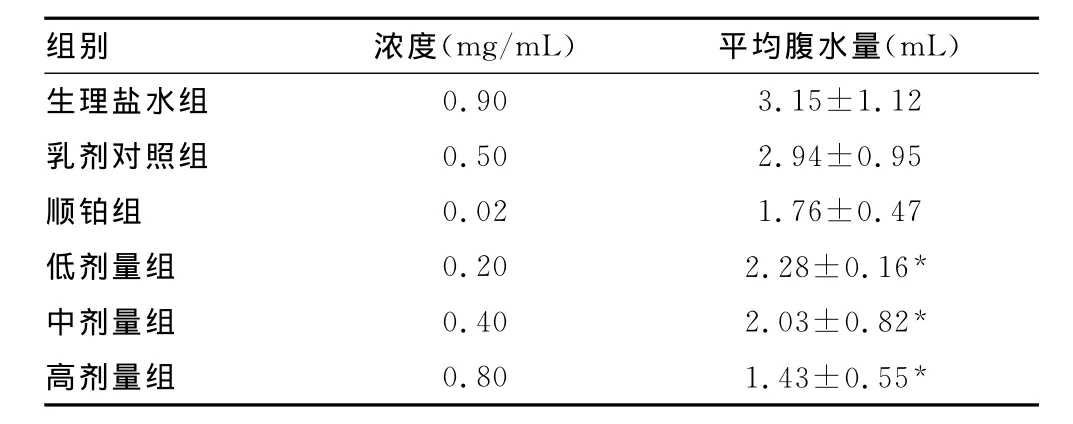
表4 N-Cu对荷瘤小鼠腹水量的影响(n=5,±s)
与生理盐水组相比,*:P0.05。
组别 浓度(mg/mL) 平均腹水量(mL)生理盐水组0.90 3.15±1.12乳剂对照组 0.50 2.94±0.95顺铂组 0.02 1.76±0.47低剂量组 0.20 2.28±0.16*中剂量组 0.40 2.03±0.82*高剂量组 0.80 1.43±0.55*
表5 N-Cu对荷瘤小鼠生命延长率的影响(n=10,±s)

表5 N-Cu对荷瘤小鼠生命延长率的影响(n=10,±s)
注:与生理盐水组相比,*P0.05。
组别 平均存活日期(d) 生命延长率(%)生理盐水组14.2±3.2乳剂对照组 15.4±4.1 8.5±1.78顺铂对照组 21.6±2.9 52.1±0.45低剂量组 16.9±3.6 19.0±1.30*中剂量组 19.2±4.4 35.2±1.85*高剂量组 21.2±3.7 49.3±1.60*
2.3 流式细胞仪检测N-Cu对S180细胞周期的影响 N-Cu能明显抑制S180细胞周期的变化,使G0/G1期细胞明显增多,S期细胞减少,但对S180细胞增殖周期G2/M期细胞作用不明显,其中,高剂量组作用最明显,G0/G1期细胞达到76.1%,中剂量组达到72.3%,差异具有统计学意义(P0.05)。结果见表6和图1。
表6 N-Cu对S180细胞周期的影响(±s,%,n=3)
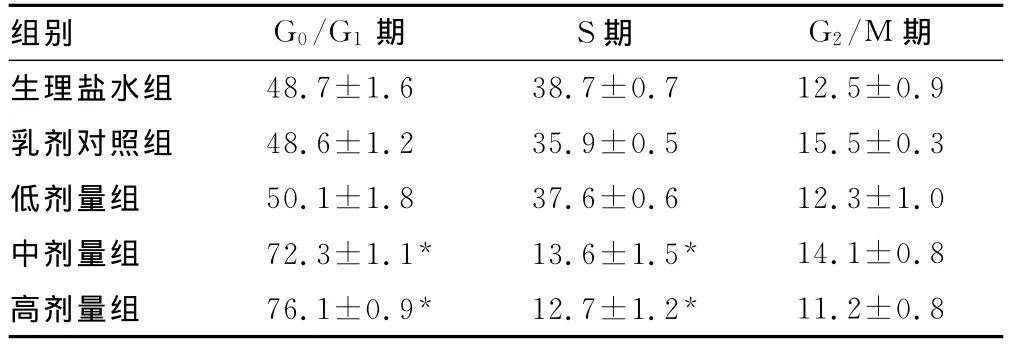
表6 N-Cu对S180细胞周期的影响(±s,%,n=3)
*:P0.05,与生理盐水组相比。
组别 G0/G1期 S期 G2/M期生理盐水组48.7±1.6 38.7±0.7 12.5±0.9乳剂对照组 48.6±1.2 35.9±0.5 15.5±0.3低剂量组 50.1±1.8 37.6±0.6 12.3±1.0中剂量组 72.3±1.1* 13.6±1.5* 14.1±0.8高剂量组 76.1±0.9* 12.7±1.2*11.2±0.8

图1 N-Cu作用S180 24h后的流式细胞周期图
3 讨 论
随着组织培养方法的发展,采用体外培养的癌细胞进行抗癌新药的筛选已成为重要的手段。目前抗肿瘤药物体外筛选的常用实验方法主要有MTT比色分析法、硫化罗丹明法(sulforhodamine B,SRB)法、3H-TdR 掺入法、CCK-8法等[11],其中,MTT比色法快速简便、应用广泛,是目前各实验室最常用的体外筛选方法。本实验 MTT结果表明,N-Cu在体外对4种肿瘤细胞的增殖都有抑制作用,且在5~100μg/mL实验浓度范围内呈剂量依赖性关系,尤其对HeLa细胞的抑制作用最强,增殖抑制率高达91.01%,其IC50值最小;对SGC7901细胞作用的IC50最大,即4种细胞中,对HeLa细胞最为敏感。
动物移植性肿瘤具有成活率高,且可以同时提供大量的肿瘤模型的特点,应用也比较广泛。本组动物实验结果表明,NCu对荷瘤小鼠自身的生长无明显的抑制作用,对肿瘤细胞的生长有明显的抑制作用,与对照组相比,中高剂量组的平均腹水量显著降低,生命延长率明显提高,分别为35.2%和49.3%,说明N-Cu能显著抑制腹水型S180细胞的增殖。
细胞周期(cell cycle)是指连续分裂细胞从一次有丝分裂结束到下一次有丝分裂结束所经历的整个过程[12]。无论是正常组织细胞还是肿瘤细胞,其增殖均与细胞周期密切相关。细胞周期中的G0/G1期和G2/M期在DNA损坏因素的作用下可发生阻滞。肿瘤细胞的特点是细胞周期运行失控和不分化,细胞群体主要处于DNA合成活跃的S期;而分化的细胞群体则主要处于DNA合成静止的G0/G1期[13]。因此,抑制细胞周期的G0/G1期的RNA及核蛋白体的合成,可间接地使肿瘤细胞的RNA合成减少[14]。本实验细胞周期结果表明,N-Cu能明显抑制S180细胞周期的变化,使G0/G1期细胞明显增多,S期细胞减少。其中,高剂量组作用最明显,G0/G1期细胞达到76.1%,中剂量组达到72.3%。
本研究结果表明,N-Cu在体内、外具有明显的抗肿瘤活性,其作用机制及活性成分有待进一步研究。
[1] 司玉昌,王玉祥,郝鹤,等.金属配合物抗癌药物研究新进展[J].武警医学院学报,2006,15(1):64-65.
[2] 徐淑云,卞如濂,陈修.药理实验方法学[M].3版.北京:人民卫生出版社,2001:1761-1762.
[3] 孙振华.豆蔻提取物对人胃腺癌细胞生长影响的体外实验研究[D].扬州:扬州大学硕士学位论文,2007.
[4] 梁世乐,元英进.抗癌药物的筛选及其作用机制的初步研究[J].天津大学学报,2000,10(3):232.
[5] 章静波,黄东阳,方瑾,等.细胞生物学实验技术[M].北京:化学工业出版社,2006:74-75.
[6] 谭卫东,金红,罗第祥,等.抗肿瘤药物筛选中MTT法与SRB法的比较[J].天然产物研究与开发,1999,11(3):17-22.
[7]齐晓宇.新型金属铜络合物的抗肿瘤作用及机制研究[D].郑州:郑州大学硕士学位论文,2009.
[8] 吕峰,王桂华,邓豫,等.穿膜融合多肽TAT-N24对S180腹水瘤生长的抑制作用[J].华中科技大学学报(医学版),2010,39(3):369.
[9] 钟安,卜平,孔桂美,等.半佛纳米微丸对大鼠长期毒性的实验研究[J].中国实验方剂学杂志,2010,16(3):82-85.
[10]Maeda Y,Kimura Y.Antitumor effects of various lowmolecular-weight chitosans are due to increased natural killer activity of inteastinal intraepithelial lymphocytes in sarcoma 180-bearing mice[J].J Nutr,2004,134(4):945-950.
[11]吴慧.抗肿瘤药物体外筛选方法[J].医学理论与实践,2005,18(2):146-147.
[12]Singh SU,Scannell RT,Carter BJ,et.a1.Alteration of the sequence specificity of distamycin on DNA[J].J Am Chem Soc,1995,117(7):12691-12692.
[13]刘秋英,孟庆勇.半叶马尾藻多糖对小鼠S180肉瘤的抑制作用及其机制[J].癌症,2005,24(12):1469-1473.
[14]康敏,唐安洲,梁钢,等.肿节风提取物抑制鼻咽癌细胞增殖的实验研究[J].广西医科大学学报,2008,25(3):347-349.
Study on anti-tumor effect of a new eight-copper complex emulsion in vitro and in vivo*
ObjectiveTo study the anti-tumor effect of a new eight-copper complex emulsion(N-Cu)invitroandinvivo.MethodsThe effect of N-Cu on proliferation of HT29,Hela,SGC7901andEC9706cancer cell lines were evaluated by MTT reduction assay.The in vivo anti-tumor effect was examined in tumor-bearing mice.Cell cycle was determined by flow cytometry.ResultsNCu significantly inhibited the proliferation of the four tumor cell lines after 24h.With increasing drug concentration,the inhibition was significantly enhanced.TheResultsin vivo showed that N-Cu had better anti-tumor effects.N-Cu by flow cytometry showed that N-Cu with anti-S180cell proliferation,an increase in G0/G1phase and decrease in S phase.Cells were arrested in G0/G1phase.The difference was statistically significant(P0.05).ConclusionN-Cu possesses the anti-tumor effectinvivoandinvitro.
antineoplastic agents;cell cycle;tumor cells,cultured;mice;nanoporous octanuclear Cu(Ⅱ)
10.3969/j.issn.1671-8348.2012.16.003
A
1671-8348(2012)16-1567-03
* 基金项目:河南省高校科技创新人才项目(2010HASTIT016)。
2011-10-11
2011-12-23)
•综 述•

