多囊卵巢综合征患者血清游离脂肪酸水平测定及其相关因素分析
宋 颖,李启富,田 波,钟 立,杨淑敏,夏 伟,毕小云
(重庆医科大学附属第一医院1.内分泌科;2.检验科 400016)
多囊卵巢综合征患者血清游离脂肪酸水平测定及其相关因素分析
宋 颖1,李启富1,田 波1,钟 立1,杨淑敏1,夏 伟1,毕小云2△
(重庆医科大学附属第一医院1.内分泌科;2.检验科 400016)
目的分析多囊卵巢综合征(PCOS)患者血清游离脂肪酸(FFAs)水平的变化,并探讨其相关因素。方法 纳入133例PCOS患者及116例年龄匹配的健康女性,测量身高、体质量、腰围;行75g无水葡萄糖耐量试验,并测空腹血清血脂、空腹胰岛素(FINS)、血清FFAs、总睾酮,计算胰岛素抵抗指数(HOMA-IR);对101例PCOS患者及20例正常人行高胰岛素-正葡萄糖钳夹术。结果PCOS患者血清FFAs水平明显高于对照组(P0.01);亚组分析显示,与两个体质量匹配的对照组相比,PCOS患者的FFAs水平也明显增高(P0.01)。相关分析显示,FFAs水平与体质量指数(BMI)、腰围、总胆固醇(TC)、低密度脂蛋白胆固醇(LDL-c)、总睾酮(r分别为0.20、0.18、0.19、0.18、0.18,P0.05)呈正相关;与高密度脂蛋白胆固醇(HDL-c)、稳态期120~180min葡萄糖代谢率(M120-180)(r分别为-0.17、-0.22,P0.05)呈负相关。结论与年龄匹配的健康妇女相比,PCOS患者血清FFAs水平显著升高,且与BMI、腰围、TC、LDL-c、总睾酮水平呈正相关,与 HDL-c、M120-180呈负相关。
多囊卵巢综合征;游离脂肪酸;胰岛素抵抗
多囊卵巢综合征(polycystic ovary syndrome,PCOS)是一种育龄期妇女常见的生殖内分泌紊乱疾病,PCOS患者肥胖、糖脂代谢异常的发生率均较正常人显著增高。目前,已证实2型糖尿病和肥胖患者体内常有血清游离脂肪酸(free fatty acids,FFAs)水平的增高,并且FFAs与胰岛素抵抗(insulin resistance,IR)呈正相关[1]。虽然已有研究表明,PCOS患者也存在血清FFAs水平的增高及IR[2-3],但目前对此类人群的研究不多,且缺乏大样本量及年龄匹配的对照组的研究。本研究旨在进一步分析PCOS患者空腹血清FFAs水平的变化,并探讨其相关因素,从而为进一步探讨PCOS发生、发展的机制提供重要的理论依据。
1 资料与方法
1.1 一般资料 纳入重庆地区2007年11月至2010年1月就诊于本院妇科及内分泌科的133例PCOS患者及116例年龄匹配的健康妇女作为对照。受试者均无糖尿病史,未怀孕,绝经前或最近至少3个月未服用过降糖药和激素类药物。PCOS的诊断标准参照欧洲人类生殖与胚胎学会和美国生殖医学学会在鹿特丹会议上推荐的标准[4],并排除其他引起高雄激素、排卵障碍的内分泌疾病,如先天性肾上腺增生、库欣综合征、分泌雄激素的肿瘤、高催乳素血症、甲状腺疾病等。本研究得到重庆医科大学伦理委员会的认可,所有调查均取得受试对象的知情同意。
1.2 研究方法
1.2.1 病史采集及人体学测量 采用统一制定的健康信息调查表,由专人对受试者进行病史询问及体格检查,身体测量包括:身高、体质量、腰围;按照体质量/身高(kg/m2)计算体质量指数(body mass index,BMI)。
1.2.2 实验室检查 (1)所有受试者于月经第5~8天(闭经者不限时间)禁食8~12h,次日清晨空腹抽肘静脉血后行口服75g无水葡萄糖耐量试验(oral glucose tolerance test,OG-TT),并测定空腹胰岛素(fasting insulin,FINS)、血清FFAs、总睾酮、总胆固醇(total cholesterol,TC)、三酰甘油(triacylglycerol,TG)、高密度脂蛋白胆固醇(high density lipoprotein cholestorol,HDL-c)、低密度脂蛋白胆固醇(low density lipoprotein cholestorol,LDL-c);另择日对其中101例PCOS患者及20例正常人行高胰岛素-正葡萄糖钳夹术[5],以稳态期120~180 min葡萄糖代谢率(M120-180)评估胰岛素敏感性。(2)血浆葡萄糖测定采用己糖激酶法(迈瑞BS-200全自动生化分析仪),试剂盒由中生北控生物科技股份有限公司提供;空腹胰岛素和总睾酮测定采用电化学发光法,试剂盒由德国罗氏诊断有限公司提供;血脂测定采用OLYMPUS AU5400型全自动生化检测仪,试剂由日本和光纯药工业株式会社提供;血清FFAs测定采用酶法测定,试剂由日本积水药疗株式会社提供。
1.2.3 评价标准 (1)超重、肥胖的诊断参照《中国成人超重和肥胖症预防控制指南》[6],24.0kg/m2≤BMI28.0kg/m2为超重,BMI≥28.0kg/m2为肥胖;中心性肥胖:女性腰围不低于80cm。(2)IR的诊断参照1999年 WHO的标准[7]以正常对照组钳夹术中M120-180下四分位数为切点将PCOS组分为IR组(M120-18010.76mg•min-1•kg-1,n=80)和非IR组(M120-180≥10.76mg•min-1•kg-1,n=21)。(3)采用稳态模型计算胰岛素抵抗指数(homeostasis model assessment-IR,HOMA-IR)评价胰岛素抵抗:HOMA-IR=FINS×空腹血糖(fasting plasma glucose,FPG)/22.5[8-9]。
1.3 统计学处理 使用SPSS13.0统计软件进行分析。计量资料以±s表示,偏态分布的变量[TG、FPG、餐后2小时血糖(2-hour postprandial blood glucose,2hPG)、FINS、HOMAIR]经对数转换后呈正态分布再进行分析。两组间均数比较采用t检验;多组均数之间的两两比较采用方差分析。以PCOS组的FFAs为应变量,以其他因素为自变量行Pearson相关分析。P0.05为差异有统计学意义。
2 结 果
2.1 一般情况 两组研究对象年龄差异无统计学意义(P0.05),与对照组相比,PCOS组有更高的 BMI、腰围、FPG、2hPG、FINS、HOMA-IR、总睾酮、FFAs、TG和更低的 HDL-c、M120-180(P0.05或P0.01),而TC、LDL-c在两组间的差异无统计学意义(P0.05),见表1。
表1 PCOS组与对照组一般情况及生化指标的比较(±s)
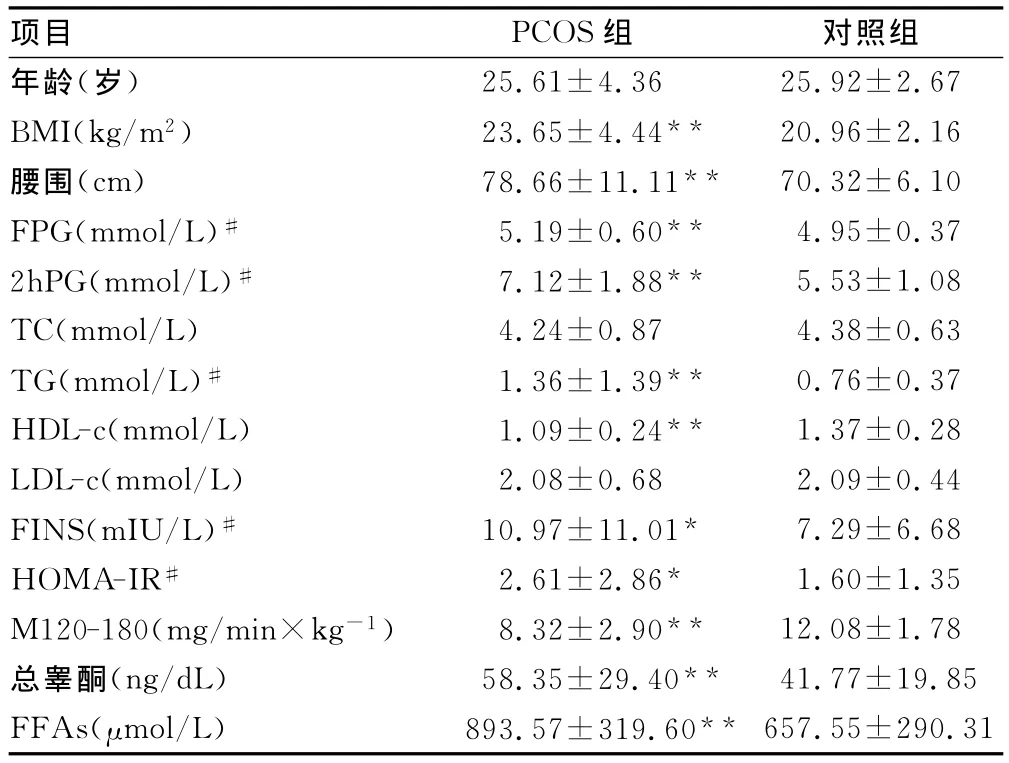
表1 PCOS组与对照组一般情况及生化指标的比较(±s)
#:经对数转换后进行统计分析;*:P0.05,**:P 0.01,与对照组比较。
项目 PCOS组25.61±4.36 25.92±2.67 BMI(kg/m2) 23.65±4.44** 20.96±2.16腰围(cm) 78.66±11.11** 70.32±6.10 FPG(mmol/L)# 5.19±0.60** 4.95±0.37 2hPG(mmol/L)# 7.12±1.88** 5.53±1.08 TC(mmol/L) 4.24±0.87 4.38±0.63 TG(mmol/L)# 1.36±1.39** 0.76±0.37 HDL-c(mmol/L) 1.09±0.24** 1.37±0.28 LDL-c(mmol/L) 2.08±0.68 2.09±0.44 FINS(mIU/L)# 10.97±11.01* 7.29±6.68 HOMA-IR# 2.61±2.86* 1.60±1.35 M120-180(mg/min×kg-1) 8.32±2.90** 12.08±1.78总睾酮(ng/dL) 58.35±29.40** 41.77±19.85 FFAs(μmol/L) 893.57±319.60**对照组年龄(岁)657.55±290.31
2.2 亚组间血清FFAs水平比较 按BMI是否超过了24.0kg/m2重新分组。PCOS组分为正常体质量的PCOS组(n=76)和超重/肥胖的PCOS组(n=57);对照组分为正常体质量的对照组(n=108)和超重/肥胖的对照组(n=8)。四个亚组中血清FFAs水平的比较见表2。
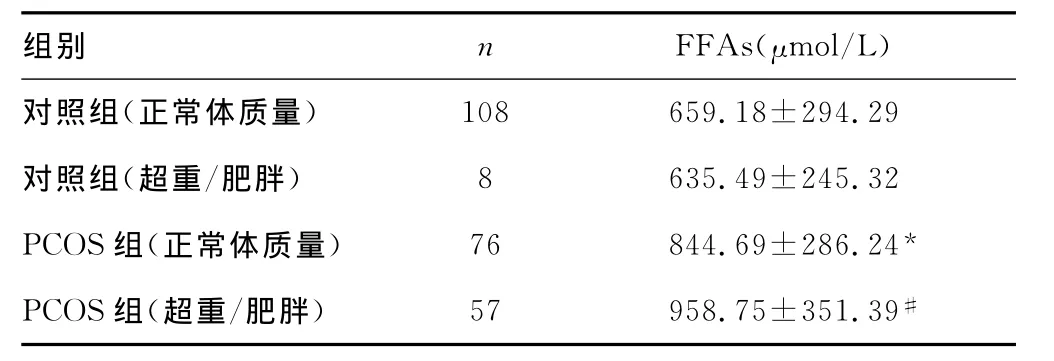
表2 四个亚组间血清FFAs水平的比较
2.3 PCOS的两个亚组血清FFAs水平的比较 两组均高于体质量匹配的对照组(P0.01),但FFAs在PCOS的两个亚组间比较,P0.05。以正常对照组钳夹术中 M120-180下四分位数为切点将PCOS组分为IR组(M120-18010.76mg•min-1•kg-1,n=80,79.2%)和非IR 组(M120-180≥10.76 mg•min-1•kg-1,n=21,20.8%)。PCOS两个亚组间血清FFAs水平的比较见表3。PCOS患者的IR组较非IR组有更高的BMI和FFAs浓度。

表3 PCOS患者的两个亚组间血清FFAs水平的比较
2.4 血清FFAs水平相关因素分析 以PCOS患者的FFAs水平为应变量,Pearson相关分析显示,FFAs水平与BMI、腰围、TC、LDL-c、总睾酮(r分别为0.20、0.18、0.19、0.18、0.18、0.05)呈 正 相 关;与 HDL-c、M120-180(r分 别 为 -0.17、-0.22,P0.05)呈负相关;与年龄、FPG、2hPG、FINS、TG、HOMA-IR(r分别 为 0.01、0.09、0.16、0.14、0.13、0.12,P0.05)无相关性。
3 讨 论
本研究显示,PCOS患者血清FFAs水平明显高于对照组(P0.01),与体质量匹配的对照组相比,超重/肥胖的PCOS患者FFAs水平明显增高(P0.01),PCOS患者的IR组较非IR组也有更高的FFAs浓度;相关分析提示PCOS患者的FFAs水平分别与BMI、腰围、TC、LDL-c、总睾酮呈正相关,与HDL-c、M120-180呈负相关。
Holte等[10]研究发现,PCOS患者较之体质量匹配的正常妇女有更高的血清FFAs水平,本研究结果与之一致。而肥胖的PCOS患者减轻体质量后血清FFAs水平和胰岛素敏感性都有一定程度的改善,部分可恢复排卵[11],具体机制尚不清楚。另外,肥胖与PCOS患者的IR及糖尿病的发生相关,且独立于糖尿病家族史[12]。本研究中,超重/肥胖的PCOS组患者血清FFAs水平高于体质量正常的PCOS组,且PCOS患者血清FFAs水平与BMI、腰围呈正相关,提示肥胖,特别是中心性肥胖的PCOS患者,其腹部脂肪堆积程度与血清FFAs浓度之间存在一定的相关性。
报道显示,中国南部的PCOS患者中大约46.9%发生IR[13]。高水平的血清FFAs分别与PCOS患者的IR[2]及2型糖尿病的发生有关[14],且胰岛素增敏剂对PCOS患者IR的治疗有效[15-16]。本研究PCOS患者中IR的发生概率为79.2%,明显高于之前报道;且IR组与非IR组相比,前者血清FFAs水平明显高于后者,虽然差异无统计学意义,但相关分析得出血清FFAs水平与M120-180呈负相关。目前对于PCOS患者血清FFAs水平的升高与IR的发生机制尚不明确。有研究认为[17-20]激素敏感性脂肪酶和脂蛋白脂酶之间的失调及抗脂解作用减弱,是IR时FFAs升高的重要原因,但对于PCOS患者来说,仅FFAs单一因素并不能解释IR的发生[21-22]。
另外,研究发现[23],存在IR的PCOS患者,因白细胞与内皮细胞的相互作用,损害内皮及线粒体氧化功能。而FFAs同时也是导致氧化应激的物质之一,受高水平的FFAs刺激,活性氧簇生成增多,氧耗降低。因此,存在高FFAs水平的PCOS患者,炎症反应更明显,心血管疾病的发生风险将会更高。
进一步研究发现,短期高水平的FFAs可通过增强肝脏硫酸转移酶的活性致正常体内高雄激素血症[24-25]。而且,胰岛素增敏剂可改善PCOS患者高雄激素的临床特征[26]。Reed等[27]研究发现,居住在伦敦西北部的亚洲妇女其血清FFAs水平与睾酮水平呈正相关。另外,年轻的PCOS患者中,随着雄激素水平的增高,其患代谢综合征的风险增加,且这种作用独立于肥胖及IR[28]。本研究也得到了类似的结果,提示血清FFAs水平增高可能是PCOS发病的重要机制之一[22]。此外,对高加索人[29]、印度人[30]的研究表明,血清高FFAs水平均为糖调节受损,向糖尿病进展的一个独立危险因素。本研究尚未得到FFAs与血糖的相关性,可能与研究对象的年龄及PCOS的病程有关。另外,本研究仅为横断面研究,关于FFAs与糖尿病发生的关系,还需要进行长期随访观察。
综上所述,与年龄匹配的健康妇女相比,PCOS患者血清FFAs水平显著升高,并且与肥胖、血脂异常、高雄激素、IR等因素相关。因此,降低PCOS患者空腹血清FFAs的水平,可能会有助于PCOS相关疾病的改善及远期并发症的预防,成为治疗PCOS的一个新思路[31]。
[1] 罗四川,李启富,刘红梅.清醒状态大鼠高胰岛素-正常血糖钳夹术的建立及其意义[J].重庆医科大学学报,2004,29(3):334-336.
[2] Macut D,Panidis D,Glisic B,et al.Lipid and lipoprotein profile in women with polycystic ovary syndrome[J].Can J Physiol Pharmacol,2008,86(4):199-204.
[3] Wu Y,Zhang J,Wen Y,et al.Increased acylation-stimulating protein,C-reactive protein,and lipid levels in young women with polycystic ovary syndrome[J].Fertil Steril,2009,91(1):213-319.
[4] Kousta E,Tolis G,Franks S.Polycystic ovary syndrome.Revised diagnostic criteria and long-term health consequences[J].Hormones(Athens),2005,4(3):133-147.
[5] 汪志红,李启富,张素华,等.高胰岛素-正葡萄糖钳夹技术的建立[J].重庆医科大学学报,2004,29(5):615-617.
[6] 中国肥胖问题工作组.中国成人超重和肥胖症预防与控制指南(节录)[J].营养学报,2004,26(1):1-4.
[7] Alberti KG,Zimmet PZ.Definition,diagnosis and classification of diabetes mellitus and its complications.Part 1:diagnosis and classification of diabetes mellitus provisional report of a WHO consultation[J].Diabet Med,1998,15(7):539-553.
[8] Matthews DR,Hosker JP,Rudenski AS,et al.Homeostasis model assessment:insulin resistance and beta-cell function from fasting plasma glucose and insulin concentrations in man[J].Diabetologia,1985,28(7):412-419.
[9] Yajnik CS,Joglekar CV,Lubree HG,et al.Adiposity,inflammation and hyperglycaemia in rural and urban Indian men:Coronary Risk of Insulin Sensitivity in Indian Subjects(CRISIS)Study[J].Diabetologia,2008,51(1):39-46.
[10]Holte J,Bergh T,Berne C.Restored insulin sensitivity but persistently increased early insulin secretion after weight loss in obese women with polycystic ovary syndrome[J].J Clin Endocrinol Metab,1995,80(9):2586-2593.
[11]Kuchenbecker WK,Groen H,van Asselt SJ,et al.In women with polycystic ovary syndrome and obesity,loss of intra-abdominal fat is associated with resumption of ovulation[J].Hum Reprod,2011,26(9):2505-2512.
[12]Kuba VM,Cavalieri PM,Christóforo AC,et al.Insulin resistance and metabolic profile in lean and overweight/obese polycystic ovary syndrome patients[J].Arg Bras Endocrinol Metabol,2006,50(5):1026-1033.
[13]Huang J,Ni R,Chen X,et al.Metabolic abnormalities in adolescents with polycystic ovary syndrome in South China[J].Reprod Biol Endocrinol,2010,8(1):142.
[14]Pankow JS,Duncan BB,Schmidit MI,et al.Fasting plasma free fatty acids and risk of type 2diabetes:the atherosclerosis risk in communities study[J].Diabetes Care,2004,27(1):77-82.
[15]Galindo García CG,Vega Arias Mde J,Hernández Marín I,et al.Mechanism of action of insulin sensitizer agents in the treatment of polycystic ovarian syndrome[J].Ginecol Obstet Mex,2007,75(3):148-154.
[16]Teede HJ,Meyer C,Norman RJ.Insulin-sensitisers in the treatment of polycystic ovary syndrome[J].Expert Opin Pharmacother,2005,6(14):2419-2427.
[17]Haemmerle G,Zimmermann R,Hayn H,et al.Hormonesensitive lipase deficiency in mice causes diglyeride accumulation in adipose tissue,muscle,and testis[J].J Biol Chem,2002,77(7):4806-4815.
[18]Mlinar B,Pfeifer M,Vrtacnik-Bokal E,et al.Decreased lipin 1beta expression in visceral adipose tissue is associated with insulin resistance in polycystic ovary syndrome[J].Eur J Endocrinol,2008,159(6):833-839.
[19]Seow KM,Tsai YL,Hwang JL,et al.Omental adipose tissue overexpression of fatty acid transporter CD36and decreased expression of hormone-sensitive lipase in insulin-resistant women with polycystic ovary syndrome[J].Hum Reprod,2009,24(8):1982-1988.
[20]Rydén M,Jocken J,van Harmelen V,et al.Comparative studies of the role of hormone-sensitive lipase and adipose triglyceride lipase in human fat cell lipolysis[J].Am J Physiol Endocrinol Metab,2007,292(6):E1847-E1855.
[21]Morin-Papunen LC,Vauhkonen I,Koivunen RM,et al.Insulin sensitivity,insulin secretion,and metabolic and hormonal parameters in healthy women and women with polycystic ovarian syndrome[J].Hum Reprod,2000,15(6):1266-1274.
[22]Ciampelli M,Muzj G,Leoni F,et al.Metabolic and endocrine consequences of acute suppression of FFAs by acipimox in polycystic ovary syndrome[J].J Clin Endocrinol Metab,2001,86(11):5324-5329.
[23]Victor VM,Rocha M,Bañuls C,et al.Induction of oxidative stress and human leukocyte/endothelial cell interactions in polycystic ovary syndrome patients with insulin resistance[J].J Clin Endocrinol Metab,2011,96(10):3115-3122.
[24]Mai K,Bobbert T,Kullmann V,et al.Free fatty acids increase androgen precursors in vivo[J].J Clin Endocrinol Metab,2006,91(4):1501-1507.
[25]Mai K,Bobbert T,Reinecke F,et al.Intravenous lipid and heparin infusion-induced elevation in free fatty acids and triglycerides modifies circulating androgen levels in women:a randomized,controlled trial[J].J Clin Endocrinol Metab,2008,93(10):3900-3906.
[26]Azziz R,Ehrmann D,Legro RS,et al.Troglitazone improves ovulation and hirsutism in the polycystic ovary syndrome:a multicenter,double blind,lacebo-ontrolled trial[J].J Clin Endocrinol Metab,2001,86(4):1626-1632.
[27]Reed MJ,Dunkley SA,Singh A,et al.The role of free fatty acids in regulating the tissue availability and synthesis of sex steroids[J].Prostaglandins Leukot Essent Fatty Acids,1993,48(1):111-116.
[28]Coviello AD,Legro RS,Dunaif A.Adolescent girls with polycystic ovary syndrome have an increased risk of themetabolic syndrome associated with increasing androgen levels independent of obesity and insulin resistance[J].J Clin Endocrinol Metab,2006,91(2):492-497.
[29]Charles MA,Eschwège E,Thibult N,et al.The role of non-esterified fatty acids in the deterioration of glucose tolerence in the Caucasian subjects:Resultsof the Paris Prospective Study[J].Diabetologia,1997,40(9):1101-1106.
[30]Stefan N,Stumvoll M,Bogardus C,et al.Elevated plasma nonesterified fatty acids are associated with deterioration of acute insulin response in IGT but not NGT[J].Am J Physiol Endocrinol Metab,2003,284(6):E1156-E1161.
[31]Douglas CC,Gower BA,Darnell BE,et al.Role of diet in the treatment of polycystic ovary syndrome[J].Fertil Steril,2006,85(3):679-688.
Concentration of serum free fatty acids and its correlation analyses in patients with polycystic ovarian syndrome
ObjectiveTo measure the concentration of free fatty acids(FFAs)and to analyze its associations with correlative factors in the patients with polycystic ovarian syndrome(PCOS).Methods133PCOS women and 116healthy,age-matched controls were recruited.Physical examination and laboratory analysis were performed.All subjects underwent a standard 75-g oral glucose tolerance test.101PCOS women and 20controls underwent hyperinsulinemic euglycemic clamp to assess their insulin sensitivity.IR was also estimated by homeostasis model assessment of insulin resistance(HOMA-IR).ResultsThe levels of serum FFAs in PCOS women were significantly higher as compared with controls(P0.01).Subgroup analysis showed that the levels of serum FFAs in two PCOS subgroups were significantly higher as compared with the two weight-matched control subgroups(P0.01).Correlation analyses showed that in all subjects,FFAs positively correlated with BMI,waist circumference,total cholesterol(TC),LDL-c and total testosterone(r=0.20,r=0.18,r=0.19,r=0.18,r=0.18,P0.05)and negatively correlated with HDL-c and M120-180value(r=-0.17,r=-0.22,P0.05).ConclusionComparing with age-matched healthy women,the levels of serum FFAs in PCOS women are elevated evidently and positively correlated with BMI,waist circumference,TC,LDL-c and total testosterone,negatively correlated with HDL-c and M120-180value.
polycystic ovary syndrome;free fatty acids;insulin resistance
10.3969/j.issn.1671-8348.2012.16.009
A
1671-8348(2012)16-1585-04
△通讯作者,E-mail:bxy20061963@163.com。
2011-10-19
2011-11-22)
•综 述•

