延髓缺血对其微血管密度、神经元及神经胶质细胞的影响
朱 江, 郭 森, 孙艳军, 冯亚茹, 来 锦
随着全球人口老龄化的到来,脑血管病特别是缺血性脑卒中发病率日益增高。临床常见的缺血性脑血管病[1,2],都是由颈内动脉系统或椎-基底动脉系统的某一分支病变引起的。其中,椎-基底动脉系统缺血性疾病占缺血性脑卒中的 20%[3,4]。延髓(medulla oblongata)是人类的生命中枢,含有大量神经元,神经元周围有神经胶质细胞填充。正常生理情况下,神经元、胶质细胞和毛细血管紧密结合在一起,星形胶质细胞突起伸展填充在神经元胞体及其突触之间[5]。在后循环缺血过程中延髓内微血管及神经元、神经胶质细胞的病理改变尤其值得关注。本研究通过阻断大鼠相应血管模拟后循环缺血后的病理过程,建立延髓缺血模型,应用单宁酸-氯化铁媒染法[6~8]、HE染色等方法观察缺血后不同时段延髓内微血管、神经元和神经胶质细胞的改变,为后循环缺血[9]的诊断治疗提供形态学资料。
1 材料和方法
1.1 材料 SPF级Wistar成年健康雄性大鼠,200~220g(由河北医科大学实验动物中心提供)。10%多聚甲醛固定液、0.1mol PB溶液、单宁酸(tannic acid)、氯化铁(FeCl3)、苏木精、伊红、10% 水合氯醛、青霉素、高频电刀、显微手术器械、分析天平、冰冻切片机、光学显微镜、显微镜及摄像装置。
1.2 实验方法
1.2.1 实验动物分组 48只大鼠随机分为4组:即实验组(1w组、2w组、3w组)和对照组,每组12只。其中实验组大鼠阻断双侧椎动脉及右侧颈总动脉。存活时间分别是1w、2w、3w。对照组只暴露双侧椎动脉及右侧颈总动脉,不做血管阻断处理。
1.2.2 延髓缺血模型制备 结扎右侧颈总动脉:10%水合氯醛腹腔注射麻醉(350mg/kg),仰卧固定,颈部正中切口,钝性分离胸锁乳突肌,暴露右侧颈总动脉并结扎切断,检查无活动性出血后,用生理盐水和青霉素(1×105U/L)冲洗后缝合伤口。电凝椎动脉:大鼠俯卧固定,于后正中线第一颈椎水平处作纵形切口,沿中线分开肌层,暴露第一颈椎横突孔,将高频电刀的电凝刀头插入横突孔内凝闭椎动脉3~4s,检查无活动性出血后,用生理盐水和青霉素(1×105U/L)冲洗后缝合伤口。待清醒后,单笼保温喂养。
1.2.3 HE染色标本制作、单宁酸-氯化铁染色标本制作 按文献[10]方法取出延髓标本,进行HE染色标本制作。按文献方法[6]制作单宁酸-氯化铁染色标本。
1.2.4 神经元、神经胶质细胞计数及微血管密度定量分析方法 每只大鼠取4张切片,每张切片在200倍光镜下随机选取5个视野,输入医学显微图像分析系统(MiVnt)进行图像处理,计数神经元、神经胶质细胞,取其平均值为这只大鼠的神经元、神经胶质细胞的细胞数。每只大鼠取3张切片,采用Mivnt图像分析系统定量分析延髓微血管密度(microvessel density,MVD)和微血管面积比(microvessel aera density,MVA)。每张切片在100倍光镜下选5个视野,分别计算MVD值和MVA值,取平均值作为该只大鼠延髓微血管的MVD值和MVA值。
1.2.5 统计学处理 用 S PSS13.0统计软件包处理,数据用均数±标准差(±s)表示,组间比较采用单因素方差分析,P<0.05有统计学意义。
2 结果
2.1 延髓缺血动物模型的建立 电凝双侧椎动脉并结扎右侧颈总动脉,建立了延髓缺血模型。
2.2 延髓缺血模型脑组织大体标本观察 雄性Wistar大鼠共48只,其中观察实验组36只,对照组12只动物。在大体标本上可见,第一周大脑横裂较对照组略显增宽,双侧大脑半球基本对称。第2周大脑横裂较第1周的略有增宽,右侧大脑半球较左侧略萎缩,小脑可见萎缩。第3周大脑横裂显著增宽,小脑萎缩明显,双侧大脑半球不对称,右侧萎缩明显。取材时可见,脑组织与颅骨之间空隙增宽,第四脑室略有扩大。本次试验采取阻断双侧椎动脉并结扎右侧颈内动脉法进行相应的比较,大体标本实验动物延髓处可见明显缺血表现,实验各组的缺血部位较对照组明显萎缩(见图1、2、3、4)。
2.3 延髓缺血模型微血管密度(MVD)、微血管面积比(MVA)变化 通过对实验各组1w、2w、3w的观察,延髓微血管密度(MVD)增加(47.28 ±8.67,61.92 ±11.37,78.33 ±14.62),与对照组(104.16 ±15.63)相比较P<0.05,P<0.01;微血管面积比(MVA)增大(0.0246 ±0.0048,0.0366 ±0.0098,0.0399 ±0.0131),与对照组(0.0614±0.0018)比较P<0.05或P<0.01,二者均有明显的统计学差异(见表1、2)。
2.4 延髓缺血对神经元的影响 实验组中,通过对1w、2w、3w后试验动物的观察,神经元数量减少(4.35 ±2.61,4.32 ±1.83,3.91 ±0.78),与对照组(8.60 ±2.82)相比较(P<0.05),统计学差异明显(见表3)。
2.5 延髓缺血对神经胶质细胞的影响 实验各组神经胶质细胞数量增加(21.25 ±4.56,29.56 ±3.65,48.36 ±5.32),与对照组(15.34 ±2.56)相比较P<0.05或P<0.01,有非常显著的差异(见表4)。
2.6 组织学观察
2.6.1 对照组:微血管、神经元、神经胶质细胞形态基本正常,细胞膜完整,核膜、核仁清晰,尼氏体丰富。
表1 各组MVD值变化情况(±s)
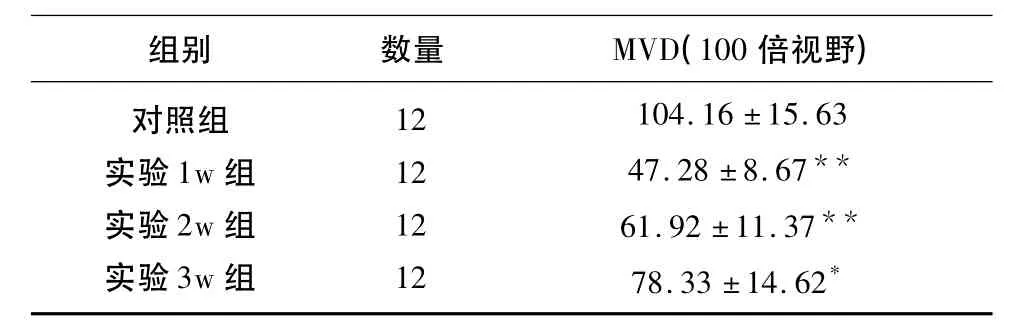
表1 各组MVD值变化情况(±s)
与对照组组内比较*P <0.05,**P <0.0
组别 数量 MVD(100倍视野)对照组实验1w组实验2w组实验3w组12 12 12 12 104.16 ±15.63 47.28 ±8.67**61.92 ±11.37**78.33 ±14.62*
表2 各组MVA值变化情况(±s)
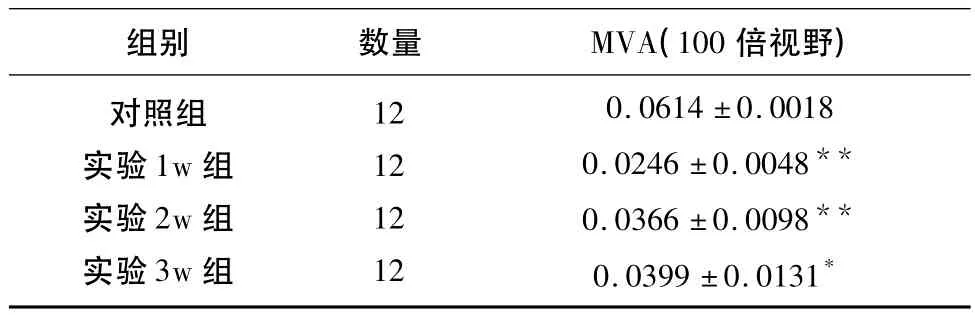
表2 各组MVA值变化情况(±s)
与对照组组内比较*P <0.05,**P <0.01
组别 数量 MVA(100倍视野)对照组实验1w组实验2w组实验3w组12 12 12 12 0.0614 ±0.0018 0.0246 ±0.0048**0.0366 ±0.0098**0.0399 ±0.0131*
2.6.2 实验组:(1)1w组微血管闭塞,数量减少,血管内皮细胞肿胀,膜结构不清,甚至断裂。神经元数量减少,核固缩、碎裂、溶解,细胞器溶解消失。神经胶质细胞数量增加,细胞排列紧密,细胞核较大,有明显核仁。(2)2w组神经元较1w组数量略减少,神经元溶解消失。神经胶质细胞增加明显,坏死区域内可见大量神经胶质细胞填充,细胞较大,核较小,颜色较浅。(3)3w组微血管量增加,内皮细胞正常,神经元数量减少,坏死性病灶内神经元破碎,甚至完全消失。神经胶质细胞数量明显增多,仍处于增殖状态,在一些受损的神经元周围出现的神经胶质细胞,细胞核深染,排列较杂乱((见图5~图12)。
表3 神经元数量(±s)
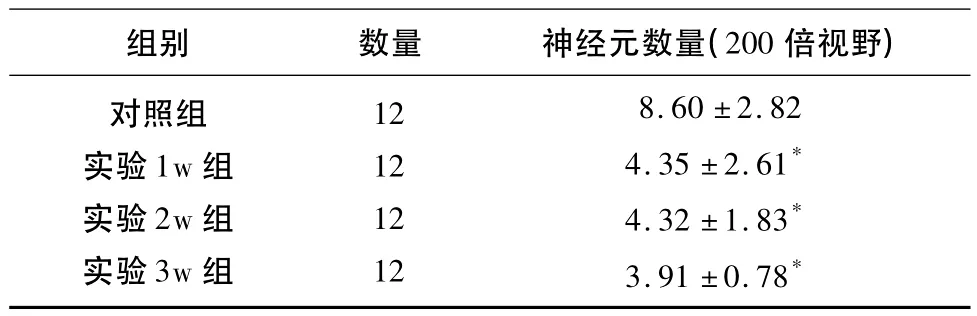
表3 神经元数量(±s)
与对照组组内比较*P<0.05
组别 数量 神经元数量(200倍视野)对照组实验1w组实验2w组实验3w组12 12 12 12 8.60 ±2.82 4.35 ±2.61*4.32 ±1.83*3.91 ±0.78*
表4 神经胶质细胞数量(±s)

表4 神经胶质细胞数量(±s)
与对照组组内比较*P <0.05,**P <0.01
组别 数量 神经胶质细胞数量(200倍视野)对照组实验1w组实验2w组实验3w组12 12 12 12 15.34 ±2.56 21.25 ±4.56*29.56 ±3.65**48.36 ±5.32**
3 讨论
脑干的血液供应复杂,大部分的血供来源于椎-基底动脉系统。以往的研究,应用阻断基底动脉的方法建立脑干缺血的实验模型。Miura等[11,12]应用双点电凝基底动脉建立脑干缺血模型。上述实验,术中需开颅,术式复杂。同时考虑直接阻断基底动脉,实验动物会瞬间出现意识障碍、抽搐、呼吸浅快等表现,存活率较低。本实验考虑,大鼠双侧椎动脉延伸汇成基底动脉,试用电凝双侧椎动脉的方法建立延髓缺血模型。但通过预实验发现,延髓缺血病灶不固定。考虑这与大鼠脑动脉环完整、相应的血流代偿机制完善有关。
参考以上实验方法,本研究尝试多点阻断脑动脉法即同时阻断双侧椎动脉及右侧颈总动脉,建立延髓缺血模型。上述方法对实验动物的条件要求单一,术式易操作。电凝双侧椎动脉,不需开颅,操作简单安全,能较确切的对血管进行阻断。直接结扎右侧颈总动脉,不应用线栓法,可避免血管穿通出现的继发蛛网膜下腔出血等副损伤。实验证明,在大体标本上不经任何染色就可清晰直观的看出脑组织的萎缩。微血管构筑、神经元、神经胶质细胞也发生明显的形态学改变。因此,该模型具有缺血部位固定、重复性较好、成活率较高的优点。
脑梗死后新生微血管增生的机制还不十分明确。利用微血管特定的标记物质,如CD31等标记新生微血管观察发现[13,14],在脑梗死后1w可见相关阳性标记物出现,在随后的2w、3w内新生微血管的密度不断增加。特别是在脑梗死后的第2周,新生微血管标记物阳性率最高。在形态学方面,不论是通过普通光学显微镜、还是应用激光共聚焦三维重建等技术,都可以发现在脑梗死1w时,会出现部分微血管闭塞,甚至可以看见微血管内皮细胞的断裂等现象,但在随后的2w、3w微血管形态学较对照组未见明显变化[15]。本实验结果与之有相似之处,通过微血管密度、微血管面积比可证实,缺血2~3w血管明显增多,增多的血管可能是新生的血管,今后的实验可通过相应的标记加以证实。笔者认为,在了解新生微血管随脑梗死的时间变化规律基础上,对微血管总体密度的统计,更加直观的反映出脑梗死对微血管的影响。经试验研究显示,延髓缺血后1w,微血管密度减低;2w时微血管的密度明显升高,较对照组少;3w时微血管密度进一步升高,仍少于对照组。
作为脑组织细胞中重要组成部分,神经胶质细胞发挥着重要的作用,如清除自由基、为突触再生提供稳定的离子状态、提供生长因子等。本研究提示,延髓缺血后神经胶质细胞总体处于增殖状态。1w时神经胶质增殖,数量较对照组增加,神经胶质细胞之间排列紧密,细胞核较大而致密,有的病灶中心可见神经胶质细胞充斥。2w时表现为神经胶质细胞在数量上仍保持增加的趋势,可见在神经元周围的神经胶质细胞,排列较整齐,胶质细胞的细胞核深染,细胞核较小,颜色致密。3w时神经胶质细胞进一步增殖,数量显著高于对照组。在一些皱缩的神经元周围出现的神经胶质细胞,细胞核深染,排列较杂乱。胶质细胞数量在延髓缺血发生后3w内总的变化趋势是始终处于增殖状态。通过实验研究发现,神经胶质细胞与微血管密度的变化方面有一部分时段变化方向相同,即在脑缺血发生后的第2、3周,神经胶质细胞数量与微血管密度在数量上统计均处于持续增长的状态。脑缺血性疾病后微血管的扩张、增生相关机制目前还处于研究阶段。缺血时在大鼠脑神经胶质细胞释放诸多如PGI2等[16]神经介质,这些神经介质可能会为脑组织中新生微血管增生提供条件,成为对缺血条件下脑组织的相应的保护机制。但两者之间是否存在相关性及更深一步增殖机制有待研究。
神经胶质细胞,特别是星形胶质细胞在维持脑细胞内环境方面有重要功能,同时还担负着为神经元供能、提供营养因子的职责。缺血诱导的神经胶质细胞的增生在实验后第一周可见。在2w、3w的研究观察中,神经元出现崩解现象。在缺血条件下,神经胶质细胞大量增生会影响到微循环,引起局部微循环障碍。从而进一步加重神经元的缺血缺氧表现,在持续低灌注状态下会出现大量神经元胞体破碎、凋亡。
实验结果提示,在脑缺血条件诱导下,延髓内部微血管、神经元、神经胶质细胞之间存在相互影响。随着延髓缺血时间的延长,神经胶质细胞的增生为微血管的新生提供了必要的基础。同时微血管的增生本身也为神经胶质细胞的增殖提供能量的贮备。实验时间进一步推移,神经胶质细胞大量增生后,出现了病灶局部的微循环改变,出现局部微循环障碍,导致神经元的减少,考虑出现迟发性神经元死亡。
图1 对照组

图2 实验1w组
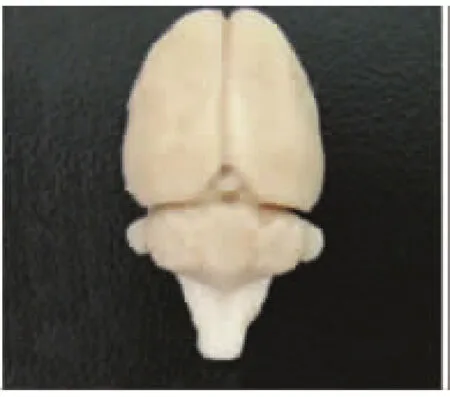
图3 实验2w组

图4 实验3w组

图5 对照组HE×200

图6 实验1w组HE×200

图7 实验2w组HE×200

图8 实验3w组HE×200

图9 对照组TA-FE×100
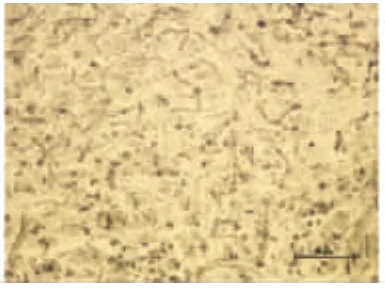
图10 实验1w组TA-FE×100

图11 实验2w组TA-FE×100

图12 实验3w组TA-FE×100
[1]Ginsberg MD,Busto R.Rodent models of cerebral ischemia[J].Stroke,1989,20:1627 -1642.
[2]Molinari GF.Why model strokes[J].Stroke,1988,19:1195 -1197.
[3]Caplan L.Posterior circulation ischemia:then,now,and tomorrow.The Thomas Willis Lecture 2000[J].Stroke,2000,21:2011 -2012.
[4]Caplan LR,Wityk RJ,Glass TA,et al.New england medical center posterior circulation registry[J].Ann Neuro,2004,56:389 -391.
[5]刘斌主编.组织学与胚胎学[M].北京:北京大学医学出版社,2003.12 -25.
[6]赵淑敏,孔祥玉.一种媒染微血管的新方法-单宁酸-氯化铁法[J].解剖学杂志,2001,24(1):91 -91.
[7]赵淑敏,孔祥玉.同时显示肾微血管和肾小管上皮细胞的研究[J].解剖学杂志,2003,26(6):592 -592.
[8]孔祥玉,赵淑敏,周天启.单宁酸-金属盐媒染脑血管的研究[J].解剖学杂志,1997,20(1):53 -54.
[9]张翠英,卢彦珍,范毅敏,等.结扎兔基底动脉后脑干缺血范围的研究[J].长治医学院学报,2007,21(6):401 -403.
[10]解景田,赵静主编.生理学实验[M].北京:高等教育出版社,2002.137 -140.
[11]Miura Y,Ito T,Kadokawa K.Acute EEG changes in rats brainstem ischemia and its dopaminergic involvement[J].Jpn J Pharmacol,1985,39:443 -451.
[12]张成英,苗 华,田鹤村,等.大鼠椎-基底动脉的解剖学观察及其在脑缺血模型中的应用[J].中国临床解剖学杂志,1995,13(1):53-55.
[13]李伟光,戚基萍,陈艳昕.人脑梗死周围组织星形胶质细胞反应与微血管相关性研究[J].哈尔滨医科大学学报,2005,39(1):7-9.
[14]Cavaglia M,Dombrowski SM,Drazba J,et al.Regional variation in brain capillary density and vascular response to ischemia[J].Brain Res,2001,901(1 ~2):81 -93.
[15]张 强,喻志源,田代实,等.大鼠局灶性脑缺血后星形胶质细胞过度增殖对局部微循环的影响[J].中国组织化学与细胞化学杂志,2008,17(6):571 -575.
[16]范有明,高钰琪,刘福玉,等.缺氧对大鼠脑星形胶质细胞释放NO、PGI2、TXA2、ET-1 的影响[J].第三军医大学学报,2004,1(26):3 -4.

