红曲霉诱导产生红曲色素条件的研究
董夏莲,王红英,钱斯日古楞,李长清
(大连工业大学生物工程学院,辽宁大连116034)
红曲霉(Monascns)是一种小型丝状腐生真菌,属真菌门,子囊菌纲,真子囊菌亚纲,曲霉科,红曲属[1],广泛存在于新鲜的牧草、泥土、橡胶及松树根等组织中[2]。它嗜酸,特别是乳酸,耐高温、耐乙醇,生长最适pH为3.5~5.5,生长温度为26~42℃。它多出现在乳酸自然发酵基物中,能利用多种碳源、氮源。红曲霉在其生长过程中产生红曲色素,纯天然,无毒无副作用。近年来,由于合成色素的安全性受到挑战,天然色素日益受到重视[3-4]。红曲霉在许多亚洲国家特别是东南亚被用来作为加工传统食品的微生物。在我国的利用也有悠久的历史,被广泛运用于酿酒、腐乳、食醋、食品色素、中药等方面[5]。
红曲色素不仅可作为天然色素,而且具有明显的脂肪酶抑制活性。因此,在降血脂保健品和减肥产品的研发中具有广泛应用前景[6-8]。人们苦于肥胖引起的疾病,如果能够阻止脂肪的消化吸收,对高脂肪引起的肥胖和疾病将有很大的改善。目前市场上常见的减肥药物主要是作用于大脑,通过抑制食欲减少食品的摄入量,也有一部分是通过抑制脂肪酶活性,以减少脂肪吸收而达到减肥目的。但是,这些皆是合成类药物,有不同程度的副作用。因此越来越多的学者将目光瞄准了天然药物[9]。
本实验以D-青霉胺(H-Pen)为诱导剂,使红曲霉诱导产生大量的红曲色素,并对红曲色素进行分离提取,同时对诱导条件进行优化。这将对红曲色素减肥天然保健品的研发探索一条新的道路。
1 材料与方法
1.1 材料红曲霉Monascus购于大连旅顺圆宝豆制品厂;D-青霉胺(H-Pen),上海晶纯试剂有限公司;其它试剂均为国产分析纯。
1.2 培养基硝酸钠1 g,葡萄糖2.5 g,磷酸二氢钾0.075 g,硫酸镁0.05 g,用50 mL蒸馏水溶解,用乳酸调节其pH为3.5,121℃灭菌20 min。
1.3 方法
1.3.1 红曲霉的培养将红曲霉孢子接入装有玻璃珠的三角瓶中,30℃振荡1 h,使孢子充分打散,取1 mL孢子悬液梯度稀释至1×107个/mL备用。
在无菌操作条件下,向盛有50 mL培养基的250 mL三角瓶中接入1 mL 107个/mL红曲霉孢子菌悬液,30℃、160 r/min振荡培养12 d取出。
1.3.2 诱导产生红曲色素将0.35 g H-Pen加入50 mL蒸馏水中充分溶解混匀,制备成0.7%的诱导剂溶液。
培养基灭菌后,在无菌条件下,向培养基中接入1 mL 107个/mL红曲霉孢子菌悬液,其中一瓶培养基加入质量分数为0.07%诱导剂,另外一瓶不加诱导剂做空白对照,30℃、160 r/min振荡培养12 d取出。
将培养得到的发酵液用四层纱布过滤,洗涤两遍,挤干,再用滤纸反复压干称定质量,即为湿菌体生物量。
发酵液过滤后得到的菌体加入15 mL无水乙醇37℃条件下萃取0.5 h,离心取上清液,用适量无水乙醇稀释,用分光光度计在410 nm处测定红曲色素提取液的OD值[10]。用无水乙醇做空白对照。
1.3.2.1 诱导剂添加量对红曲色素产生的影响在无菌条件下,对质量分数为0.7%的诱导剂进行梯度稀释,分别配制质量分数为0.7%、0.07%、0.007%、0.000 7%、0.000 07%的诱导剂溶液。取不同质量分数的诱导剂各1 mL,分别加到培养基中,向培养基中接入1 mL 107个/mL红曲霉孢子菌悬液,30℃、160 r/min振荡培养12 d。取出,测定红曲霉的湿菌体量和红曲色素的色价。无诱导剂的做空白参照。
1.3.2.2 pH值对诱导产生红曲色素的影响用乳酸为调节剂,分别配置pH为2.8、3.8、4.8、5.8、6.8的培养基。灭菌后,在无菌条件下各加质量分数为0.000 7%的诱导剂,接入1 mL 107个/mL的红曲霉孢子菌悬液。在30℃、160 r/min振荡培养12 d。取出,测定红曲霉的湿菌体量和红曲色素的色价
1.3.2.3 培养温度对诱导产生红曲色素的影响配制培养基,用乳酸调节pH到3.5,在无菌条件下,向培养基中加入质量分数为0.000 7%的诱导剂,接入1 mL 107个/mL红曲霉孢子菌悬液,培养温度分别为26、28、30、32、35℃,160 r/min振荡培养12 d。取出,测定红曲霉的湿菌体量和红曲色素的色价。
1.3.2.4 培养时间对诱导产生红曲色素的影响配制培养基,用乳酸调节pH到3.5,在无菌条件下,所有培养基中加入质量分数为0.000 7%的诱导剂,接入1 mL 107个/mL红曲霉孢子菌悬液,培养温度为30℃,160 r/min振荡培养,分别在培养8、10、12、14、16d。取出,测定红曲霉的湿菌体量和红曲色素的色价。
1.3.2.5 装瓶量对诱导产生红曲色素的影响配制培养基,用乳酸调节pH到3.5,分别取50、100、150 mL培养基装入250 mL三角瓶中,在无菌条件下,所有培养基中加入质量分数为0.000 7%的诱导剂,接入1 mL 107个/mL红曲霉孢子菌悬液,30℃、160 r/min振荡培养12 d。取出,测定红曲霉的湿菌体量和红曲色素的色价。
2 结果
2.1 添加诱导剂对红曲色素产生的影响配制两瓶培养基,一瓶加入质量分数为0.07%的诱导剂,另外一瓶不加诱导剂做空白参照,两瓶培养基中均接入1 mL 107个/mL红曲霉孢子菌悬液,30℃、160 r/min振荡培养12 d,结果见图1。

图1 诱导剂对菌体生长的影响Fig.1 Inducer effects on cell growth
由图可见,通过对有诱导剂与无诱导剂的红曲霉的菌质量及胞内红色素的吸光值的对比,诱导剂促进红曲霉产生红曲色素,同时对菌体生长有明显的促进作用。
2.2 诱导产生红曲色素
2.2.1 诱导剂添加量对红曲色素产生的影响分别向培养基中加入质量分数为0.7~0.000 07%的诱导剂,培养后,得到菌体质量及胞内色素的色价。没添加诱导剂的做空白对照,结果见图2。

图2 诱导剂添加量的选择Fig.2 Choice of the amount of inducer added
由图可见,诱导剂添加量为0.000 7%诱导产生的红曲色素色价最高,菌体质量相对较大。综合考虑菌体的色价、菌体生长量,确定诱导剂加量为0.000 7%是最佳诱导剂加量。
2.2.2 诱导pH值的确定用乳酸为调节剂,配制pH为2.8~6.8的培养基。培养后,得到菌体质量及胞内色素的色价,结果见图3。
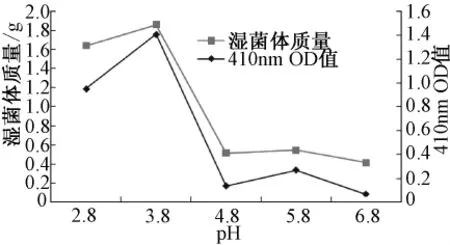
图3 最佳培养pH的确定Fig.3 Determination of optimal culture pH
由图可见,pH值为3.8的时候,诱导产生的红曲霉菌量最大,红曲色素色价最高。确定pH值3.8为最佳诱导pH。
2.2.3 诱导温度的确定将红曲霉分别在26~35℃条件下震荡培养。培养后,得到菌体重量及胞内色素的色价,结果见图4。

图4 最佳培养温度的确定Fig.4 Determination of optimal culture temperature
由图可见,培养温度为26、28、30、32℃时,红曲霉的菌体量、色价依次明显递增,32℃到35℃红曲霉的菌体量、色价没有明显变化。综合考虑菌体的色价、菌体生长量及最低耗能,确定32℃为诱导红曲霉产生红色素的最佳温度。
2.2.4 培养时间的确定其它培养条件不变的情况下,将红曲霉分别培养6~14 d,得到菌体质量及胞内色素的色价,结果见图5。
由图可见,培养时间为6、8、10、12 d,红曲霉的菌体量、色价依次明显递增,12 d到14 d红曲霉的菌体量、色价没有明显变化。综合考虑菌体的色价、菌体生长量及最低耗能,确定12 d为诱导红曲霉产生红色素的最佳培养时间。

图5 最佳培养时间的确定Fig.5 Determination of optimal culture time
2.2.5 装液量的优化为了考察通风量对红曲霉产色素的影响,同时又考虑到最低的动力消耗而采用摇瓶不同装液量对红曲霉产色素的影响[11]。结果见表1。

表1 不同装液量对红曲霉产红曲色素的影响Tab.1 Effects of different volumes in flask liquid on pigment of Monascus
3 讨论
H-Pen诱导红曲霉产生红曲色素效果明显,其最佳条件为,诱导剂添加量为0.000 7%,培养pH条件为3.8,温度为30℃,培养时间为12 d,最佳每瓶装液量50 mL。
红曲色素是目前唯一允许在食品中使用的天然真菌色素,红曲色素作为食品添加剂时除了可提高食品的色泽还可抑制体内脂肪酶的活力,达到降低脂肪吸收的效果,同时,通过抑制有毒物质(桔霉素)的合成[12],提高红曲色素的产量,提高其色价,确定出诱导条件和对脂肪酶抑制力的关系,提高红曲色素的稳定性以后,其产品将会有更广阔的前景。
[1]丘振宇,王亚琴,许喜林.红曲霉的特点及应用研究[J].食品工业科技,2006(12):186-188.
[2]方元超,杨柳.红曲霉研究进展综述[J].四川食品与发酵,1999(1):6-10.
[3]郭宝禹,郝林.红曲霉产物的功能及研究进展[J].酿酒科技,2010(6):89-91.
[4]颜延宁.红曲色素的研究进展[J].广西轻工业,2007(2):17-36.
[5]张志刚,马歌丽.红曲霉的应用现状及发展前景[J].食品加工,2007(3):36-29.
[6]Kim J H,Kim H J,Park H W,et al.Development of inhibitors against lipase and a-glucosidase from derivatives of monascus pigment[J].FEMS Microbiol Lett,2007(276):93-98.
[7]张庆庆,危勤涛.红曲霉发酵生产Monacolin K的研究进展[J].生物学杂志,2005,25(1):51-54.
[8]陈春艳.功能红曲与红曲色素的研究进展[J].湖南科技学院学报,2007(28):40-42.
[9]朱晓青.荷叶活性成分的提取及对脂肪酶抑制的研究[D].上海:上海大学,2006.
[10]林元山,詹逸舒,梁智群.从红曲霉菌丝体中提取红色素的工艺[J].湖南农业大学学报:自然科学版,2008,34(3):355-358.
[11]郭红珍,千秋芬,马立芝.不同培养条件对红曲霉产红曲色素的研究[J].食品科学,2008(1):215-218.
[12]邢淑婕,刘开华.培养条件对红曲霉产红曲红色素及桔霉素影响的研究[J].中国食品添加剂,2010(1):112-115.

