五味子药材中苹果酸、柠檬酸的测定方法研究
张 韵, 傅 颖, 吴霞红
(1.上海市中药质量监督检验室,上海 200336;2.上海体育科学研究所,上海 200030)
五味子是木兰科植物五味子Schisandra chinensis的干燥成熟果实,其功效收敛固涩、益气生津、补肾宁心[1],兼有药用与营养作用两种属性。近年来,对五味子的研究表明,其具有增强免疫、提高抗氧化机能以及改善肠道菌群等作用[2-3]。五味子中有机酸含有量的高低代表着药材的成熟度,与五味子的有机酸如苹果酸、柠檬酸具有一定的关联,本实验以研究有机酸为目的,开发新产品,为保证产品质量,把好原药材质量关,有必要建立五味子中苹果酸、柠檬酸的高效液相检测方法。
1 仪器、试药与样品
1.1 仪器 Agilent 1100高效液相色谱仪;G1322A自动进样器;G1316A柱温箱;DAD G1315B检测器;超声波清洗机SK7200LH,功率350 W,59 kHZ,上海科导超声仪有限公司。
1.2 试药、试剂 柠檬酸对照品(中国药品生物制品检定所,批号111679-200401,供定量测定用);L-苹果酸对照品SIGMA公司,批号 01011AE,供定量测定用);甲醇为色谱纯,水为重蒸馏水,其它试剂均为分析纯。五味子药材产自辽宁,6个批次(批号见样品检验结果)均按照2010版中国人民共和国药典一部检验结果符合规定。
2 色谱条件
以十八烷基硅烷键合硅胶为填充剂;以甲醇为流动相A,以0.1%磷酸水溶液为流动相B,按2010年版中国药典一部梯度洗脱方法(按表1进行梯度洗脱),检测波长为209 nm;柱温15℃;进样量10 μL;色谱柱理论塔板数按苹果酸、柠檬酸色谱峰计算应不低于3000。

表1 苹果酸、柠檬酸梯度洗脱顺序
3 方法与结果
3.1 对照品溶液的制备
苹果酸对照品溶液的制备 精密称取苹果酸对照品11.62 mg,置25 mL量瓶中,加0.1%磷酸溶液溶解并稀释至刻度,摇匀。制成0.4648 mg/mL的对照品溶液,备用。
柠檬酸对照品溶液的制备 精密称取柠檬酸对照品21.22 mg置25 mL量瓶中加水溶解并稀释至刻度,摇匀,制成0.849 mg/mL的对照品溶液,备用。
3.2 供试品溶液的制备 取五味子药材适量粉碎,使其全部通过60目筛。精密称取粉末约0.5 g置25 mL量瓶中,加水适量超声60 min,冷却至室温,定容,滤过,取滤液15 mL,减压浓缩至干,用0.1%H3PO4溶液溶解并定量转移至10 mL量瓶中,并稀释至刻度,摇匀。经0.45 μm微孔滤膜滤过,得供试品溶液。
3.3 色谱条件及系统适应性试验 用十八烷基硅烷键合硅胶为填充剂;以甲醇为流动相A,以0.1%磷酸溶液为流动相B;检测波长为209 nm;苹果酸、柠檬酸的测定均按表1进行梯度洗脱,苹果酸测定的柱温为15℃;柠檬酸测定的柱温为23℃;以苹果酸、柠檬酸色谱峰计,理论塔板数应不低于3000。
3.3.1 检测波长的选择 取苹果酸和柠檬酸对照品的水溶液,高效液相色谱仪分别进样,考察苹果酸和柠檬酸在190~380 nm波长范围内的光谱吸收图,苹果酸和柠檬酸在209 nm处有稳定的、较大的吸收峰,故选择209 nm作为苹果酸和柠檬酸HPLC检测波长。
3.3.2 供试品提取方法的选择
取0.5061 g药材粉末,置25 mL量瓶中,加水适量超声1 h,冷却至室温并稀释至刻度,取滤液15 mL,按3.2项供试品制备项制备,在上述苹果酸和柠檬酸色谱条件下,分别注样分析。结果见表2。
取0.5216 g药材粉末,精密加入25 mL水,回流1 h,冷却至室温并稀释至刻度,取滤液15 mL,按供试品制备项制备,在上述苹果酸和柠檬酸色谱条件下色谱条件下,分别注样分析。结果见表2。结果表明,采用超声提取法提取比较完全,且方法操作简单。
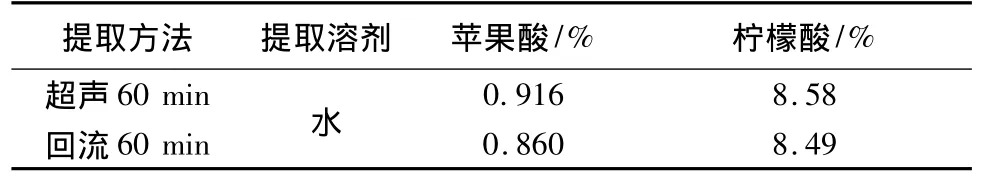
表2 药材中苹果酸和柠檬酸测定的提取方法比较
3.3.3 苹果酸和柠檬酸线性关系考察 分别吸取苹果酸和柠檬酸对照品备用液,在上述苹果酸和柠檬酸色谱条件下,苹果酸进样 1、3、5、8、10、15、20 μL,柠檬酸进样 2、5、8、10、12、15、18 μL,各浓度进样 2 次,取峰面积的平均值。以峰面积为纵坐标,苹果酸、柠檬酸进样量为横坐标,分别绘制成标准曲线,计算得回归方程:苹果酸Y=66.32X+1.49,柠檬酸Y=87.66X+0.29,相关系数分别为0.9996和0.9999。结果表明,苹果酸、柠檬酸在0.4648~9.296 μg和1.698~15.282 μg范围内与峰面积呈良好的线性关系。
3.3.4 精密度考察 精密吸取上述苹果酸和柠檬酸供试品溶液10 μL,注入液相色谱仪,连续进样7次,平均峰面积分别为318.0605,RSD为1.63%和744.1637,RSD为1.49%,结果表明精密度良好。
3.3.5 稳定性试验 取药材五味子按供试品溶液制备项制备,在上述色谱条件下,每隔1 h测定一次,连续进样10次,考察供试品溶液的稳定性。结果表明供试品溶液在10 h内测定结果稳定,苹果酸平均峰面积165.4521,RSD为2.0%(n=10);柠檬酸平均峰面积888.0191,RSD为1.41%(n=10)。
3.3.6 重复性试验 精密称取同一批号J070805的五味子药材样品5份,按供试品溶液制备项制备,在上述色谱条件下,按定量测定方法进行测定,测得苹果酸和柠檬酸平均质量分数分别为0.918%(RSD1.98%)和8.502%(RSD1.98%)。结果表明本法重复性良好。
3.3.7 加样回收率试验 取已测定的同一批号J070805的五味子药材样品6份(该批样品平均含苹果酸量为1.05%,柠檬酸为8.56%),分别精密加入苹果酸和柠檬酸对照品溶液,按供试品溶液制备项方法处理,在上述色谱条件下,按定量测定方法测定苹果酸和柠檬酸,计算回收率,结果见表3、4。结果表明回收率良好。
表3 苹果酸加样回收率试验结果 ()
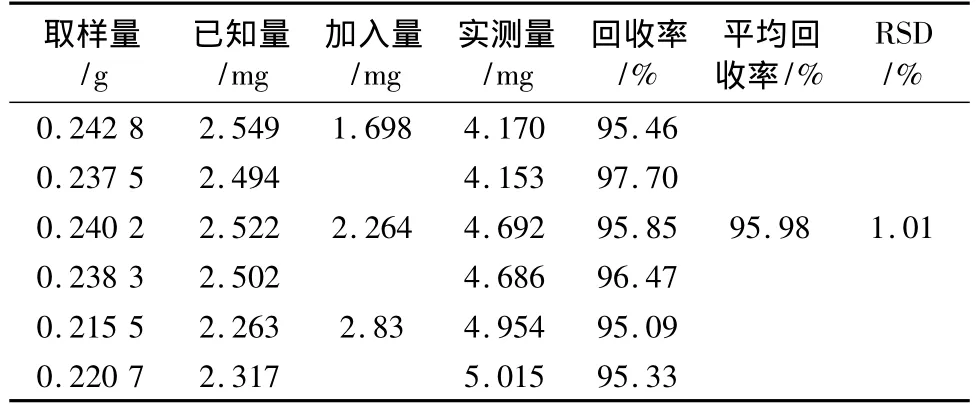
表3 苹果酸加样回收率试验结果 ()
取样量/g已知量/mg加入量/mg实测量/mg回收率/%平均回收率/%RSD/%0.2428 2.549 1.698 4.170 95.460.2375 2.494 4.153 97.700.2402 2.522 2.264 4.692 95.85 95.98 1.010.2383 2.502 4.686 96.470.2155 2.263 2.83 4.954 95.090.2207 2.317 5.015 95.33
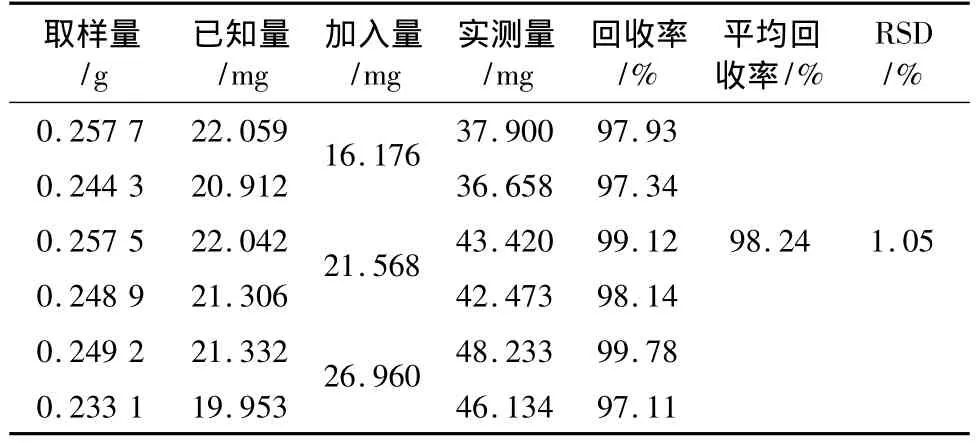
表4 柠檬酸加样回收率试验结果
3.4 6批五味子药材样品的定量测定 取6批五味子药材按供试品溶液制备项下操作,每批分别制成3份供试品溶液。在上述色谱条件下,分别注样分析,以外标法计算。结果见表5。见图1~2。
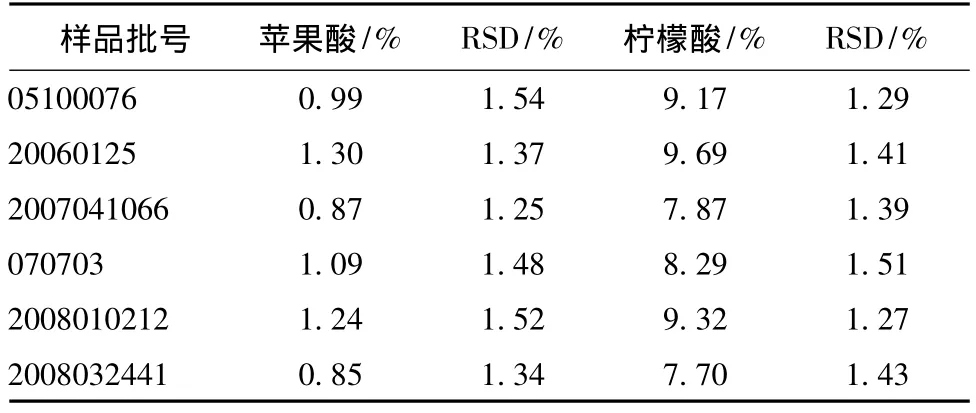
表5 6批药材定量测定结果
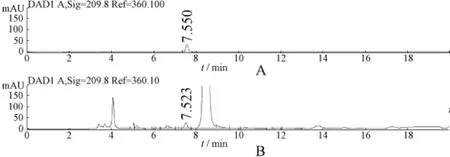
图1 苹果酸对照品(A)及五味子药材中苹果酸(B)HPLC图谱
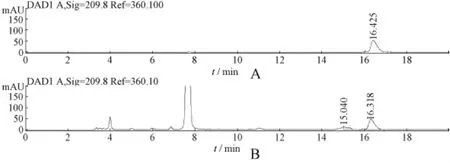
图2 柠檬酸对照品(A)及五味子药材中柠檬酸(A)HPLC图谱
4 小结与讨论
4.1 在样品提取处理方面曾采取不同时间的比较试验,实验结果表明现采取超声波提取优于回流提取60 min已完全能提取有机酸成分。
4.2 由于苹果酸和柠檬酸吸收波长,化学性质相近,故而本实验采用梯度洗脱和适当调节柱温的差异,得到成功分离。
[1]国家药典委员会.中华人民共和国药典:2010年版一部[S].北京:中国医药科技出版社,2010:61.
[2]李建平,单安山,程宝晶,等.五味子、柠檬酸对断奶仔猪血清生化指标和免疫功能的影响[J].中国畜牧杂志,2009,45(17):25-29.
[3]Hancke J L,Burgos R A,Ahumada F.Schisandra chinensis(Turcz.)Baill[J].Fitoterapia,1999,70(5):451-471.
[4]Zhu M,Yeung R Y,Lin K F,et al.Improvement of phase I drugmetabolism with Schisandra chinensis against CCl4hepatotoxicity in a rat model[J].Planta Med,2000,66(6):521-525.
[5]唐慧慧,蔡清宇,毛 翼.HPLC法测定净乌梅及乌梅炭中柠檬酸和苹果酸的含量[J].中药材,2007,30(1):52-54
[6]安天海,王爱英.五味子的综合质量分析[J].中国林副特产,2009,101(4):39
[7]吴建兵,王誉洁,赵 铁,等.电位滴定法测定五味子中总游离有机酸[J].中草药,2007,38(2):281-282.
[8]张林疆,刘唯芬,毕开顺,等.五味子质量标准的研究[J].辽宁中医学院学报,2004,6(3):219-220.

