牛隐孢子虫多重PCR方法的建立及应用
彭 昊,李 军,陶 立,陈泽祥,韦志锋,许力干,杨 威
隐孢子虫病(cryptosporidiosis)是由隐孢子虫感染而引起的以腹泻为主要临床症状的一种人兽共患的寄生虫病[1]。隐孢子虫主要引起幼龄动物的消化道和呼吸道疾病,导致其生产性能下降或死亡。传统方法如粪便浓集、改良抗酸染色和免疫荧光染色法等检测卵囊步骤繁琐,敏感性低,目前使用的分子生物学方法检测隐孢子虫方法为Xiao等[2]建立的巢式-PCR-RFLP,特点是通用性好,可检测目前发现的所有隐孢子虫种类,但需要两轮PCR以及酶切鉴定的过程方能定种,较为耗时。本研究在国外牛微小隐孢子虫COWP基因[3]和本室安氏隐孢子虫ITS-1基因单一PCR技术的基础上,建立多重PCR的检测方法,优化适宜条件,建立多重PCR快速检测方法。
1 材料与方法
1.1 材料
1.1.1 虫株 安氏隐孢子虫、贝氏隐孢子虫由本实验室分离鉴定,微小隐孢子虫为河南农业大学张龙现教授惠赠;牛泰勒氏虫、牛巴贝斯虫、伊氏锥虫、食道口线虫为广西大学寄生虫研究室李健老师惠赠。
1.1.2 试剂 粪便DNA提取试剂盒购自天根生化科技(北京)有限公司;2×TaqPCR Master Mix、DNA Marker 1购自广东东盛生物科技有限公司。
1.2 方法
1.2.1 引物的设计与合成 根据前人研究及本室研究情况,设计合成两对引物,引物序列为引物由广州Invitrogen公司合成。微小隐孢子虫引物靶基因为COWP基因,引物序列为:上游引物 C.parvum P1:5′-CCCAACATTCCTGGTGTAGCTTCC -3′,下游引物 C.parvum P2:5′-GAA CGCACCTGTTCCCACTCAATG-3′,预期扩增片段长度为1 033bp。安氏隐孢子虫引物靶基因为ITS-1基因,上游引物 C.andersoni P1:5′-ATTGAACCTGAACTTGCCTA -3′,下 游 引 物 C.andersoni P2:5′ – AAAAGTCGGCAAATAACAA-3′,预计扩增片段长度为263bp。
1.2.2 DNA模板的制备 取待检牛的新鲜粪便20.0g~50.0g,置灭菌烧杯充分搅匀,称取搅拌后的粪便样本180~220mg至2mL离心管中,反复冻融处理3次后,按粪便基因组DNA提取说明书提取模板DNA。
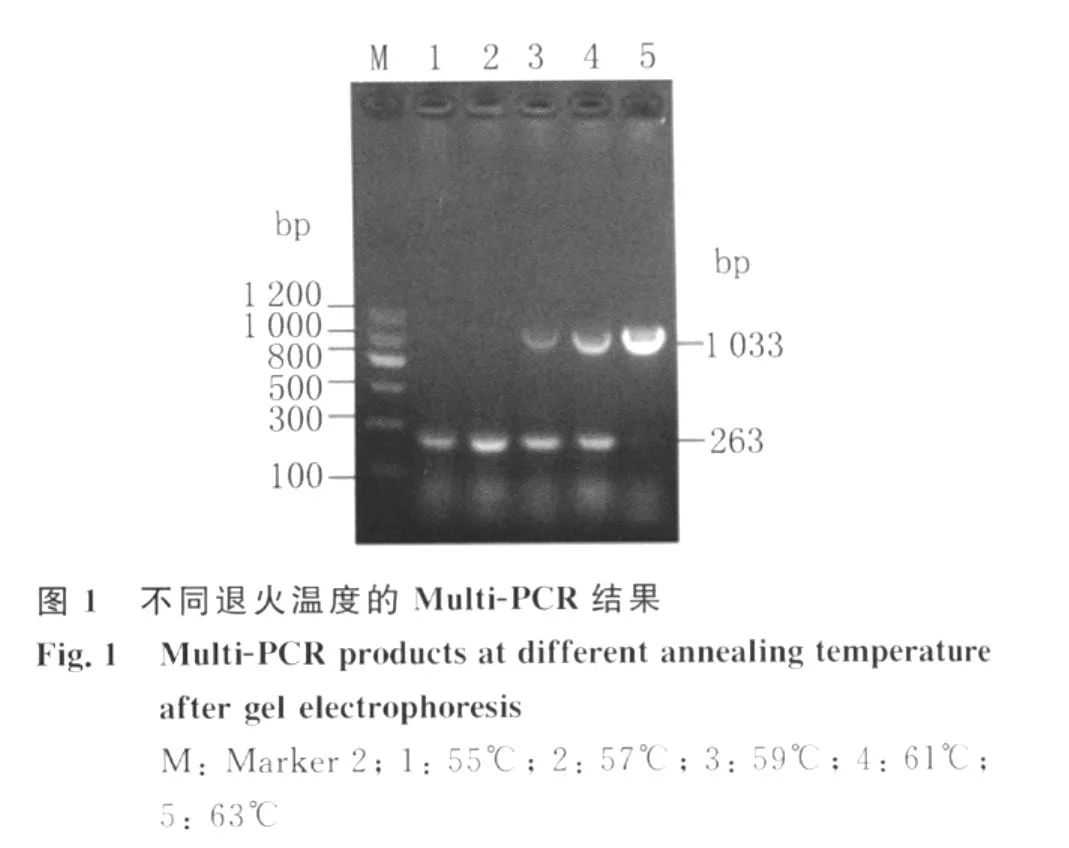
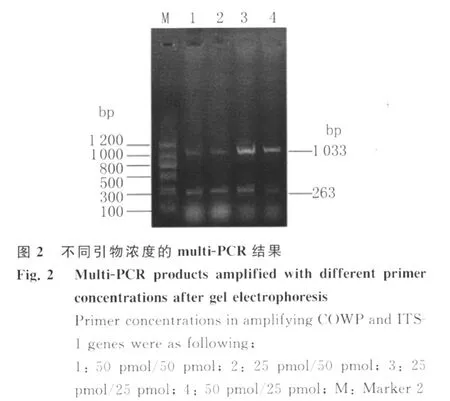
1.2.3 多重PCR扩增条件的优化 在微小隐孢子虫和安氏隐孢子虫单重PCR稳定的基础上,将微小隐孢子虫和安氏隐孢子虫的DNA等量混匀物作为模板,对多重PCR中的退火温度(55℃(下同)、57、59、61、63)、引物浓度(50pmol/50pmol、50pmol/25pmol、25pmol/25pmol、25pmol/50 pmol)等条件进行优化,筛选多重PCR扩增的最佳反应体系和程序。
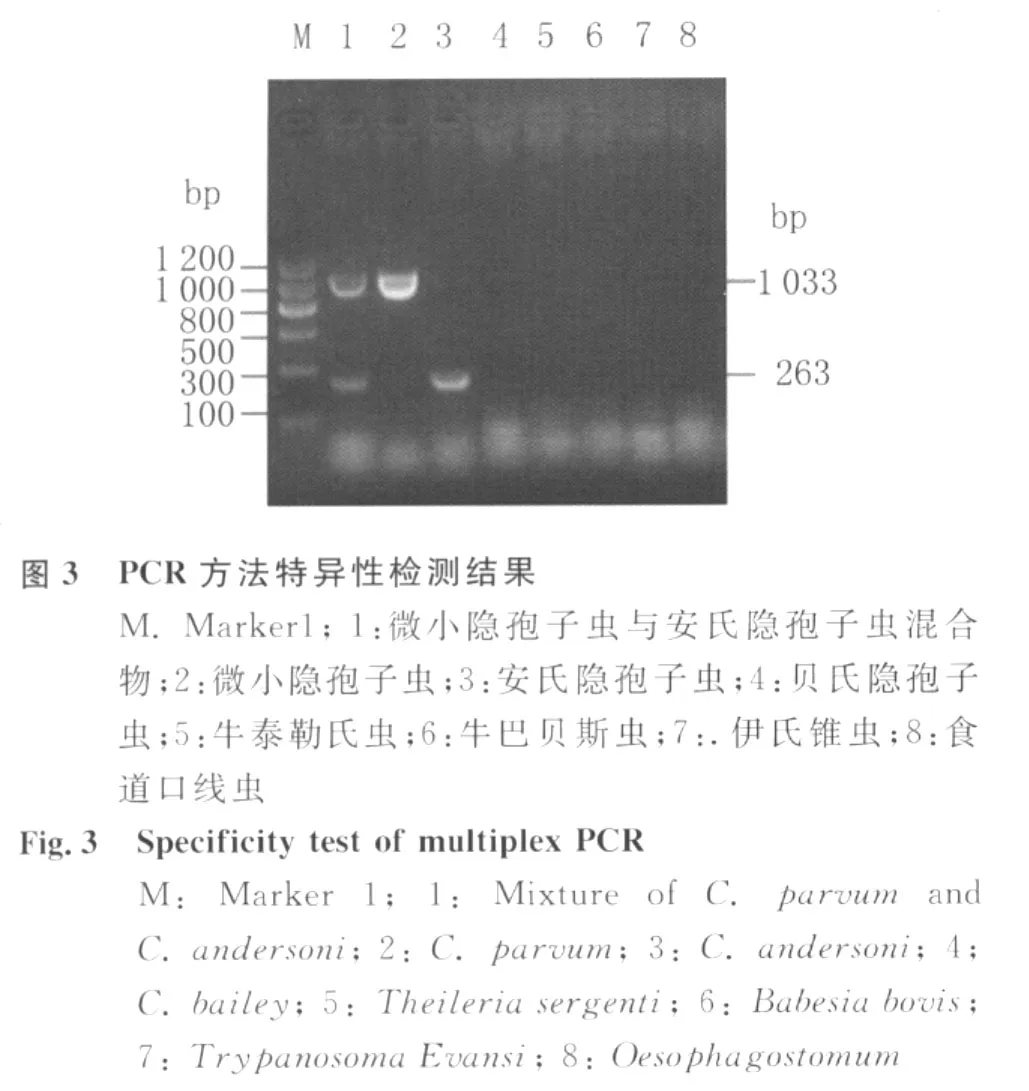
1.2.4 特异性试验 分别用分别以经传统镜检及Nest-PCR-RFLP鉴定后定种确定的微小隐孢子虫与安氏隐孢子虫混合物、微小隐孢子虫、安氏隐孢子虫、贝氏隐孢子虫、牛泰勒氏虫、牛巴贝斯虫、伊氏锥虫、食道口线虫为模板,进行PCR扩增检测,PCR反应结束后取20μL产物用于1%琼脂糖凝胶电泳分析。
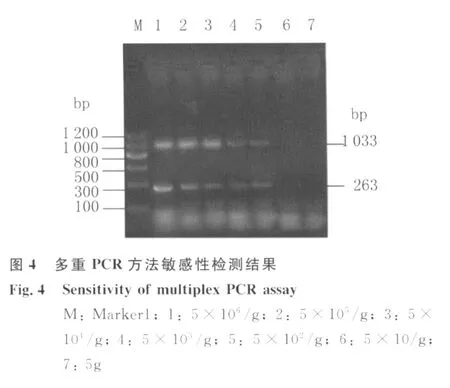
1.2.5 敏感性试验 测定敏感度时,将经过计数的微小隐孢子虫与安氏隐孢子虫混合卵囊加入牛粪中,浓度分别为5×106、5×105、5×104、5×103、5×102、5×101、5个卵囊/g粪,用天根粪便基因组DNA试剂盒分别提取DNA后,进行多重PCR扩增。
1.2.6 重复性试验 应用建立的多重PCR方法,重复检测微小隐孢子虫、安氏隐孢子虫单一DNA或混合DNA样品3次,以确定其稳定性。
1.2.7 多重PCR对临床样品的检测 采用多重PCR方法对采自广西不同地区一些规模化奶牛场及散养户的1613份牛粪样进行牛隐孢子虫流行病学调查,并与经典的巢式PCR方法进行比较分析。
2 结 果
2.1 多重PCR条件的确立 按照对 Multi-PCR反应的退火温度,见图1、引物浓度,见图2。
2.2 Multi-PCR反应特异性检测结果 琼脂糖凝胶电泳结果显示,见图3,微小隐孢子虫与安氏隐孢子虫混合物、微小隐孢子虫、安氏隐孢子虫均扩增出相应特征性的片段,而贝氏隐孢子虫、牛泰勒氏虫、牛巴贝斯虫、伊氏锥虫、食道口线虫无特征性条带,证实本方法有良好的特异性。
2.3 Multi-PCR反应敏感性检测结果 通过对7个不同浓度的隐孢子虫模板进行扩增,结果表明本方法在5×102个/g孔处仍可见清晰度较高的目的条带,见图4。所以本方法最低可检测每g牛粪中500个隐孢子虫卵囊。
2.4 重复性试验 应用建立的多重PCR方法,重复检测微小隐孢子虫、安氏隐孢子虫单一DNA或混合DNA样品3次,结果均一致。
2.5 多重PCR对临床样品的检测 采用多重PCR方法对采自广西不同地区一些规模化奶牛场及散养户的1 613份牛粪样进行牛隐孢子虫多重PCR方法与经典的巢式PCR方法的平行比较分析。。两种方法检测结果均为安氏隐孢子虫阳性粪样189份,微小隐孢子虫阳性粪样1份,符合率为100%。表明建立的多重PCR方法特异性和敏感性较好,可用于临床检测。
3 讨 论
常规隐孢子虫病原学检测主要通过小肠黏膜活检法、粪便集卵法及抗酸染色法等镜检观察,均需要进行隐孢子虫的纯化,费时费力、检出率低且主观性强。而采用分子生物学方法检测往往也要先进行隐孢子虫的分离纯化、超声破碎等前处理过程,而本研究通过直接用试剂盒,仅冻融处理即可快速、简便提取粪便中的隐孢子虫卵囊DNA做为模板,较前人方法[4]省略了从粪便中卵囊分离、纯化的繁琐步骤,大为减轻了工作量。
单一PCR 1次只能检测一种病原,当对几种病原进行检测时,需进行多次PCR反应。而多重PCR技术具有单一PCR技术无可比拟的优越性:方便快捷和经济,减轻了工作量,一次反应可以检测多个基因型,可最大限度减少取样错误和交叉污染。具体到隐孢子虫的检测方面。相较Xiao等[2]建立的通过两轮PCR扩增隐孢子虫18SrRNA特异性DNA片段后再选取不同的限制性内切酶进行RFLP鉴定该隐孢子虫虫种的经典方法,本研究建立的多重PCR方法能在一次反应中对粪样中的微小隐孢子虫和安氏隐孢子虫进行检测,而敏感性方面与向飞宇[5]、Benigno[6]等报道应用经典方法最低检测500个卵囊的水平相当,证实本方法特异、敏感、快速、简便,具有良好的应用性。
当然,经典方法经过不断改进可以用于区分几乎所有的隐孢子虫种类,在种的鉴别和基因型分型方面仍然具有不可替代的优势。近来国外虽有Santin[7]等多重PCR方法鉴别微小隐孢子虫、安氏隐孢子虫、牛隐孢子虫/赖氏隐孢子虫的报道,但该方法检测微小隐孢子虫和安氏隐孢子虫的目的条带差异仅为50bp(微小隐孢子虫为400bp,安氏隐孢子虫目的条带350bp)因此在电泳鉴定时对所用Maker、琼脂糖及结果辨识区分能力上均有较高要求,且牛隐孢子虫和赖氏隐孢子虫被认为并不导致宿主产生疾病或影响其生理[8-9],临床鉴定意义相对较低。本研究针对公共卫生学意义和临床危害较严重的微小隐孢子虫和安氏隐孢子虫,针对性和实用性较高。
应用建立的多重PCR方法对采自广西不同地区一些规模化奶牛场及散养户的1 613份牛粪样进行牛隐孢子虫流行病学调查并与巢式-PCR-RFLP方法做平行比较,两种方法检出的结果吻合。此次调查发现主要流行虫种为安氏隐孢子虫,微小隐孢子很少。究其原因主要是微小隐孢子虫主要感染断奶前乳牛,而此次调查主要为断奶后乳牛,此时的优势虫种应为安氏隐孢子虫,与Kvác等人[10]的研究情况相似,也进一步证实了隐孢子虫种类与日龄紧密相关。多重PCR方法的临床使用效果表明,本方法可用于隐孢子虫的流行病学调查研究及临床诊断。
[1]Xu QM,Li GQ,Ye YJ,et al.Development of RT-PCR-ELISA assay for detectingCryptosporidiumhominis[J].Chin J Zoonoses,2010,26(2):150-153.(in Chinese)徐前明,李国清,叶亦见,等.人隐孢子虫RT-PCR-ELISA检测方法的建立[J].中国人兽共患病学报,2010,26(2):150-153.
[2]Xiao LH,Morgan UM,Limor J,et al.Genetic diversity withinCryptosporidiumparvumand relatedCryptosporidiumspecies[J].Appl Environ Microbiol,1999,65(8):3386-3391.
[3]Spano F,Putignani L,Crisanti A,et al.Multilocus genotypic analysis ofCryptosporidiumparvumisolates from different hosts and geographical origins[J].J Clin Microbiol,1998,36(11):3255-3259.
[4]Li W,Wu K,Zhang XC,et al.Detection ofCryptosporidiumby nested PCR assay[J].Chin J Vet Sci,2010,30(6):779-783.(in Chinese)李巍,吴康,张西臣,等.应用巢式PCR检测隐孢子虫[J].中国兽医学报,2010,30(6):779-783.
[5]Xiang FY,Li GQ,Xiao SM,et al.Establishment of PCR detec-ting method ofCryptosporidiumandersoni[J].Chin J Prev Vet Med,2004,26(3):231-233.(in Chinese)向飞宇,李国清,肖淑敏,等.安氏隐孢子虫PCR检测方法的建立[J].中国预防兽医学报,2004,26(3):231-233.
[6]Balatbat BA,Jordan GW,Tang YJ,et al.Detection ofCryptosporidiumparvum DNA in human feces by nested PCR[J].J Clin Microbiol,1996,34:1769-1772.
[7]Santin M,Zarlenga DS.A multiplex polymerase chain reaction assay to simultaneously distinguishCryptosporidiumspecies of veterinary and public health concern in cattle[J].Vet Parasitol,2009,166:32-37.DOI:10.1016/j.vetpar.2009.07.039
[8]Fayer R,Santin M,Xiao L,Cryptosporidiumbovisn.sp.(Apicomplexa:Cryptosporidiidae)in cattle(Bostaurus)[J].J Parasitol,2005,91:624-629.DOI:10.1645/GE-3435
[9]Fayer R,Santin M,Trout JM,Cryptosporidiumryanaen.sp.(Apicomplexa:Cryptosporidiidae)in cattle(Bostaurus)[J].Vet Parasitol,2008,156:191-198.DOI:10.1016/j.vetpar.2008.05.024
[10]Kvác M,Kouba M,Vitovec J.Age-related and housing-dependence ofCryptosporidiuminfection of calves from dairy and beef herds in South Bohemia,Czech Republic[J].Vet Parasitol,2006,137(3-4):202-209.DOI:10.1016/j.vetpar.2006.01.027

