肠出血性大肠杆菌粘附机理的研究进展*
崔 强,周志江,刘建青,肖华志
EHEC是一群重要的传染性病原菌,有若干血清型,其中以 O157∶H7血清型菌株为主[1]。EHEC O157的感染因具有暴发流行趋势、较强的致病性与致死性和抗生素治疗可加剧病情的危险性等特点,已成为全球性公共卫生问题。2011年5月中旬,一场由EHEC细菌引发的疫情在德国北部集中暴发。由于广谱β-内酰胺酶CTX-M等质粒基因的作用,这些细菌对第三代头孢菌素等抗生素有耐受性[2]。据世界卫生组织统计,截至2011年6月24日,已报告3 043例EHEC O104∶H4感染病例,16例死亡,HUS病例877例,造成32例死亡。除德国外,美国、英国、瑞典、加拿大、新西兰等15个国家也有上述病例报告[3]。
EHEC的主要致病因子有两个,一是它产生毒力极强的志贺毒素,一是它具有粘附到上皮细胞的能力,粘附是该菌引起发病的重要环节。通常出血性大肠杆菌O157引起人或动物的感染必须粘附到肠粘膜上皮细胞,然后在此定居、释放外毒素,从而引起疾病[4]。目前,关于EHEC的粘附机理比较公认的是紧密素起重要作用,但仅仅依靠紧密素仍不足以引起粘附,除紧密素外,还从EHEC中鉴定出许多其他粘附因子。本文将就各类粘附因子进行分类阐述,并总结其粘附机理及研究进展。
1 粘附因子
1.1 紧密素(Intimin) 紧密素是由eae基因编码的94~97kDa的外膜蛋白,是肠道的粘附因子。紧密素既为AE损伤过程中所必需的,又介导细菌在肠黏膜上皮细胞刷状缘上粘附定居,避免细菌被肠道黏膜分泌液及肠蠕动清除[5]。
紧密素由表现同源性的N端和表现多肽受体结合活性的C端组成。此粘附素有不同的抗原亚型,包括紧密素α,β,γ,δ和ε。紧密素α的C端280个氨基酸构建成3个球状结构域,其中由β长带夹心结构组成的前两个结构域与免疫球蛋白超家族(Immunoglobulin Super Family,IgSF)类似。结合紧密素受体的活性片段贯穿这个类IgSF结构域和邻近的类凝集素结构域,而紧密素受体结合位点在类凝集素结构的顶端残基上[6]。
紧密素不仅能与紧密素受体相互作用,也可以与宿主受体结合。紧密素的不同抗原亚型能够决定细菌在宿主体内的不同组织嗜性,而对特定位点的突变研究已经发现了决定组织嗜性的关键残基[7]。
1.1.1 AE损伤(Attaching/Effacing lesion) 紧密素是通过AE损伤过程发挥粘附作用的。AE损伤是指细菌能够附着在肠上皮细胞表面的微绒毛上,并将肠上皮微绒毛抹平,使细菌粘附处正下方的细胞骨架结构发生重排,同时发生丝状肌动蛋白的聚集。细菌在粘附过程中依附在细胞表面的基座结构上,此结构能延伸到细胞外10μm处[8](图1)。
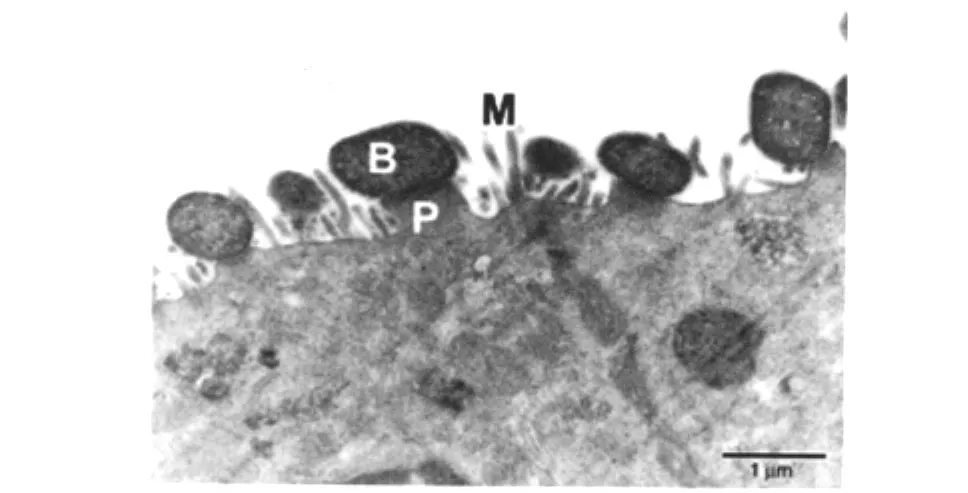
图1 AE损伤(透射电镜图像)[8]B:附着的大肠杆菌菌体;P:宿主细胞底座结构;M:宿主细胞微绒毛Fig.1 AE lesion(TEM images)B:Adhesive E.coli;P:The base structure of host cells;M:Microvilli of host cells.
1.1.2 Tir(Translocation intimin receptor) AE损伤的形成需要一种叫Tir的蛋白,其由Ⅲ型分泌系统分泌后借助EspA、EspB、EspD转位于宿主细胞,表现为紧密素受体功能。紧密素与Tir结合后可引起宿主细胞信号转导反应并导致细胞骨架重排而形成特异性损害。Tir与紧密素的两个跨膜结构域一起在宿主细胞质形成一个发卡拓扑结构[9]。
1.2 LEE编码蛋白和非LEE编码蛋白 EHEC的染色体上有一个43kb的肠细胞脱落毒力岛(Locus of enterocyte effacement,LEE)。LEE不仅编码转运蛋白EspA,EspB和EspD,还编码效应蛋白EspF,EspG,EspH,EspZ,Tir和 Map。某些非LEE编码蛋白(non-LEE-encoded,Nle),包括周期抑制蛋白(Cycle inhibiting factor,Cif)、Tccp(Tircytoskeleton coupling protein)、EspJ 和 NleA、NleC、NleD,同样由Ⅲ型分泌系统分泌。
1.2.1 EspA/B/D 作为转运蛋白,EspA 形成Ⅲ型分泌系统的延伸丝状结构。此丝状结构负责将细菌分泌的包括Tir在内的效应蛋白转运到宿主细胞内[10]。EspB和EspD在此转运过程中同样不可或缺,他们在宿主细胞膜上形成孔,与EspA结合,成为EspA丝状结构的末梢[11]。
1.2.2 EspF/G/H,Map EspF 与 Map共同作用,破坏跨膜阻抗并协助线粒体膜电位的形成,诱导细胞凋亡。其中 Map还可以形成丝足[12]。而EspG与EspH共同作用于对宿主细胞骨架的控制和破坏。其中有研究表明EspG能降低细菌粘附能力[13]。
1.2.3 Tccp 在大肠杆菌O157∶H7形成的AE损伤中,宿主细胞骨架成分(F-肌动蛋白和α-肌动蛋白)的补充依靠另外一种被转入宿主细胞的效应蛋白—Tir细胞骨架偶联蛋白(TccP)[14]。在体外人类HeLa细胞实验中,tccp的突变表达产物尽管粘附得很好,却无法聚集纤维型肌动蛋白。然而在牛的体内实验中,tccp的突变表达产物可以与典型的基座结构结合导致AE损伤。这说明基座结构的形成在体内和体外有不同,可能的原因包括宿主细胞的差异和效应因子在体内环境中所起的作用[15]。
1.2.4 EspJ EspJ能阻止巨噬细胞的吞噬作用,并不参与AE损伤过程[16]。Dahan等人的动物实验表明EspJ能通过阻止宿主的免疫应答来提高定植能力,但是有限的可用证据亦表明EspJ或许能降低细菌存活率[17]。
1.2.5 Cif Cif蛋白由λ形噬菌体编码,许多EHEC和EPEC菌株携带功能性Cif或Cif的变异体。它可在HeLa细胞中触发一个不可逆转的病变效应,表现为局灶性粘附的逐步聚集,应力纤维的装配,以及对细胞周期的抑制作用[18]。有学者提出Cif能在短时间对大量细胞的细胞周期产生抑制作用,比如对肠上皮细胞,这很可能会辅助细菌定居和存活繁殖[19],不过相关研究尚未得到发表。
1.2.6 NleA,NleC,NleD NleA/EspI蛋白由大肠杆菌O157∶H7基因组的噬菌体CP933P编码,集中在宿主细胞高尔基体内,干扰其分泌机制[20-21]。Marche`s等 人 发 现 了 NleC 蛋 白 和 NleD蛋白,并将野生型大肠杆菌O157∶H7菌株及nleC,nleD的等基因突变表达产物分开口服于羊体内,在随后7d里,羊群所排泄的粪便中菌体的密度基本一样,可得出结论:NleC和NleD对大肠杆菌O157∶H7在羊体内的粘附和定居都并非必需的[22]。
1.3 菌毛 菌毛是细菌的一种蛋白性突起,对宿主上皮细胞有粘附作用。这对细菌对宿主的入侵、定居从而打开侵袭的通道起着至关重要的作用。研究已经发现在大肠杆菌O157∶H7中至少有16个菌毛基因簇的表型[23]。Roe等学者发现,由于受到其调控子‘fim开关’中一段大小为16bp的DNA缺失的影响,EHEC O157∶H7无法表达Ⅰ型菌毛[24]。
长极菌毛(Long polar fimbriae,LPF)在大肠杆菌O157∶H7的粘附过程中成为潜在的决定因素。大肠杆菌O157∶H7中有两个lpf基因,他们虽与鼠伤寒沙门氏菌中的lpf位点同源,但并不完全相同[25]。其中任意一个lpf基因位点的突变都能改变大肠杆菌O157∶H7在人体肠道中的粘附嗜性,即粘附范围反常地从回肠小囊上皮细胞(野生型粘附嗜性)扩大到其他小的肠上皮细胞区域[26]。
在特定的培养条件下,Ⅳ型菌毛和‘F9’菌毛可以从大肠杆菌O157∶H7中提取出来。Ⅳ型菌毛可以协助大肠杆菌O157∶H7粘附到人、牛体内和猪内脏中,但是现在还缺乏体内实验验证[27]。在牛体内对其突变体的研究尚未确认‘F9’菌毛在细菌粘附中的作用[28]。发酵山梨醇的EHEC O157∶H菌株能表达只在厌氧条件下才由质粒编码的菌毛,它能提高细菌对人体肠道上皮细胞的粘附能力[29]。
引发2011年德国大规模疫情的菌株被认为是EHEC,却能够表达肠道聚集粘附性大肠杆菌(EAEC)的聚集粘附型菌毛[30]。有学者利用高通量测序技术对菌株的全基因组进行测序,发现此现象是大肠杆菌基因组可塑能力的表现,它得到了不同的大肠杆菌致病型(EAEC,EHEC和ExPEC)的基因[31]。经研究,这些基因是通过大肠杆菌水平基因转移和同源性重组扩展到各个血清型的[32]。
1.4 脂多糖和外膜蛋白A 脂多糖(lipopolysaccharide,LPS)在粘附中具有一些间接的作用。Paton等研究发现LPS的抗体封闭了O157粘附到Henle407细胞,但用LPS的抗体对Henle407细胞进行预处理并不能封闭细菌的粘附,所以推测LPS耐受抗性的粘附是通过位阻机理实现的[33]。而另一些体外研究发现LPS缺失突变株能高度粘附HEp-2细胞,暗示LPS可能遮盖了细菌表面的粘附结构,或者LPS的缺乏导致了细胞的理化特性如表面的电荷或疏水性发生改变。
外膜蛋白OmpA(Outer membrane protein A)广泛的存在于原核生物的细胞外膜中,具有β-桶状结构。Torres等学者通过体外实验证实OmpA作为外膜孔蛋白在EHEC O157∶H7粘附Hela细胞和Caco-2细胞的过程中起重要作用,但是在体内是否有同样的作用不得而知[34]。
2 结 语
EHEC的粘附是一个复杂的过程,其精确的粘附机理还不太不清楚。随着对细菌和宿主相互关系研究的深入,将来可能还会有新的粘附因子被发现。最新的研究多集中于NleC、NleE、EspP等新近发现而其粘附机理不甚明了的粘附蛋白以及HCP等参与菌毛粘附的粘附素。各粘附因子的作用和研究状况的总结如表1所示。研究EHEC的粘附机理有3个重要意义:EHEC致病机理的理论得到进一步完善,更有利于预防和控制该菌引起的疾病;对细菌的血清型鉴定和诊断有重要意义;为EHEC疫苗的开发提供新思路,有助于我们研制用于预防的疫苗。
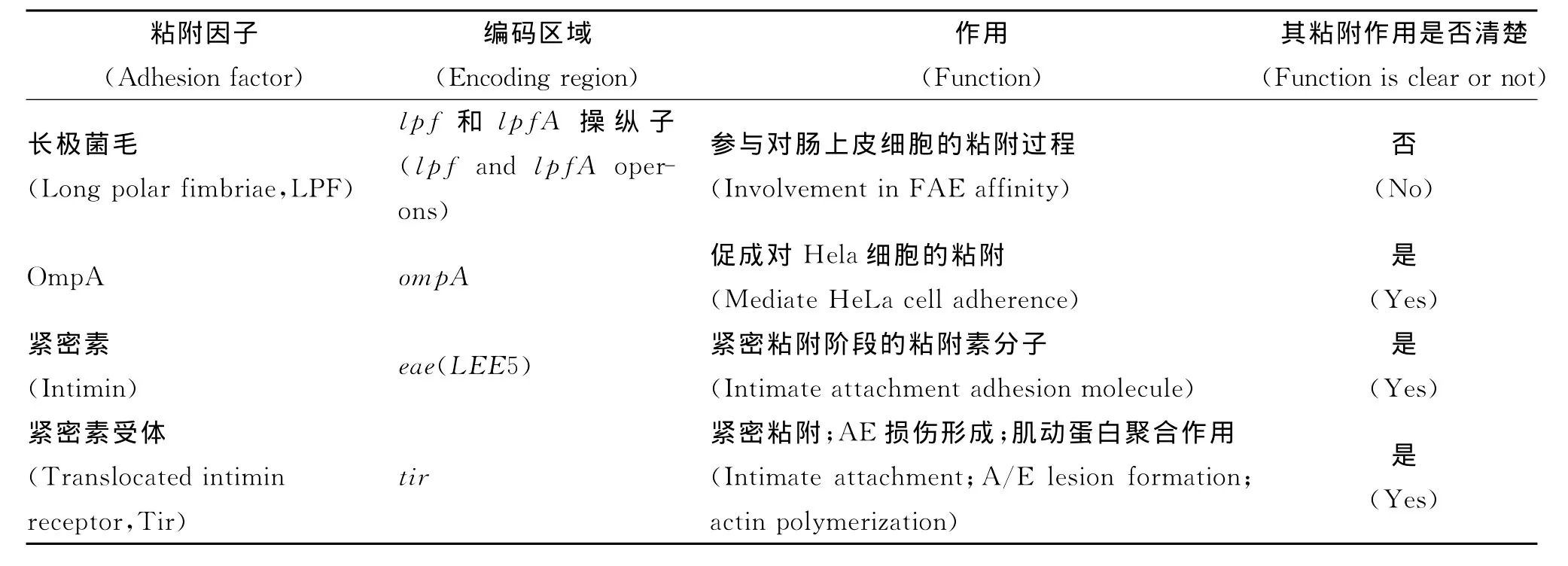
表1 EHEC粘附因子总结Tab.1 Summary of EHEC adhesion factors

续表
[1]Ran Lu.Trends of enterohemorrhagicEscherichiacoli(EHEC)[J].Chin J Food Hygiene,1999,11(3):31-35.(in Chinese)冉陆.肠出血性大肠杆菌(EHEC)流行趋势[J].中国食品卫生杂志,999,11(3):31-35.
[2]Frank C,Faber M,Askar M,et al.Large and ongoing outbreak of haemolytic uraemic syndrome,Germany,May 2011[J].Euro Surveill,2011,16:pii:19878.
[3]WHO.Outbreaks ofE.coliO104:H4infection.[EB/OL].[2011-06-24].http://www.euro.who.int/en/what-we-do/ealth-topics/emergencies/international-health-regulations/news/news/2011/06/ehec-outbreaks-update-24-france-reports-8-cases-in-new-outbreak.
[4]Yang BL,Xu J,Zhu SP,et al.Construction of mutant strain with increased adherence to caco-2cells in enterohemorrhagicEscherichiacoliO157:H7[J].Chin J Health Lab Technol,2004,14(4):418-420.(in Chinese)杨宝兰,徐进,朱淑萍,等.EHEC O157:H7肠粘附力增强突变株的构建[J].中国卫生检验杂志,2004,14(4):418-420.
[5]Woodward MJ,Best A,Sprigings KA,et al.Non-toxigenicEscherichiacoliO157:H7strainNCTC12900causes attachingeffacing lesions andeae-dependent persistence in weaned sheep[J].Int J MedMicrobiol,2003,293:299-308.DOI:10.1078/1438-4221-00264
[6]Batchelor M,Prasannan S,Daniell S,et al.Structural basis for recognition of the translocated intmin receptor(Tir)by intimin from enteropathogenicEscherichiacoli[J].EMBO J,2000,19:2452-2464.DOI:10.1093/emboj/19.11.2452
[7]Reece S,Simmons CP,Fitzhenry RJ,et al.Site-directed mutagenesis of intimin a modulates intimin-mediated tissue tropism and host specificity[J].Mol Microbiol,2001,40:86-98.DOI:10.1046/j.1365-2958.2001.02371.x
[8]Kaper JB,Elliott S,Sperandio V,et al.Attaching and effacing intestinal histopathology and the locus of enterocyte effacement[M].EscherichiacoliO157:H7and Other Shiga Toxin-ProducingE.coliStrains(O'Brien AD & Kaper JB,eds),Washington,DC:ASM Press.1998:163-182.
[9]Allen-Vercoe E,Waddell B,Toh MCW,et al.Amino acid residues within enterohemorrhagicEscherichiacoliO157:H7Tir involved in phosphorylation,alpha-actinin recruitment,and Nckindependent pedestal formation[J].Infect Immun,2006,74:6196-6205.DOI:10.1128/IAI.00753-06
[10]Knutton S,Rosenshine I,Pallen MJ,et al.A novel EspA-associated surface organelle of enteropathogenicEscherichiacoliinvolved in protein translocation into epithelial cells[J].EMBO J,1998,17:2166-2176.DOI:10.1093/emboj/17.8.2166
[11]Ide T,Laarmann S,Greune L,et al.Characterization of translocation pores inserted into plasma membranes by type III secreted Esp proteins of enteropathogenicEscherichiacoli[J].Cell Microbiol,2001,3:669-679.DOI:10.1046/j.1462-5822.2001.00146.x
[12]Thanabalasuriar A,Koutsouris A,Weflen A,et al.The bacterial virulence factor NleA is required for the disruption of intestinal tight junctions by enteropathogenicE.coli[J].Cell Microbiol,2009,12:31-41.DOI:10.1111/j.1462-5822.2009.01376.x
[13]Dong N,Liu L,Shao F.A bacterial effector targets host DHPH domain RhoGEFS and antagonizes macrophage phagocytosis[J].EMBO J,2010,29:1363-1376.DOI:10.1038/emboj.2010.33
[14]Goosney DL,DeVinney R,Pfuetzner RA,et al.EnteropathogenicE.colitranslocated intimin receptor,Tir,interacts directly with alpha-actinin[J].Curr Biol,2000,10:735-738.DOI:10.1016/S0960-9822(00)00543-1
[15]Dziva F,Vlisidou I,Crepin VF,et al.Vaccination of calves with EspA,a key colonisation factor ofEscherichiacoliO157:H7,induces antigen-specific humoral responses but does not confer protection against intestinal colonisation[J].Vet Microbiol,2007,123:254-261.DOI:10.1016/j.vetmic.2007.02.016
[16]Marche`s O,Covarelli V,Dahan S,et al.EspJ of enteropathogenic and enterohaemorrhagicEscherichiacoliinhibits opsonophagocytosis[J].Cell Microbiol,2008,10:1104-1115.DOI:10.1111/j.1462-5822.2007.01112.x
[17]Dahan S,Wiles S,La Ragione RM,et al.EspJ is a prophagecarried type III effector protein of attaching and effacing pathogens that modulates infection dynamics[J].Infect Immun,2005,73:679-686.DOI:10.1128/IAI.73.2.679-686.2005
[18]Nougayrede JP,Boury M,Tasca C,et al.Type III secretiondependent cell cycle block caused in HeLa cells by enteropathogenicEscherichiacoliO103[J].Infect Immun,2001,69:6785-6795.DOI:10.1128/IAI.69.11.6785-6795.2001
[19]Marche`s O,Ledger TN,Boury M,et al.Enteropathogenic and enterohaemorrhagicEscherichiacolideliver a novel effector called Cif,which blocks cell cycle G2/M transition[J].Mol Microbiol,2003,50:1553-1567.DOI:10.1046/j.1365-2958.2003.03821.x
[20]Garmendia J,Phillips AD,Carlier MF,et al.TccP is an enterohaemorrhagicEscherichiacoliO157:H7type III effector protein that couples Tir to the actin-cytoskeleton[J].Cell Mi-crobiol,2004,6:1167-1183.DOI:10.1111/j.1462-5822.2004.00459.x
[21]Kim J,Thanabalasuriar A,Chaworth-Musters T,et al.The bacterial virulence factor NleA inhibits cellular protein secretion by disrupting mammalian COPII function[J].Cell Host Microbe,2007,2:160-171.DOI:10.1016/j.chom.2007.07.010
[22]Marche`s O,Wiles S,Dziva F,et al.Characterization of two non-locus of enterocyte effacement-encoded type III translocated effectors,NleC and NleD,in attaching and effacing pathogens[J].Infect Immun,2005,73:8411-8417.DOI:10.1128/IAI.73.12.8411-8417.2005
[23]Iida K,Mizunoe Y,Wai SN,et al.TypeⅠfimbriation and its phase switching in diarrheagenicEscherichiacolistrains[J].Clin Diagn Lab Immun,2001,8:489-495.DOI:10.1128/CDLI.8.3.489-495.2001
[24]Roe AJ,Currie C,Smith DGE,et al.Analysis of typeⅠfimbriae expression in verotoxigenicEscherichiacoli:a comparison between serotypes O157and O26[J].Microbiology (SGM),2001,147:145-152.
[25]Perna NT,Plunkett G,Burland V,et al.Genome sequence of enterohaemorrhagicEscherichiacoliO157:H7[J].Nature,2001,409:529-533.DOI:10.1038/35054089
[26]Fitzhenry R,Dahan S,Torres AG,et al.Long polar fimbriae and tissue tropism inEscherichiacoliO157:H7[J].Microbes Infect,2006,8:1741-1749.DOI:10.1016/j.micinf.2006.02.012
[27]Xicohtencati-Cortes J,Monteiro-Neto V,Ledesma MA,et al.Intestinal adherence associated with type IV pili of enterohemorrhagicEscherichiacoliO157:H7[J].J Clin Invest,2007,117:3519-3529.DOI:10.1172/JCI30727
[28]Low AS,Dziva F,Torres AG,et al.Cloning,expression,and characterization of fimbrial operon F9from enterohemorrhagicEscherichiacoliO157:H7[J].Infect Immun,2006,74:2233-2244.DOI:10.1128/IAI.74.4.2233-2244.2006
[29]Musken A,Bielaszewska M,Greune L,et al.Anaerobic conditions promote expression of Sfp fimbriae and adherence of sorbitol-fermenting enterohemorrhagicEscherichiacoliO157:NM to human intestinal epithelial cells[J].Appl Environ Microb,2008,74:1087-1093.DOI:10.1128/AEM.02496-07
[30]Croxen MA,Finlay BB.Molecular mechanisms ofEscherichia colipathogenicity[J].Nat Rev Microbiol,2010,8:26-38.DOI:10.1038/nrmicro2265
[31]Kupferschmidt K.Germany.Scientists rush to study genome of lethalE.coli[J].Science,2011,332:1249-1250.DOI:10.1126/science.332.6035.1249
[32]Schubert S,Darlu P,Clermont O,et al.Role of intraspecies recombination in the spread of pathogenicity islands within theEscherichiacolispecies[J].PLoS Pathog,2009,5:e1000257.DOI:10.1371/journal.ppat.1000257
[33]Paton AW,Woodrow MC,Doyle RM,et al.Molecular characterization of a Shiga toxigenicEscherichiacoliO133:H21strain lackingeaeresponsible for a cluster of cases of hemolytic-uremic syndrome[J].J Clin Microbiol,1999,37:3357-3361.
[34]Torres AG,Kaper JB.Multiple elements controlling adherence of enterohemorrhagicEscherichiacoliO157:H7to HeLa cells[J].Infect Immun,2003,71:4985-4995.DOI:10.1128/IAI.71.9.4985-4995.2003

