托瑞米芬逆转肺癌耐药细胞株A549/cDDP耐药性的研究①
刘利则 夏 莉 刘玉侠 段北野 (吉林省人民医院,长春130021)
化疗是恶性肿瘤治疗的主要手段,但是在化疗过程中往往会出现肿瘤细胞对化疗药物的抗药性,影响治疗效果。针对这一问题,众多学者都在探讨能否用药物使这种耐药性逆转同时使肿瘤细胞恢复对药物的敏感性,保证治疗效果。目前研究证实,托瑞米芬(TOR)对多种耐药肿瘤细胞具有逆转和增敏作用[1,2],本研究采用托瑞米芬联合顺铂(cDDP)对耐药细胞A549/cDDP进行逆转和增敏实验,为托瑞米芬治疗非小细胞肺癌耐药细胞提供理论依据。
1 材料与方法
1.1实验材料 肺癌耐药细胞株A549/cDDP:由本课题组建立,经大剂量cDDP冲击12次以后,MTT法检测耐药指数达4.2。枸橼酸托瑞米芬:上海拜力生物有限公司产品;顺铂(cDDP):江苏豪森药业股份有限公司产品;IMDM培养基、MTT、DMSO:购自Sigma。Annexin V/PI双染色细胞凋亡检测试剂盒:购自碧云天公司。
1.2实验方法
1.2.1托瑞米芬(TOR)母液的配制 称取2.99 mg枸橼酸托瑞米芬,溶于5ml DMSO中,加5ml无血清 IMDM,混匀,即500 μmol/L。除菌,分装,常温密闭避光保存。
1.2.2 MTT法测定cDDP及cDDP+TOR联合用药对肺癌耐药细胞株A549/cDDP药物敏感性的影响复苏并培养A549/cDDP细胞至指数生长期,用0.25%胰蛋白酶消化,生理盐水洗涤,计数,用含体积分数10%胎牛血清的IMDM培养液配成浓度为5×104ml-1单个细胞悬液,接种于96孔培养板中,100 μl/well。置于 CO2培养箱中,37℃ 5%CO2,饱和湿度条件下静止培养过夜,倒置显微镜下观察可见细胞已贴壁,生长状态良好。将细胞分为3组:单独cDDP组终浓度分别是 200、100、50、20、10、5 μmol/L,cDDP+TOR(5 μmol/L)组及 cDDP+TOR(10 μmol/L)组。每个药物浓度设4复孔。同时设阴性对照(以等体积的无血清IMDM代之)、阳性对照(含1%DMSO)、TOR(5 μmol/L)对照和 TOR(10 μmol/L)对照。加入受试药物cDDP,终浓度分别是200,100、50、20、10、5 μmol/L,TOR 终浓度 5 μmol/L、10 μmol/L,置37℃,5%CO2,饱和湿度条件下静止培养68小时后加入 MTT(5 mg/ml),20 μl/well,继续培养4 小时,小心吸弃培养上清。加入 DMSO,150 μl/well,震荡10分钟,使结晶物全部溶解后,用全自动酶标仪检测各孔吸光度值(A),波长为492 nm。
1.3计算公式 药物对细胞抑制率=[阳性对照孔吸光度值(A)-加药孔吸光度值(A)]/阳性对照孔吸光度值(A)×100%。半数抑制浓度(IC50)根据曲线方程求得。逆转倍数=cDDP IC50/(cDDP+TOR)IC50。
1.4流式细胞仪检测cDDP及cDDP+TOR联合用药诱导肺癌耐药细胞株A549/cDDP凋亡 实验分组和药物浓度同上,采用Annexin V/PI双染色法检测细胞凋亡,按照试剂盒说明书操作,Coulter XL-MCL流式细胞仪检测,每个样本收集10 000个细胞。
1.5统计学分析 实验均重复3次,应用SPSS11.5统计软件进行统计分析,结果以±s表示,验证两样本资料符合正态分布后采用t检验比较两组间差异。
2 结果
2.1细胞形态学观察 细胞形态学观察见图1A、B、C。
图1 细胞形态学Fig.1 Cell morphology
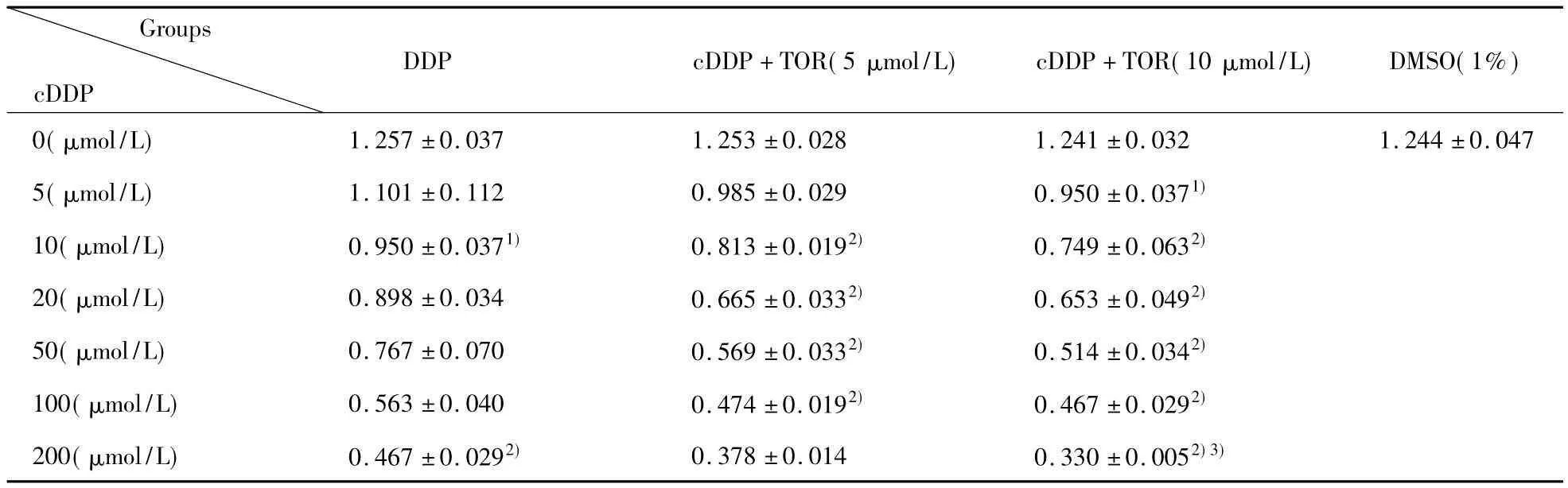
表1 MTT比色试验结果(x ± s,n=6)Tab.1 MTT colorimetric assay results(x ± s,n=6)
2.2TOR的细胞毒性测定 在本实验中,我们加设了TOR(终浓度5 μmol/L)对照和 TOR(终浓度10 μmol/L)对照,实验结果见表1,当cDDP浓度为零时,单独 TOR(终浓度5 μmol/L或终浓度 10 μmol/L),1%DMSO对A549/cDDP细胞的增殖均无明显影响,各组间数据无明显差异(P>0.05)。说明单独应用TOR对细胞无明显毒性,无论终浓度是5 μmol/L或是10 μmol/L,与阳性对照均无明显差异,见表1。
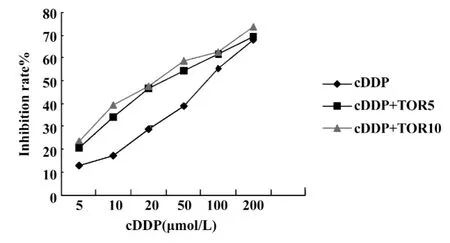
图2 TOR逆转cDDP对A549/cDDP抑制曲线Fig.2 Inhibition curve of TOR reversal cDDP on A549/cDDP
2.3 cDDP+TOR联合用药逆转肺癌耐药细胞株A549/cDDP对cDDP的耐药性 图2为TOR逆转cDDP对A549/cDDP抑制曲线,不同浓度的cDDP对A549/cDDP细胞的增殖都有抑制作用,且随着剂量的增加而加深。当cDDP与TOR联合作用时无论TOR 终浓度5 μmol/L或10 μmol/L,均能明显增加cDDP对A549/cDDP细胞的敏感性(P<0.05,P<0.001)。其 IC50值分别为 39.06 μmol/L和30.64 μmol/L,逆转倍数分别为2.05倍和2.65倍。cDDP+TOR终浓度5 μmol/L与cDDP+TOR终浓度10 μmol/L之间除了在cDDP浓度为200 μmol/L时两者有差异(P<0.05)外其它均无明显差异。
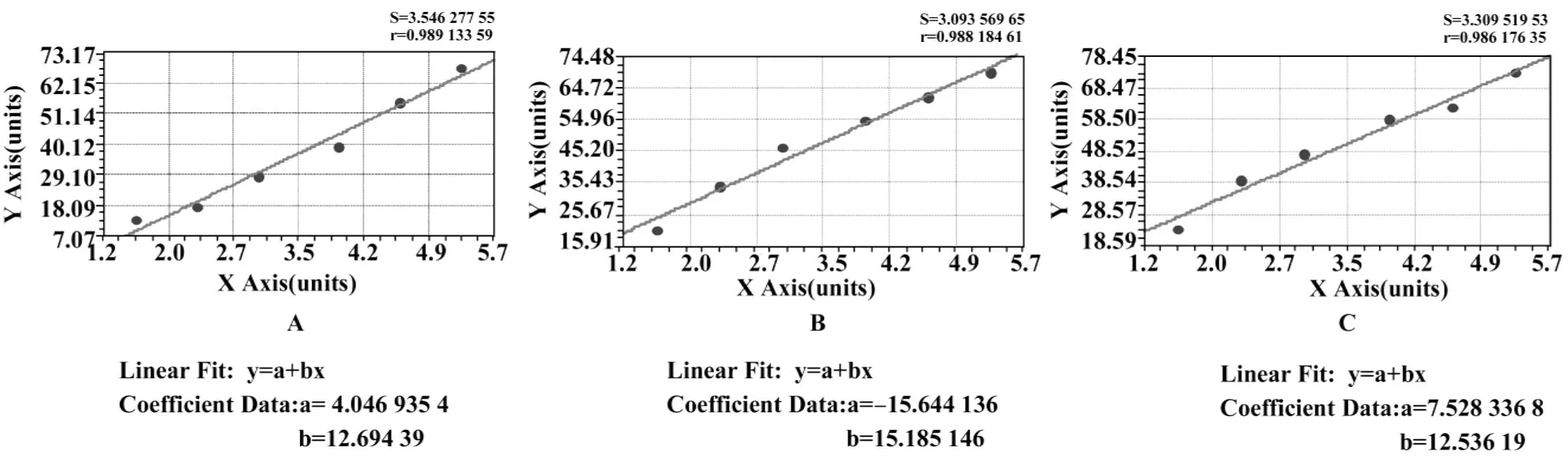
图3 三个实验组的半对数直线回归曲线Fig.3 Semi-logarithmic linear regression curve of three experimental groups

图4 药物对A549/cDDP耐药细胞作用凋亡图Fig.4 Apoptosis figure of A549/cDDP resistant cells
2.4TOR增强细胞对cDDP的敏感性的作用 由图2三组数据我们可以得出3个方程,并由此得出其IC50值。cDDP组:y=-15.644+15.185x,r=0.989,IC50=75.41 μmol/L;cDDP+TOR(终浓度5 μmol/L)组:y=4.047+12.694x,r=0.988,IC50=37.34 μmol/L;cDDP+TOR(终浓度 10 μmol/L)组:y=7.528+12.536x,r=0.986,IC50=29.60 μmol/L。见图3A、B、C。
2.5 cDDP及cDDP+TOR联合用药诱导肺癌耐药细胞株A549/cDDP凋亡 见图4A、B、C。从流式细胞仪检测结果可以看出,对照组细胞A549/cDDP凋亡率只有1.9%,cDDP对A549/cDDP的凋亡率为17.0%,而TOR联合cDDP对A549/cDDP的凋亡率达到52.3%。
3 讨论
目前肺癌发病率和死亡率位居恶性肿瘤第一位,其中非小细胞肺癌(NSCLC)约占肺癌病例总数的80%[3]。由于NSCLC具有天然耐药性及复杂的组织学组成,化疗过程中常引起肺癌细胞对化疗药物产生耐药性,导致化疗不敏感,影响治疗效果。一些研究证实,在肺癌组织中有雌激素受体(Estrogen receptor,ER)的高表达[4],并且 ER 的含量和阳性表达率与肺癌的分化程度和组织学类型及预后相关,使激素受体与肿瘤的关系的研究受到重视[5],这为肺癌的内分泌治疗提供了理论依据,也为肺癌的治疗提供了新方法。
托瑞米芬(Toremifene,TOR)是雌激素受体(Estrogen receptor,ER)拮抗剂,它是由芬兰Faraos研究组于1979年研制的新一代抗雌激素抗肿瘤药物,TOR作为新一代的ER拮抗剂,与传统的ER拮抗剂三苯氧胺相比,具有抗肿瘤特性强、毒副作用小、不致畸、不致癌等,与化疗药物联合具有化疗增敏和逆转耐药作用。
对TOR化疗增敏及逆转肺癌耐药机制研究较多,可能的作用机制有以下几方面[6-8]:TOR通过抑制蛋白激酶C活性,使P糖蛋白磷酸化水平降低,降低其活性,使细胞内化疗药物浓度升高,增加化疗药物的细胞毒性,逆转肺癌多药耐药;肺癌组织雌激素受体表达很高,而TOR是雌激素受体竞争性拮抗剂,通过与雌激素受体结合而对激素依赖性肺癌组织产生明显抑制;TOR对Ca2+的双向调节作用。另外还有研究表明,高浓度的TOR可以诱导肿瘤细胞凋亡。
本实验选用的A549/cDDP耐药细胞,是由本课题组用大剂量cDDP反复多次冲击肺腺癌细胞A549后,建立的稳定表达耐药基因的耐药细胞,经MTT法检测耐药指数达4.2。以此为基础,本实验选用托瑞米芬作为肺腺癌耐药细胞A549的逆转剂和化疗药物cDDP的增敏剂,通过不同剂量TOR与cDDP联合对A549/cDDP进行体外增敏及逆转实验,证明当cDDP与TOR联合作用时无论TOR终浓度5 μmol/L 或 10 μmol/L,均能明显增加 cDDP 对A549/cDDP细胞的敏感性(P<0.05,P<0.001)。其 IC50 值分别为 39.06 μmol/L 和 30.64 μmol/L,逆转倍数分别为2.05倍和2.65倍。从细胞形态学可以看出,TOR与cDDP联合应用时,细胞死亡率明显高于单独应用cDDP组(见图1B、C)。通过流式细胞仪检测TOR对A549/cDDP细胞的凋亡作用,证明当 TOR与 cDDP联合应用时,能明显增加A549/cDDP细胞的凋亡率(52.3%),单独应用cDDP组只有17%(见图4)。从实验结果还可以看出,cDDP+TOR终浓度5 μmol/L与cDDP+TOR终浓度 10 μmol/L之间除了在 cDDP浓度为 200 μmol/L时两者有差异(P<0.05)外,其他均无明显差异。说明在cDDP低浓度时,5 μmol/L的TOR即能起到化疗增敏及逆转作用,避免了大剂量使用可能带来的毒副作用,对临床应用具有指导意义。
1 王红霞,张凤春,楼丽广 et al.托瑞米芬和他莫昔芬对MCF7、ADR多药耐药的逆转作用[J].现代肿瘤医学,2007;15(9):1216-1221.
2 赵秋霞,陈宝安,程 坚 et al.汉防己甲素、托瑞米芬及其联合应用逆转K562细胞多药耐药的研究[J].中国实验血液学杂志,2008;16(1):61-64.
3 Noble J,Ellis P M,Mackay J A et al.Second-line or subsequent system in therapy for recurrent or progressive non-small cell lung cancer:A systematic review and practice guile line[J].J Thorac Oncol,2006;1(9):1042-1058.
4 彭爱梅,苍龙卿,刘蕊凤 et al.肺癌组织雌/孕激素受体表达及三苯氧胺治疗[J].上海铁道大学学报,2000;21(1):59-62.
5 Watanabe T,Inoue S,Ogawa S et al.A gonistic effect of tamoxifen is dependent on cell type,ER E-promoter context,and estrogen receptor subtype:functional difference between estrogen receptors alpha and beta[J].Biochem Biophys Res Commun,1997;236(1):140-144.
6 Miyati Y,Okada K,IshiBashi S et al.P-gp-induced modulation of regulatory volume increase occurs via PKC in mouse proxinal tubule[J].Am J Physiol Renal Physiol,2002;282(1):F65-F76.
7 Kavai H,Ishii A,Washiya K.Estrogen receptor alpha and beta are prognostic factors in non-small cell lung cancer[J].Clin Cancer Res 2005;11(14):5084-5089.
8 丁 娟,曹倍国,彭红华.非小细胞肺癌雌激素受体表达和托瑞米芬治疗现状及进展[J].实用预防医学,2006;13(5):1389-1391.

