早期胃癌淋巴结转移潜在危险因素分析
杨磊磊,戴岳楚,董米连,杨秀英,叶甫波,廖 伟,梅 统
1.浙江省临海市温州医学院附属浙江省台州医院(临海317000)
2.浙江省台州市台州市立医院(台州318000)
3.浙江省温州市温州医学院(温州325000)
早期胃癌(early gastric cancer,EGC)是指癌灶仅限于黏膜层或黏膜下层的胃癌,无论病灶大小及有无淋巴结转移。虽然EGC 被视为可以治愈的癌症[1],目前仍有部分早期胃癌复发死亡,淋巴结转移是EGC 复发的高危因素。我院及浙江省人民医院1995年3月—2010年6月收治EGC 336 例,占同期3758例胃癌手术的8.04%;黏膜内癌142例,占同期3758例胃癌手术的3.78%。现分别对其淋巴结转移潜在危险因素进行分析。
1 资料和方法
1.1 一般资料 本组EGC 336 例,男191 例,女145例;年龄17~89 岁,中位年龄53 岁。均行胃癌根治术(D1 或D2),共检出淋巴结5461 个,平均每例16.25个。其中黏膜内癌142例,男91例,女51例;年龄19~85 岁,中位年龄52 岁。占 全 部EGC 的42.26%,检出淋巴结1543个,平均每例10.87个。
1.2 方法 分别对336例EGC及142例黏膜内癌患者的性别、年龄、肿瘤部位、大体分型、分化程度、溃疡情况、肿瘤大小、浸润深度及脉管癌栓等临床病理特征,进行单因素及多因素分析,找出影响EGC 及黏膜内癌的淋巴结转移潜在危险因素。胃癌的临床病理分期、淋巴结分组分站、肿瘤部位、大体分型、分化程度、肿瘤大小、癌浸润深度和手术操作参照“日本胃癌处理规约”。其中肿瘤的大小按黏膜面最大直径计算;组织学类型分为分化良好(高分化、中分化)、分化不良(低分化癌、未分化癌、印戒细胞癌);大体类型分为隆起型、表浅型(包括浅表隆起型、浅表平坦型、浅表凹陷型)、凹陷型。全部病例规范取材,直径<1.0 cm 病灶全部取材,直径>2.0 cm 选样取材,病灶上、下、左、右取到2 cm 正常胃组织,深度达浆膜或纤维膜,以及肉眼能见到的各组全部淋巴结。光镜观察组织类型、分化、浸润深度和淋巴结转移情况。常规石蜡切片、苏木精-伊红染色。
1.3 统计学方法 采用SPSS 17. 0统计软件进行单因素和多因素Logistic 回归分析。P <0.05 为差异有统计学意义。
2 结果
2.1 淋巴结转移 336 例EGC 共检出34 例发生淋巴结转移,占所有病例的10.12%,转移淋巴结个数78 个(均为第1 站),占所有检出淋巴结的1.43%。142 例黏膜内癌共检出5 例发生淋巴结转移,占3.52%(5/142),转移淋巴结个数8 个(均为第1 站),占检出淋巴结的0.52%(8/1543)。
2.2 EGC 淋巴结转移潜在危险因素单因素分析EGC 淋巴结转移潜在危险因素与淋巴结转移显著性相关的因素有,患者性别(P=0.01)、年龄(P=0.013)、肿瘤部位(P=0.042)、有无合并溃疡(P=0.001)、浸润深度(P<0.0001)、有无脉管癌栓(P<0.0001)。单因素分析结果显示,女性、年龄≤60岁、肿瘤位于胃下区、合并有溃疡、浸润至黏膜下层、伴有脉管癌栓的患者,有更多的淋巴结转移几率。见表1。
2.3 EGC 淋巴结转移潜在危险因素多因素分析多因素分析显示,合并有溃疡(P=0.012)、浸润至黏膜下(P=0.008)及有脉管癌栓(P=0.001)是淋巴结转移的独立性危险因素,三个指标的OR 值均>1, 分别为3.398、4.504、11.400。其淋巴结转移的危险性分别是无溃疡、黏膜内癌及有脉管癌栓的3.398倍、4.504 倍和11.400 倍。合并有溃疡、浸润至黏膜下层及伴有脉管癌栓的患者,有更多的淋巴结转移几率。见表2。
2.4 黏膜内癌淋巴结转移潜在危险因素单因素分析 黏膜内癌淋巴结转移潜在危险因素与淋巴结转移显著性相关的因素有,肿瘤部位(P=0.007)及肿瘤大小(P=0.010)。单因素分析结果显示,肿瘤位于胃下区及肿瘤直径>20 mm的患者有更多的淋巴结转移几率。见表3。

表1 EGC淋巴结转移潜在危险因素的单因素分析
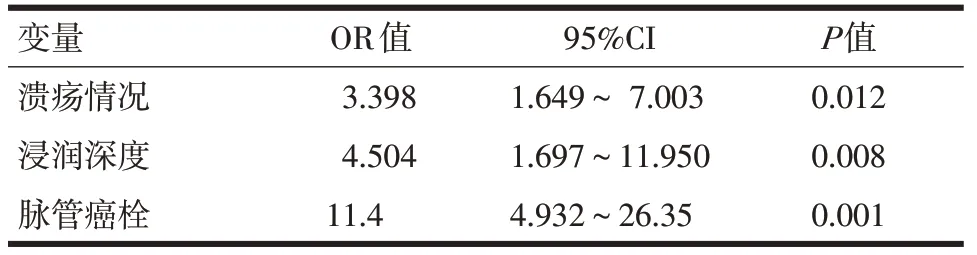
表2 EGC淋巴结转移潜在危险因素的多因素分析
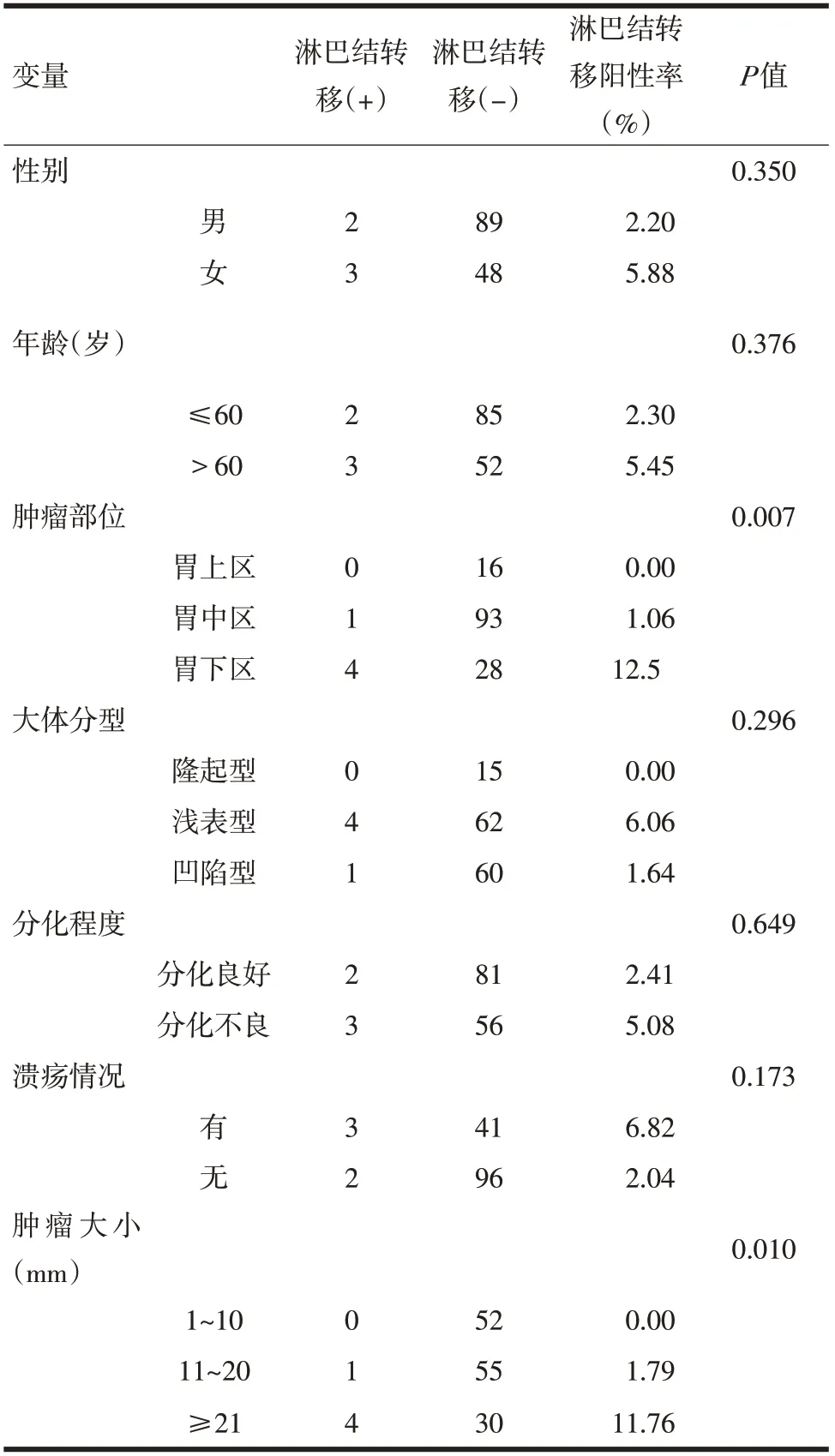
表3 黏膜内癌淋巴结转移潜在危险因素的单因素分析
2.5 黏膜内癌淋巴结转移潜在危险因素多因素分析 多因素分析显示,只有肿瘤直径>20 mm(P=0.041)是黏膜内癌淋巴结转移的独立性危险因素,OR 值>1, 为10.372,其淋巴结转移的危险性是肿瘤直径≤20 mm的10.372倍。肿瘤直径>20 mm的患者有更多的淋巴结转移几率。见表4。

表4 黏膜内癌淋巴结转移潜在危险因素的多因素分析
3 讨论
EGC 患者因早期多无症状,检出率较低。国内大量文献报道,检出率在5%~15%,而日本EGC 的检出率达到60%。本组患者EGC 检出率为8.04%。胃镜检查结合镜下组织活检,使EGC的确诊率明显提高。但是否伴有淋巴结转移,术前尚无法判断。本组336 例患者,均是经术后病理确诊淋巴结转移。Borie 等[2-5]报道,EGC 的淋巴结转移率大约8%~20%。本组资料表明,EGC 淋巴结转移率为10.21%。Hosokawa 等[6,7]报道,黏膜内癌的淋巴结转移率大约2%~3%,而浸润至黏膜下层癌的淋巴结转移率为15%~20%。本组资料表明,黏膜内癌的淋巴结转移率为3.5%,而浸润至黏膜下层癌的淋巴结转移率为14.6%。
手术方式的合理选择,有赖于术前或术中对淋巴结转移状态的准确评估。目前尚无一种非常有效的方法,能够在术前就明确是否有淋巴结的转移。本研究通过对336例EGC的临床病理资料进行单因素分析,发现女性、年龄≤60 岁、肿瘤位于胃下区、合并有溃疡、浸润至黏膜下层、伴有脉管癌栓的患者,有更多的淋巴结转移几率。这与Li 等[8]报道的结果基本一致。但本研究却发现,女性及合并有溃疡的患者,更易发生淋巴结转移。推测认为可能与女性性激素及溃疡病灶对黏膜的破坏等因素有关,对此,有待今后进一步研究探索。由于女性及合并有溃疡的患者更易出现淋巴结转移,因此临床上选择内镜微创手术还是外科根治手术时,性别和有无合并溃疡便视为不可忽视的因素。多因素分析发现,合并有溃疡(P=0.012)、浸润至黏膜下(P=0.008)及有脉管癌栓(P=0.001),是EGC 淋巴结转移的独立性危险因素。三个指标的OR 值均>1,分别为3.398、4.504、11.400,其淋巴结转移的危险性分别是无溃疡、黏膜内癌及有脉管癌栓的3.398倍、4.504倍和11.400倍。这与Kim等[9]报道的结果基本一致。临床上选择手术方式时,溃疡情况、浸润深度及脉管癌栓情况是非常重要的因素。由于术前较难判断有无脉管癌栓,因此,溃疡情况及浸润深度就成为更有价值的参考指标。临床上,EGC 手术方式选择争论焦点,是黏膜内癌内镜下切除是否彻底,根治术有无必要等。为此,本研究进行了较为深层的探讨,将局限于黏膜内的EGC单独进行分析。单因素分析发现,肿瘤位于胃下区及肿瘤直径>20 mm 的患者,有更多的淋巴结转移几率。Kim 等[10]也报道,肿瘤直径>20 mm 的EGC 患者有更多的淋巴结转移机率。本组资料显示,肿瘤直径>20 mm 只在黏膜内EGC 中有显著性(P=0.01)。临床上,黏膜内EGC 选择手术方式时,肿瘤部位和肿瘤大小便视为不可忽视的因素。多因素分析发现,只有肿瘤直径>20 mm(P=0.041)是黏膜内EGC 淋巴结转移的独立性危险因素,OR 值>1, 为10.372,其淋巴结转移的危险性是肿瘤直径≤20 mm的10.372倍。本资料显示,肿瘤直径是黏膜内EGC决定手术方式最有价值的参考指标。值得一提的是,本资料提示,低分化肿瘤并不能增加EGC 淋巴结转移几率(P=0.439),也不能增加黏膜内EGC 淋巴结转移几率(P=0.649)。这与Park[11]报道的肿瘤分化程度与淋巴结转移没有相关性相一致。
EGC 的治疗方法包括内镜下黏膜切除术或内镜黏膜下剥离术、胃楔形切除术、D1 或D2 根治术(开放或腔镜)。日本EGC 治疗主要采用内镜下黏膜切除术或内镜黏膜下剥离术,我国则以D1 或D2根治术为主要术式。EGC 的预后与有无淋巴结转移密切相关,国内相关临床病理学资料表明:有淋巴结转移和无淋巴结转移的EGC其5年存活率分别为84.3%~88.7%和97.5%~98.0%。因此,淋巴结清扫是否彻底是影响EGC预后的重要因素。本研究结果显示,合并有溃疡、浸润至黏膜下层及有脉管癌栓是EGC淋巴结转移的独立危险因素,肿瘤直径>20 mm是黏膜内癌淋巴结转移的独立危险因素。因此,对于合并有溃疡、浸润至黏膜下层及有脉管癌栓的EGC患者进行手术时建议行D2 术;对于肿瘤直径>20 mm的黏膜内癌也应考虑行D2术。
总之,通过研究淋巴结转移潜在危险因素,结合术前内镜超声、增强CT、胃镜活检及腹腔镜检查等,评估早期胃癌, 特别是黏膜内癌的淋巴结转移风险,选择合适的手术方式,规划合理的手术范围,在保证肿瘤清扫的同时,应尽可能提高患者的生活质量,做到个体化治疗。
[1]Chung IK, Lee JH, Lee SH , et al. Therapeutic outcomes in 1000 cases of endoscopic submucosal dissection for early gastric neo⁃plasms: Korean ESD Study Group multicenter study [J]. Gastroin⁃test Endosc,2009,69(7):1228-1235.
[2]Borie F, Plaisant N, Millat B, et al. Appropriate gastric resection with lymph node dissection for early gastric cancer [J]. Ann Surg Oncol,2004,11(5):512-517.
[3]Yuasa N,Nimura Y. Survival after surgical treatment of early gas⁃tric cancer: surgical techniques and long-term survival [J]. Langen⁃becks Arch Surg,2005,390(4):286-293.
[4]Kunisaki C,Akiyama H, Nomura M, et al. Surgical outcomes for early gastric cancer in the upper third of the stomach [J]. J Am Coll Surg 2005,200(1),15-19.
[5]Lee JH, Choi IJ, Kook MC, et al. Risk factors for lymph node me⁃tastasis in patients with early gastric cancer and signet ring cell histology [J]. Br J Surg,2010,97(5):732-736.
[6]Hosokawa O, Kaizakei Y, Hattory M, et al. Endoscopic findings of intramucosal gastric cancer with metastasis [J]. Stomach and Intes⁃tine, 2006, 41(8): 1141- 1149.
[7]Ichikura T, Chochi K, Sugasawa H, et al. Individualized surgery for early gastric cancer guided by sentinel node biopsy [J]. Sur⁃gery, 2006,139(4): 501-507.
[8]Li C, Kim S, Lai JF, et al. Risk factors for lymph node metastasi⁃sin undifferentiated early gastric cancer [J]. Ann Surg Oncol,2008,15(3): 764-769.
[9]Kim KJ, Park SJ, Moon W,et al. Analysis of factors related to lymph node metastasis in undifferentiated early gastric cancer [J].Turk J Gastroenterol,2011,22(2):139-144.
[10]Kim DY, Joo JK, Ryu SY, et al. Factors related to lymph node me⁃tastasis and surgical strategy used to treat early gastric carcinoma[J]. World J Gastroenterol,2004,10(5): 737-740.
[11]Park YD, Chung YJ, Chung HY, et al. Factors related to lymph node metastasis and the feasibility of endoscopic mucosal resection for treating poorly differentiated adenocarcinoma of the stomach[J]. Endoscopy,2008,40(1):7-10.

