IL-13Rα2、VEGF和PTEN在星形细胞瘤中的表达及临床意义
涂明,郑伟明,李建敏,黄卡特
(温州医学院附属第一医院,浙江 温州 325000,1.神经外科;2.病理科)
星形细胞瘤是最常见的神经上皮性肿瘤约占胶质瘤总数的1/3。尽管近几年来脑肿瘤的外科技术、放疗、化疗等综合治疗技术有较大的发展,但星形细胞瘤的总体生存率仍非常低。近年研究发现白细胞介素13受体α2(IL-13Rα2)在恶性胶质瘤细胞表面存在特异性的高表达,并指出其不仅可以作为恶性胶质瘤诊断特异性的标志物,且可能与胶质瘤的恶性增殖存在密切的关系[1-2]。血管内皮生长因子(VEGF)的表达不仅与肿瘤血管的形成有关,还可反映肿瘤血管的生成量,其表达水平还与肿瘤组织的生物学行为密切相关[3-4]。PTEN(人10号染色体上缺失的磷酸酶和张力蛋白类似物)是于1997年发现的第一个具有磷酸酶活性的抑癌基因,它的变异与多种肿瘤有关,而脑胶质瘤是与PTEN基因缺失及突变关系最为密切的恶性肿瘤之一[5-6]。本研究应用免疫组化方法检测37例人脑星形细胞瘤标本中IL-13Rα2、VEGF和PTEN的表达,探讨它们与星形细胞瘤的临床病理分级和生物学行为的关系以及三者之间的相关性,以期为这三者在脑星形细胞瘤基因治疗方面的可行性提供科学的实验依据。
1 材料和方法
1.1 材料 选取2008年2月-2010年11月本院病理科保存的人脑星形细胞瘤石蜡标本,其来源中男19例,女18例,年龄10~79岁,平均(46.24±9.61)岁。本组均为手术切除,均经HE染色明确为星形细胞瘤,病历资料保存完整。按WHO(2000年)中枢神经系统肿瘤分类及分级标准:低级别星形细胞瘤17例(WHOI~II级),高级别星形细胞瘤20例(WHOIII~IV级)。所有病人术前均未接受化疗、放疗或免疫治疗。出于医学伦理道德因素的考虑,IL-13Rα2、VEGF和PTEN在正常脑组织中的表达均参照相关文献[1,3,5]。
1.2 方法
1.2.1 检测方法:应用免疫组织化学染色法对37例人脑星形细胞瘤标本中的IL-13Rα2、VEGF和PTEN的表达进行检测。分别观察此三项指标在不同性别病人、不同肿瘤直径(分两组:<5 cm和≥5 cm)等临床病理因素中的阳性表达情况。
1.2.2 结果判断:参考Kawakami等[7]在头颈部肿瘤中检测IL-13Rα2表达的免疫组化结果,肿瘤细胞浆内出现棕黄色或(和)棕褐色颗粒即是阳性细胞。VEGF阳性表达为细胞浆中出现棕黄色颗粒,PTEN阳性表达为细胞质中出现棕黄色颗粒。每张切片在肿瘤区随机选择5个不同的高倍视野(400倍),并统计分析观察视野中肿瘤细胞阳性表达的比率:阳性细胞百分比<10%为阴性(-),10%~25%为弱阳性(+),25%~50%为阳性(++),>50%为强阳性(+++)。正常脑组织中未见IL-13Rα2和VEGF的表达[8], PTEN的表达率在90%以上[9]。
1.2.3 随访条件及方法:条件:患者术前Karnofsky评分≥70分;术后曾行放疗或化疗。方法:主要以电话随访和门诊随访两种方式。
1.3 统计学处理方法 应用SPSS12.0统计学软件进行统计学分析。三者的表达与病理分级及临床病理因素之关的差异采用秩和检验,三者相关性分析采用Spearman等级相关分析。P<0.05为差异有统计学意义。
2 结果
2.1 免疫组化染色结果 IL-13Rα2阳性染色主要表现为细胞浆内出现棕黄色或(和)棕褐色颗粒(见图1-2),VEGF阳性染色主要表现为细胞浆中出现棕黄色颗粒(见图3-4),PTEN阳性染色主要表现为细胞质中出现棕黄色颗粒(见图5-6)。IL-13Rα2、VEGF和PTEN在不同级别星形细胞瘤中的表达(见表1)发现高级别星型细胞胶质瘤IL-13Rα2和VEGF表达明显(P<0.05),而低级别星型细胞胶质瘤PTEN表达明显(P<0.05)。

图1 IL-13Rα2在低级别星型胶质细胞瘤呈阳性表达(×400)
图2 IL-13Rα2在高级别星形细胞瘤呈阳性表达

图3 VEGF在低级别星型胶质细胞瘤呈阳性表达(×400)

图4 VEGF在高级别星形细胞瘤呈阳性表达
图5 PTEN在低级别星型胶质细胞瘤呈阳性表达(×400)
图6 PTEN在高级别星形细胞瘤呈阳性表达

表1 IL-13Rα2、VEGF和PTEN在不同病理级别星形细胞瘤中的表达
2.2 IL-13Rα2、VEGF和PTEN在星形细胞瘤的表达与临床病理因素的关系 见表2。
2.3 星形细胞瘤中IL-13Rα2、VEGF和PTEN蛋白表达的相关性 相关性研究表明,在人星形细胞瘤中IL-13Rα2、VEGF和PTEN蛋白表达中,PTEN与IL-13Rα2、VEGF呈负相关(P<0.05),IL-13Rα2和VEGF蛋白表达呈正相关(P<0.05),具体见表3。

表2 IL-13Rα2、VEGF和PTEN在星形细胞瘤的表达与临床病理因素的关系
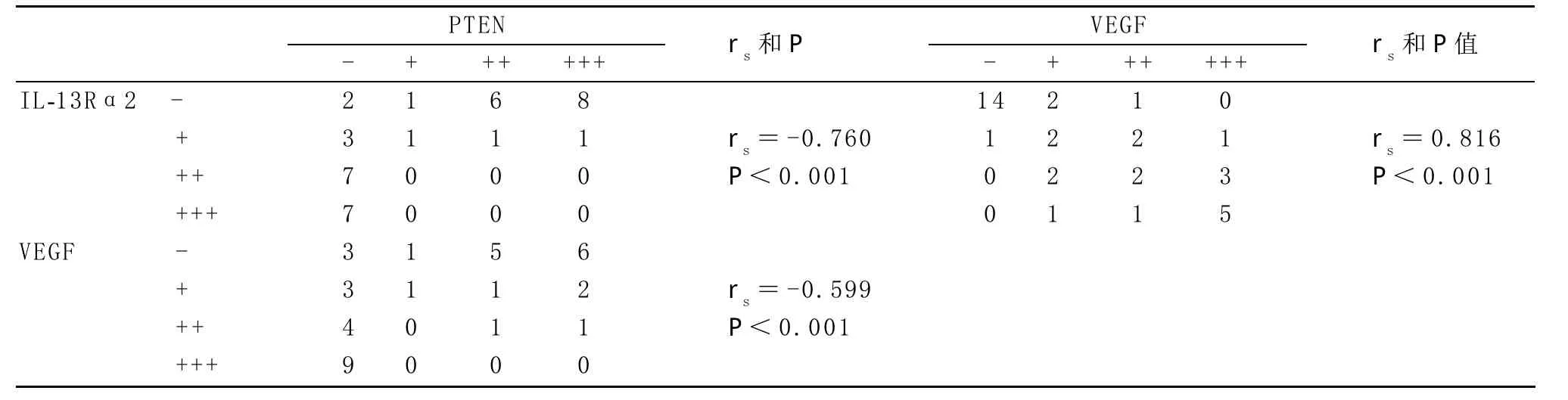
表3 星形细胞瘤中IL-13Rα2、VEGF和PTEN蛋白表达的相关性
3 讨论
3.1 IL-13Rα2、VEGF、PTEN与星形细胞瘤 IL-13Rα2是一种诱骗性的受体,与IL-13有着相当高的亲和力,缺乏与JAK激酶(Jak蛋白酪氨酸激酶)结合、启动信号传递所必须的box1、box2功能域。IL-13Rα2参与胶质瘤的恶性增殖过程机制尚可能是:Kawakami等[10]研究发现在正常的胶质细胞和脑胶质瘤细胞中,IL-4和IL-13通过和由IL-4Rα、IL-13Rα1组成的二聚体结合激活JAK STAT6(Janus激酶-信号转导子和转录激活子)信号转导途径,防止胶质细胞的有丝分裂并最终导致胶质细胞生长。而IL-13Rα2通过和IL-4Rα结合使由IL-4Rα、IL-13Rα1组成的二聚体失活,最终导致了胶质细胞的无限生长。另外,Rahaman等[11]的研究表明它与IL-13高亲和力结合而竞争性抑制IL-13与IL-13Rα1结合以后激活的JAK STAT6途径,同样可能是其参与胶质瘤恶性增殖的机制。
Folkman等[12]1992年研究指出,由肿瘤细胞分泌和激活的内皮因子,如VEGF、碱性成纤维细胞生长因子、转化生长因子β等在肿瘤新生血管形成中起重要作用。其中VEGF是刺激肿瘤间质和新生血管形成的最关键因子。VEGF对肿瘤血管生成的作用有三个方面:①特异性促进血管内皮细胞增殖;②提高血管通透性,引起血浆蛋白从血管内渗漏到血管外区域;③刺激内皮细胞产生PAS,从而促进渗漏到血管外区域的血浆蛋白形成纤维蛋白凝块,作为血管新生的支持物。
PTEN是迄今发现的第一个具有磷酸酶活性的抑癌基因。PTEN的变异与多种肿瘤有关,而脑胶质瘤与PTEN基因缺失及突变关系最为密切[13]。PTEN参与IL-13Rα2在胶质瘤的恶性增殖过程的机制:①负调控PI3K/AKT通路。PI3K/AKT是重要的信号通路,使细胞永生化,促进正常血管发育和肿瘤血管形成。PTEN是脂质磷酸酶,使PIP3(3,4,5-三磷酸磷脂酰肌醇)脱膦酸,阻断PI3K/AKT通路。若PTEN失活,PI3K/AKT持续活化,导致细胞分裂,体积增大,凋亡阻滞和肿瘤血管形成等[14]。②抑制细胞周期。PTEN使PIP3脱膦酸,阻断PI3K调控的生长因子信号通路,维持细胞正常的生长周期。但PTEN缺失导致PIP3堆积,激活PDKs、mTOR、AKT等,使细胞恶性转化;而PTEN过表达使细胞阻滞于G1期。③诱导细胞凋亡。抑制PI3K/AKT,激活capase-3、capase-9,促进凋亡。④抑制肿瘤血管的形成。
3.2 IL-13Rα2、VEGF和PTEN三者之间的相关性
VEGF受体(VEGFR)是VEGF生物信号传导级联通路的门户,VEGF与其结合后使VEGFR二聚体化,形成同源二聚体或异源二聚体,从而启动受体后信号传导途径。二聚体形成启动受体酪氨酸激酶激活导致其自身磷酸化,受体自身磷酸化可以激活其他蛋白,启动下游通路包括一系列第二信使的激活。IL-13Rα2尾部的亚基可与受体酪氨酸激酶相结合并使其活化,加速与VEGFR结合的过程,也许可以解释IL-13Rα2与VEGF之间相关性的机制。
研究表明,PTEN能直接作用于FAK酪氨酸使其去磷酸化,从而抑制整合素介导的细胞铺展、浸袭和骨架排列[15]。星形细胞瘤中存在IL-13Rα2的表达,增强了其对IL-13的敏感性。IL-13可以上调整合素,也许可以解释IL-13Rα2与PTEN之间的关联性。PTEN编码双重底物特异性磷酸酶,具有脂质磷酸酶和蛋白磷酸酶双重活性,有可能降解人IL-13Rα2跨膜蛋白,同时可能影响与IL-13Rα2与IL-13及IL-4Rα的结合,无法阻断JAK STAT6信号转导途径。已有研究显示PI3K/Akt/mTOR可能是调控细胞内HIF1表达和活性的一条重要信号[16]。HIF1结合于VEGF基因启动子中的HRE,为诱导VEGF表达的重要分子机制,PTEN蛋白对PI3K/Akt/mTOR通路有负性调节作用,故PTEN基因通过PI3K/Akt/mTOR途径而影响VEGF表达。PTEN还可抑制肿瘤血管的形成,通过:①PTEN缺失,上调VEGF介导的血管内皮细胞增殖;②PTEN突变,上调VEGF启动子活性,增加mRNA表达[17]。
[1] Kawakami K, Kawakami M, Puri RK. Specifically targeted killing of interleukin-13(IL-13) receptor-expressing breast cancer by IL-13 fusion cytotoxin in animal model of human disease[J].Mol Cancer Ther,2004,3(2):137-147.
[2] 郑伟明,章剑剑,李剑敏,等. 星形细胞瘤IL-13Rα2的表达及其与预后的关系[J].中华神经外科杂志, 2006,22(5):324.
[3] Schweda F, Blumberg FC, Schweda A, et al. Effects of chronic hypoxia on renal PDGF-A,PDGF-B,and VEGF gene expression in rats[J].Nephron,2000,86(2):161-166.
[4] 王树兴,于春玲,李少梅,等. 星形细胞瘤组织CD105和VEGF及TGF-β1表达与血管生成关系的研究[J]. 中华肿瘤防治杂志, 2008,15(22):1731-1733.
[5] Yue Q, Groszer M, Gil JS, et al. PTEN deletion in Bergmann glia leads to premature differentiation and affects laminar organization[J].Development,2005,132(14):3281-3291.
[6] 刁宏宇, 吴永刚, 李少一, 等. PTEN蛋白在人脑星形细胞瘤中的表达及意义[J].中国医科大学学报, 2006,35(5):532-533.
[7] Kawakami M,Kawakami K,Kasperbauer JL,et al. Interleukin 13 receptor alpha2 chain in human head and neck cancer serves as a unique diagnostic marker[J].Clin Cancer Res,2003,9(17):6381-6388.
[8] Knizetova P,Darling JL,Bartek J.Vascular endothelial growth factor in astroglioma stem cell biology and response to therapy[J].Cell Mol Med,2008,12(1):1111-1125.
[9] Koul D. PTEN signaling pathways in glioblastoma[J].Cancer Biol Ther,2008,7(9):1321-1325.
[10]Kawakami K,Taguchi J,Murata T,et al.The interleukin-13 receptor alpha2 chain:an essential component for binding and internalization but not for interleukin-13-induced signal transduction through the STAT6 pathway[J].Blood,2001,97(9):2673-2679.
[11]Rahaman SO,Sharma P,Harbor PC,et al. IL-13R(alpha)2, a decoy receptor for IL-13 acts as an inhibitor of IL-4-dependent signal transduction in glioblastoma cells[J].Cancer Res,2002,62(4):1103-1109.
[12] Folkman J.The role of angiogenesis in tumor growth[J].Semin Cancer Biol,1992,3(2):65-71.
[13]Yue Q,Groszer M,Gil JS,et al.PTEN deletion in Bergmann glia leads to premature differentiation and affects laminar organization[J]. Development,2005,132(14):3281-3291.
[14]Hamada K,Sasaki T,Koni PA,et al.The PTEN/PI3K pathway governs normal vascular development and tumor angiogenesis[J].Genes Dev,2005,19(17):2054-2065.
[15]Yamada KM,Araki M.Tumor suppressor PTEN:modulator of cell signaling, growth,migration and apoptosis[J].Cell Sci,2001,114(Pt 13):2375-2382.
[16]Bardos JI, Chau NM, Ashcroft M. Growth factor-mediated induction of HDM2 positively regulates hypoxia-inducible factor 1alpha expression[J].Mol Cell Biol,2004,24(7):2905-2914.
[17]Li YM,Zhou BP,Deng J,et al. A hypoxia-independent hypoxia-inducible factor-1 activation pathway induced by phosphatidylinositol-3 kinase/Akt in HER2 overexpressing cells[J].Cancer Res,2005,65(8):3257-3263.

