特异性IgG抗体在异种/同种异株疟原虫感染治愈后P.y17XL再感染中的保护作用
秦晓松,王庆辉,刘军,冯永辉,曹雅明
(1.中国医科大学附属盛京医院检验科,辽宁沈阳110004;2.中国医科大学基础医学院免疫学教研室,辽宁沈阳110001)
疟疾是目前对人类健康危害最为严重的原虫感染性疾病之一。最新的统计资料显示,全球100多个国家的33亿人口生活于疟疾风险区,每年有近百万人因罹患疟疾而死亡。为此,世界卫生组织(WHO)等已将其列为优先防治的三大感染性疾病之一[1]。疟疾流行的显著特征之一是疟疾流行区的人群普遍存在2种或2种以上疟原虫的混合感染,以及同种异株或异种疟原虫虫株的再感染现象[2-3]。因此,研制开发有效的疟疾疫苗和抗疟新药已成为疟疾治疗迫切需要解决的重点课题。然而,当前国内外关于再感染的研究多集中于疫苗靶位的筛选和抗疟药物的开发[4-5],而宿主保护性免疫应答的相关机制迄今尚未系统阐明。疟原虫混合感染可使其感染进程和宿主的免疫应答模式明显有别于单一疟原虫感染[6]。研究表明,疟原虫虫株之间存在交叉抗原,其刺激机体产生的抗体对不同疟原虫的再感染具有一定的交叉保护效应。为此,本研究通过用P.y17XL虫株再攻击不同疟原虫初次感染治愈的小鼠,监测原虫血症及生存期,并检测了再感染小鼠血清中特异性抗体的水平,旨在明确初次感染治愈产生的抗体对同/异种疟原虫再感染的保护效应,以期为疟疾疫苗开发及抗疟新药的研制提供必需的前提依据。
1 材料与方法
1.1 材料
1.1.1 实验动物和疟原虫6~8周、雌性BALB/c小鼠由中国医学科学院实验动物研究所提供(许可证编号:SCXK京2007-0001);P.yoelii17XL(P.y17XL)、P.yoelii17XNL(P.y17XNL)、P.c chabaudi AS(P.cAS)、P.berghei ANKA(P.b ANKA)、P.vinckei(P.v)(日本爱媛大学分子寄生虫学教研室惠赠)。
1.1.2 实验动物感染BALB/c小鼠经腹腔分别感染1×106P.y17XNL、P.cAS、P.bANKA或P.v寄生的红细胞(pRBC),待初次感染后3 d,经口给予青蒿琥脂片(购自桂林南药股份有限公司)60 mg/kg体重,氯喹(购自上海中西药业有限公司)90 mg/kg体重,1次/d,连续3 d。小鼠经尾静脉采血,制备薄血膜,Giemsa染色,光学显微镜计数红细胞感染率,原虫血症为0认为小鼠治愈。上述治愈小鼠分别记为P.y17XNL immunized、P.c immunized、P.b immunized及P.v immunized组,正常未经感染的小鼠为control组。留取部分未治疗小鼠(10只)用以观察存活率。
1.2 方法
1.2.1 血清收集和脾细胞培养再感染P.y17XL小鼠分别于感染后第0天和第4天,通过眼球取血收集血液,分离血清,用于检测特异性IgG、IgG1和IgG2a抗体。并同时常规无菌取出小鼠脾脏,用RPMI1640培养液制备浓度为1×107个/mL脾细胞悬液,于24孔培养板中培养48 h后,收集培养上清,-80℃保存,用于IFN-γ检测。
1.2.2 细胞因子检测双抗体夹心ELISA试剂盒检测脾细胞培养上清中IFN-γ产生水平。酶标仪测定450 nm处OD值。结果以试剂盒提供的标准品绘制标准曲线,应用SoftMax Pro 4.3.1Ls软件分析,计算细胞因子含量(pg/mL)。
1.2.3 P.y17XL抗原的制备感染1×106P.y 17XL的BALB/c小鼠血液(原虫血症约达30%)通过灭菌纤维素CF11除去白细胞,用PBS稀释感染血液至10%压积,经45%Percoll(体积比)分离、收集P.y17XL感染红细胞,要求WBC≤5个/10油镜视野,感染率≥60%[7]。感染血样经皂甙裂解、-80℃冷冻30 min,40℃水浴解冻,反复冻融3次,PBS洗3次,P.y17XL颗粒抗原冰浴条件下超声处理,设置电压450 V,共超声粉碎15次,每次20 s,每次间隔90 s,离心,上清即为P.y17XL可溶性抗原,经核酸蛋白分析仪测蛋白质含量,置-80℃冰箱备用。
1.2.4 血清特异性抗体检测以P.y17XL可溶性抗原(10 μg/mL)包被酶标板,100 μL/孔,4℃过夜,5%FCS封闭1 h,洗涤后加入1∶200稀释的抗血清,37℃2 h。洗涤后加入HRP-羊抗鼠IgG或IgG1、IgG2a(1∶500)100 μL/孔,37℃1 h,洗涤。加OPD-H2O2底物显色15 min,2 mol/L H2SO4终止反应。酶标仪检测492 nm处OD值。1.2.5统计学处理应用SPSS 11.5统计学分析软件。双尾student-t检验分析比较各组均值的显著性差异,P<0.05为差异显著。
2 结果与分析
2.1 再感染小鼠原虫血症水平及其生存率
如图1所示,小鼠经不同虫株初次感染并治愈,在再感染P.y17XL后第2~5天,P.c、P.b、P.v组小鼠的外周血红细胞感染率逐渐升高,除P.c组外,其余2组的原虫血症的峰值水平均低于P.y17XL初次感染鼠(control);而同种异株的P.y17XNL组小鼠可完全抵御P.y17XL再感染,其外周血中红细胞感染率始终为0,所有小鼠全部存活,而P.c和P.v组小鼠于再感染后7~9 d全部死亡,再感染后20 d P.b组小鼠的存活率为50%(图1)。
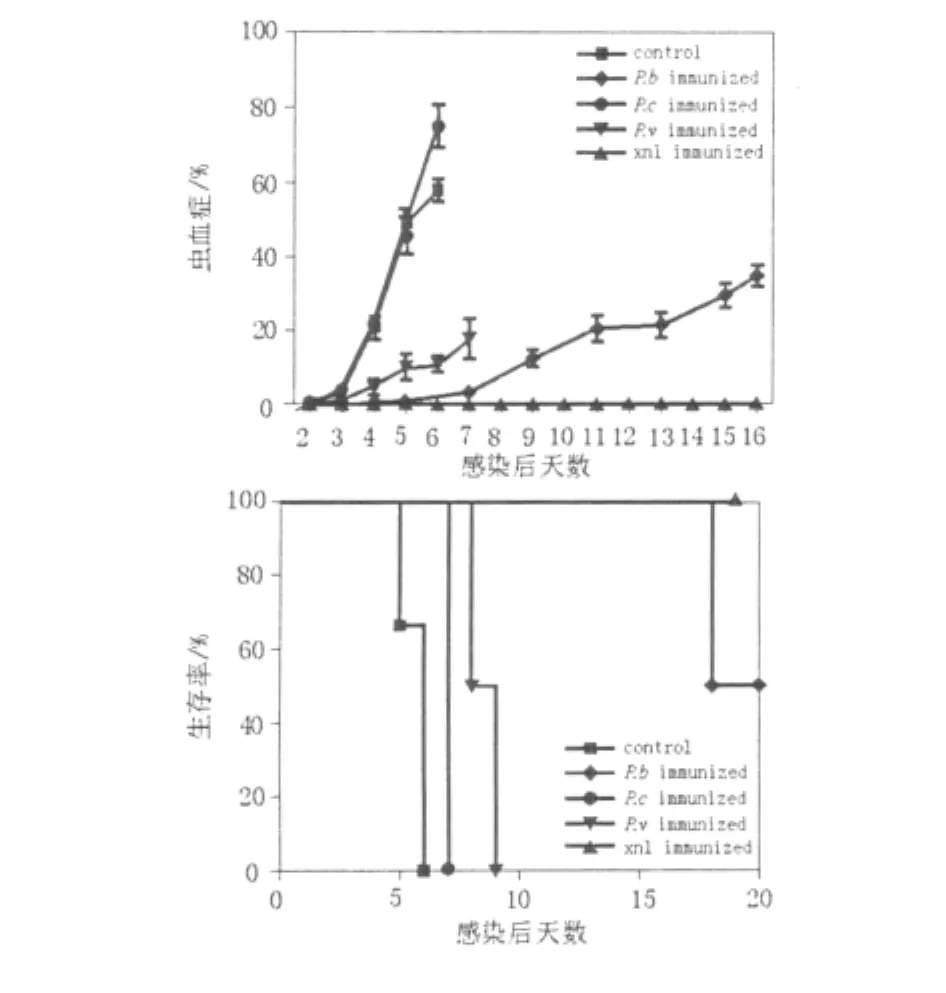
图1 P.y17XL再感染后的原虫血症水平和生存率Fig.1 Parasitemia and survival rate of BALB/c mice reinfected with P.y17XL
2.2 再感染小鼠脾细胞培养上清中IFN-γ水平
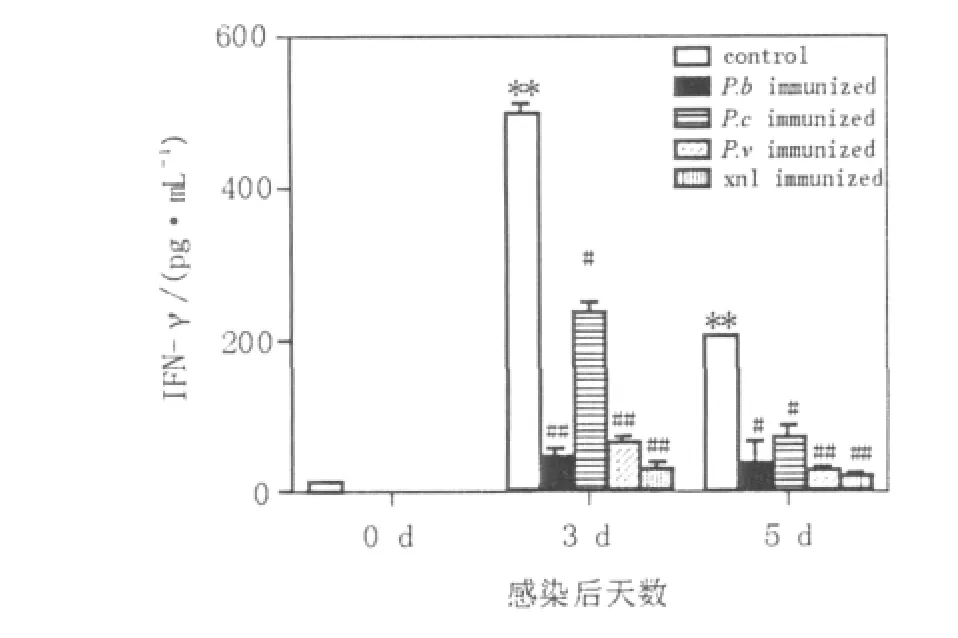
图2 不同虫种感染小鼠经P.y17XL再攻击后脾细胞培养上清中IFN-γ水平Fig.2 IFN-γ levels in different species/strains immunized mice after P.y17XL re-infection
与正常小鼠相比,control(初次感染P.y17XL)小鼠脾细胞培养上清中IFN-γ水平于再感染后第3天显著升高(P<0.01),第5天水平下降,但仍然显著高于感染前水平(P<0.01);P.c、P.v及xnl immunized组的IFN-γ也呈现出相同的趋势。同时,与control相比,初次感染不同虫种/株感染治愈后再感染P.y17XL的小鼠,IFN-γ水平在再感染后3 d和5 d均显著降低(P<0.05)(图2)。
2.3 再感染小鼠特异性IgG抗体水平检测
如图3所示,再感染P.y 17XL后,与control相比,P.xnl immunized组小鼠血清中P.y17XL特异性IgG水平出现有意义升高(P<0.05),最高滴度为1∶1 600;P.v immunized组为1∶800;而其他各组血清在不同滴度下,与control相比,特异性IgG抗体水平均未见显著差异(图3A)。与control相比,P.y17XL再感染后,P.b、P.c及P.y xnl immunized组小鼠血清中P.y17XL特异性IgG1抗体水平出现显著增加(P<0.05),其中P.y xnl immunized组的最高滴度为1∶6 400,P.b和P.v immunized组的最高滴度为1∶800,P.c immunized组的最高滴度为1∶1 600(图3B)。
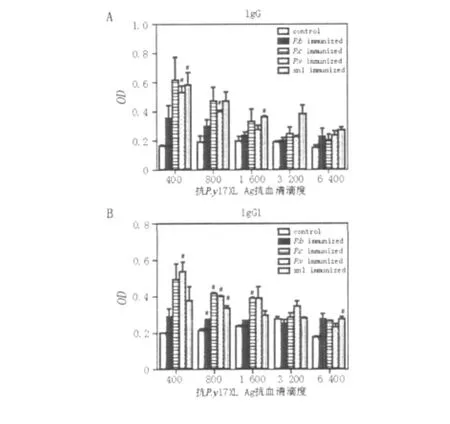
图3 不同虫种感染后P.y17XL再攻击小鼠血清中P.y17XL特异性IgG(A),IgG1(B)水平Fig.3 Specific anti-P.y17XL IgG levels in different species/strains immunized mice after P.y17XL re-infection
3 讨论
研究表明,疟疾感染的有效控制依赖于早期Th1型免疫应答的建立,以及随后向Th2型免疫应答转化[8]。相关研究显示,P.y17XL再感染前,小鼠血清中存在一定水平的特异性抗体,这使得小鼠对同种疟原虫再攻击具有显著的保护力,而在再感染早期,Th1型细胞因子IFN-γ出现一定程度的升高,血清中特异性IgG抗体水平则升高明显,同时易感的BALB/c小鼠接受被动转移再感染小鼠的免疫血清后可明显抵御P.y17XL的感染[9]。由此提示,以IgG抗体为主的体液免疫应答在宿主抵抗疟原虫再感染中发挥重要作用。IgG2a和IgG1分别是Th1和Th2型细胞依赖抗体,也是抗疟免疫中最重要的IgG亚型,宿主对不同虫种/株的抵抗或易感与宿主产生的IgG2a和IgG1水平明显相关[10-11]。不同种/株疟原虫感染后发生再感染的现象已成为疟疾疫苗研发和效果评估的主要障碍之一。然而,有关不同种株疟原虫感染后对同/异种株再感染的影响目前尚不明晰。
本研究显示,P.y17XNL疟原虫感染治愈后能够完全保护宿主抵抗P.y17XL的再攻击。提示经初次感染后的小鼠治愈后对同种疟原虫的再感染有完全的保护力;以异种疟原虫感染BALB/c小鼠治愈后,再用P.y17XL再攻击时,与P.y17XL初次感染鼠相比,除P.c外的各组小鼠均出现了不同程度的虫血症水平降低,部分生存率有所延长。由此表明,疟原虫初次感染对异种疟原虫的再感染具有一定抵抗力,该免疫保护可能与不同虫种疟原虫间存在共同的交叉抗原有关。除P.b ANKA感染组外,P.c AS和P.v组小鼠均未能完全保护宿主抵抗P.y17XL再感染,P.c AS组小鼠甚至出现了较高的死亡率。有文献报道,单一虫种/株疟原虫感染并不能诱导产生足够的交叉免疫保护[12-13],本实验结果与之相符。另外,在检测脾细胞培养上清中IFN-γ水平及其血清中特异性IgG抗体时发现,不同虫种/株感染治愈后P.y17XL再感染的小鼠IFN-γ水平均明显低于同时间点P.y17XL初次感染的小鼠;P.v、P.y 17XNL感染治愈小鼠血清中P.y17XL特异性IgG抗体水平出现显著增加,且以IgG1亚类升高为主;此外,P.v和P.c AS感染治愈组的IgG1亚类也出现了有意义的升高,但各组的IgG2a亚类水平则未出现有意义的变化(数据未显示)。这表明,P.b ANKA、P.c AS、P.v和P.y17XNL感染产生的抗血清均可与P.y17XL可溶性抗原产生明显的交叉反应,且该反应主要表现为Th2型细胞因子介导的IgG1应答水平的升高,由此提示,以IgG尤其是IgG1抗体为主的体液免疫应答对同种异株疟原虫再感染发挥保护性作用,而对异种疟原虫再感染保护性作用有限。这也为抗疟疫苗及抗疟新药在疟疾流行区的应用提供了理论依据。
[1] McCoy D,Kembhavi G,Patel J,et al.The Bill&Melinda Gates Foundation's grant-making programme for global health[J].Lancet,2009,373(9675):1645-1653.
[2] Lorenzetti A,Fornazari PA,Bonini-Domingos AC,et al.Mixed Plasmodium falciparum infections and its clinical implications in four areas of the Brazilian Amazon region[J].Acta tropica,2008,107(1):8-12.
[3] Ebrahimzadeh A,Fouladi B,Fazaeli A.High rate of detection of mixed infections of Plasmodium vivax and Plasmodium falciparum in South-East of Iran,using nested PCR[J].Parasitology international,2007,56(1):61-64.
[4] King CL,Michon P,Shakri AR,et al.Naturally acquired Duffybinding protein-specific binding inhibitory antibodies confer protection from blood-stage Plasmodium vivax infection[J].Proceedings of the National Academy of Sciences of the United States of America,2008,105(24):8363-8368.
[5] Stepniewska K,White NJ.Pharmacokinetic determinants of the window of selection for antimalarial drug resistance[J].Antimicrobial agents and chemotherapy,2008,52(5):1589-1596.
[6] Snounou G,Bourne T,Jarra W,et al.Assessment of parasite population dynamics in mixed infections of rodent plasmodia[J].Parasitology,1992,105(Pt 3):363-374.
[7] Trang DT,Huy NT,Kariu T,et al.One-step concentration of malarial parasite-infected red blood cells and removal of contaminating white blood cells[J].Malaria journal,2004,3:7.
[8] Zheng W,Liu J,Meng DY,et al.Study on protective immunity against infection of Plasmodium yoelii 17XL in DBA/2 mice[J].Zhongguo ji sheng chong xue yu ji sheng chong bing za zhi=Chinese journal of parasitology&parasitic diseases,2006,24(1):14-18.
[9] Ma SH,Zheng L,Liu YJ,et al.Plasmodium yoelii:influence of antimalarial treatment on acquisition of immunity in BALB/c and DBA/2 mice[J].Experimental parasitology,2007,116(3):266-272.
[10]ten Hagen TL,Sulzer AJ,Kidd MR,et al.Role of adjuvants in the modulation of antibody isotype,specificity,and induction of protection by whole blood-stage Plasmodium yoelii vaccines[J].Journal of immunology(Baltimore,Md:1950),1993,151(12):7077-7085.
[11] Smith EC,Taylor-Robinson AW.Parasite-specific immunoglobulin isotypes during lethal and non-lethal murine malaria infections[J].Parasitology research,2003,89(1):26-33.
[12] Beeson JG,Osier FH,Engwerda CR.Recent insights into humoral and cellular immune responses against malaria[J].Trends in parasitology,2008,24(12):578-584.
[13] Mackintosh CL,Beeson JG,Marsh K.Clinical features and pathogenesis of severe malaria[J].Trends in parasitology,2004,20(12):597-603.

