石油降解菌株的分离鉴定及降油特性
雒晓芳,杨琴,陈丽华,3,周立辉,徐红伟
(1.西北民族大学实验中心,甘肃兰州730124;2.长庆油田公司油气工艺研究院,陕西西安710018;3.兰州大学西部环境与气候变化研究院,甘肃兰州730000)
土壤中微生物资源丰富,自然条件下大多数微生物代谢不活跃。当这些微生物遇到适当的刺激(氧、营养等)时复苏开始其代谢(降解)过程。对微生物进行筛选和分离可以选出降解能力较强的微生物即优势菌,在土壤中添加这些优势菌,可以在一定程度上提高微生物对污染物的降解作用。在长期被石油污染的土壤和活性污泥中微生物可逐步改变自身的代谢条件以适应环境条件,即以石油烃为碳源进行生长繁殖,同时将石油烃降解,因此在这种土壤中存在着可降解石油烃的微生物,石油烃降解菌的分离是生物法处理石油污染的关键。在自然界净化石油烃类污染的综合因素中微生物降解起着重要的作用,目前已报道有多个种属具有分解和转化石油组分的能力[1]。近年来,石油烃的生物降解受到了人们越来越多的关注,在石油污染的生物处理中,石油降解菌利用碳源而将其降解[2-4]。石油降解微生物的资源研究已经成为一个重要方向,国际上已建成专门的降解微生物菌种资源库[5]。目前已分离鉴定的烷烃降解菌有假单胞菌(Pseudomonas)[6]、肠杆菌(Enterobacter)、不动杆菌(Acinetobacter)、棒杆菌(Nocardia)和诺卡氏菌(Corynebacterium)等[7]。由于石油污染物具有组成复杂性、生物难降解性和较低的生物可利用度等特点,土著微生物难以有效、快速、彻底地降解土壤中的石油烃[8]。同时,石油的主要成分是烷烃类物质,水溶性较低,较难被微生物利用,因此对烷烃降解菌的筛选分离是生物法处理石油污染物的关键。在长期被石油污染的土壤中,微生物可逐步改变自身的条件适应环境,进行选择性富集并发生遗传变异,因此在这种土壤中存在着可降解烷烃的微生物[9]。然而,污染土壤的石油组分复杂,大致分为烷烃(占65%~70%)、芳香烃(占10%~15%)和树脂与沥青质(占8%~10%)3大类,各组分的生物可降解程度不同,降解过程复杂,其中芳香烃类最难被降解。单一的细菌或真菌因产生酶的种类比较少且浓度较低,所以一般只能降解少数特定烃类或只降解到某一阶段,复杂烃类的彻底降解往往需要多种微生物协同联合作用[10]。所以,筛选高效降解石油的微生物菌种是生物修复的必然,目前有关石油降解菌方面的研究报道较多[11-12],但尚未见到白色类诺卡氏菌(Nocardioides albus)降解石油方面的研究。因此,本课题组从甘肃华庆油田油井附近地表深度10 cm左右石油污染土壤中采样,通过多次富集并筛选分离出1株高效石油降解菌株,利用生理生化测试和16S rDNA序列分析进行分子鉴定,初步探讨了其降解特性,以期为微生物在石油污染土壤治理中的应用提供菌种资源和理论依据。
1 材料与方法
1.1 材料
1.1.1 实验土样石油污染土样取自甘肃华庆油田油井附近地表深度为10 cm左右石油污染土壤,装入无菌袋中密闭保存于4℃冰箱。
1.1.2 培养基无机盐培养基:NH4NO32 g/L,K2HPO41.5 g/L,KH2PO43 g/L,微量元素液2 mL,蒸馏水1 000 mL;微量元素液(g/L):MgSO4·7H2O 0.1,FeSO4·7H2O 0.2,CuSO40.1,无水CaCl20.01,Na2EDTA·2H2O 0.01;降油培养基:无机盐培养基1 000 mL,原油6 g,若配制固体培养基需另加琼脂20 g。保存培养基为牛肉膏5 g,蛋白胨10 g,氯化钠5 g,琼脂20 g,蒸馏水1 000 mL,pH 7.2~7.4。
1.2 方法
1.2.1 F1菌株的分离土样2.5 g,添加到装有200 mL无机盐培养基的三角瓶中,在30℃,120 r/min的恒温摇床上进行振荡培养7 d,移取一定量的富集培养液接入新鲜降油培养基中,在相同条件下培养7 d,共重复3次,经过3个周期的驯化后,在无菌的条件下,用接种环蘸取驯化培养液,在降油培养基的平板上划线后,平板倒置于恒温培养箱中培养24~72 h,然后将代表性较好的菌落在降油培养基平板上反复划线纯化得到单一菌落,再将纯化的菌株接种至斜面保存培养基上培养后,保存于4℃冰箱中,待用。
1.2.2 菌株的鉴定①生理生化鉴定:参照《常见细菌系统鉴定手册》[13],对菌株进行明胶液化、牛奶凝固与胨化、淀粉水解、纤维素分解、硝酸盐还原反应、硫化氢的产生、碳源的利用、黑色素的产生等生理生化指标的检测观察。按文献[14]方法进行碳、氮源利用试验;②分子鉴定:采用细菌16S rRNA PCR通用引物,2个PCR引物分别为8F(5'-AGAGTTTGATCCTGGCTCAG-3')和1512R(5'-ACGGCTACCTTGTCGACTT-3'),对应于大肠埃希菌16S rRNA基因的第8~27个碱基和第1 512~1 495个碱基。引物由宝生物工程(大连)有限公司(TaKaRa)合成。以细菌总DNA为模板,PCR反应条件:94℃5 min,1 cycle;94℃1 min、55℃1 min、72℃1.5 min,30 cycles;72℃5 min 1 cycle。把16S rDNA PCR产物与PMD18-T载体连接后转化入大肠埃希菌感受态细胞,挑取阳性克隆,培养12 h后进行测序。将16S rDNA测序结果用Blast软件与GenBank中15株参考菌株的16S rDNA序列进行比较分析。用分子进化遗传学分析与序列比对软件MEGA5.1的邻近相接法(Neighbor-JoiningMethod)对clustalx多重比对结果进行系统进化分析,采用Boot strap方法对500个重复进行可靠性检验[15],确定F1菌株的分类地位。
1.2.3 紫外分光光度法测定石油烃含量配置含油量分别为0、0.2、0.4、0.8、2.0、4.0、5.0 mg/mL的标准油样,以石油醚(脱芳烃)为对照,在紫外分光光度计224 nm处测出不同浓度样品的吸光度,得原油的标准曲线。土样取自甘肃华庆油田油井污染土壤,经碎散、除杂、过筛(1.25 mm)、混均后将土壤样品分别装入6个体积为22 cm×6 cm×22 cm的玻璃缸。采用三级扩大培养法制备F1菌液,将其浓度达到1×1010cfu/mL后放置4℃冰箱备用。每缸装土1 kg,每一缸为1组,分为3组。1#:1 kg污染土壤,加1 mL F1菌液,并添加3 g标准油样,搅匀;2#:1 kg污染土壤,加1 mL F1菌液,并添加5 g标准油样,搅匀;3#:1 kg污染土壤,加1 mL F1菌液,并添加10 g标准油样,搅匀。考虑到微生物有一定的存活时间,故拟定本实验历时42 d,加无菌水保持土壤含水率每天在20%左右,在第0、3、7、10、17、24、31、38、42天时采用5点法分别从3个缸中取土样20 g,放入3个索氏提取器中,用150 mL沸程为60~90℃的石油醚索氏提取12 h,回流温度为60~65℃,虹吸速度为3~5次/分,回流72 h后测得索氏提取率为90.55%,将提取液移入250 mL的容量瓶中,用紫外可见分光光度计测定3个缸中污染物含量在224 nm下的吸光度,根据原油标准曲线求得石油烃污染物的含量。
1.2.4 GS-MC测定原油各组分将F1菌株接入20 mL含10 mg原油的无机盐培养基的三角烧瓶,28℃摇床震荡培养7 d,取出加入氯仿10 mL,放入超声波仪器中破乳15 min,倒入滴液漏斗中萃取出氯仿相,如此反复3次,将萃取液收集一起,放入水浴中将氯仿蒸发殆尽,剩下的残油准确称量后定容10 mL,即为GS-MC测试降解油样。同样方法,同时不添加F1菌剂设置对照组。降解油样各组分分析条件:气化温度260;载气He;柱温200;柱SE-30(50 m);质谱条件:电子能量70 eV,质量范围40~450。
2 结果与分析
2.1 不同浓度的原油对F1菌株的降油影响
测得原油的标准方程为y=0.019 6x①,相关系数R2为0.999 3(图1)。为方便计算,将其转变为250 mL样品中所含的石油类总量和吸光度之间的关系式:M=12.755 1D②。其中,D为用250 mL石油醚萃取含油油样得到萃取液的有效吸光度,无量纲;M为样品所含污染物总量。
对1#、2#、3#土样的残留量进行回归方程的分析,可以看出石油残留量曲线符合一级反应动力学方程[16]:lnρ(油)=lnρ(油)-kt(1),式中:ρ(油)可为任意时刻石油残留量。ρ(油)为第0天残留量,k为降解速度常数,t为半衰期。利用k值可以指示不同浓度的微生物降解速度。由(1)式可得西-27原油的半衰期公式:t1/2=ln2/k(2)。由(2)式可以计算出F1菌株在含油浓度0.3%、0.5%、1.0%土样中降解原油的半衰期分别为17.2、18.2、23.7 d。
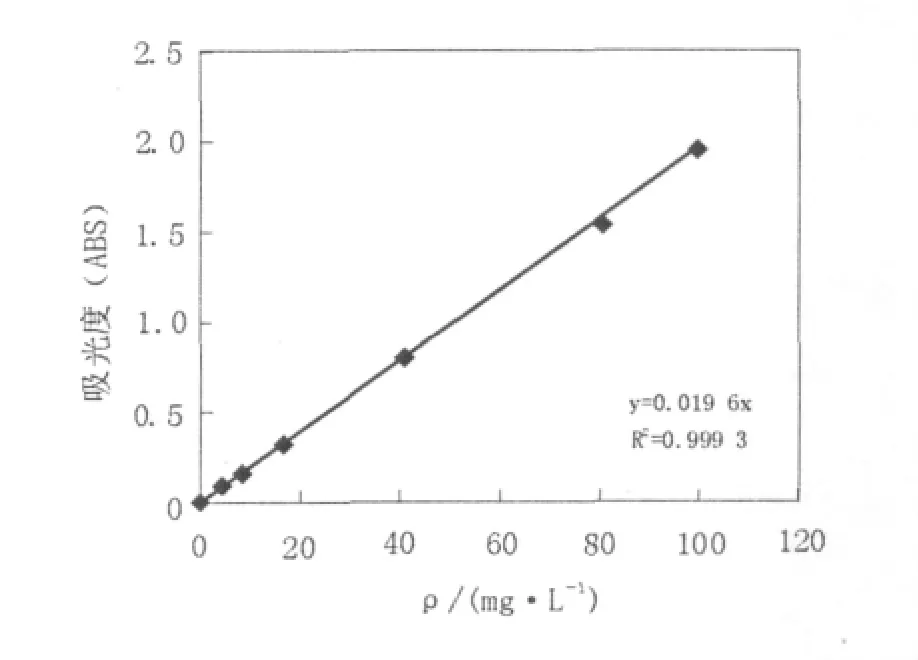
图1 原油的标准曲线Fig.1 Standard curve of crude oil
由图2可知,原油浓度为0.3%、0.5%、1.0%3组土样的降解速度依次降低。用紫外分光光度计测得索氏提取液250 mL的Abs,根据M=12.755 1D计算得1 kg土样在不同天数污染物残留量,然后换算为降解率。1#、2#、3#土样17 d降解率分别为40.23%、46.41%、42.07%,24 d达到72.02%、69.87%、56.57%,降解率均超过50%,42 d后均达到78%以上。
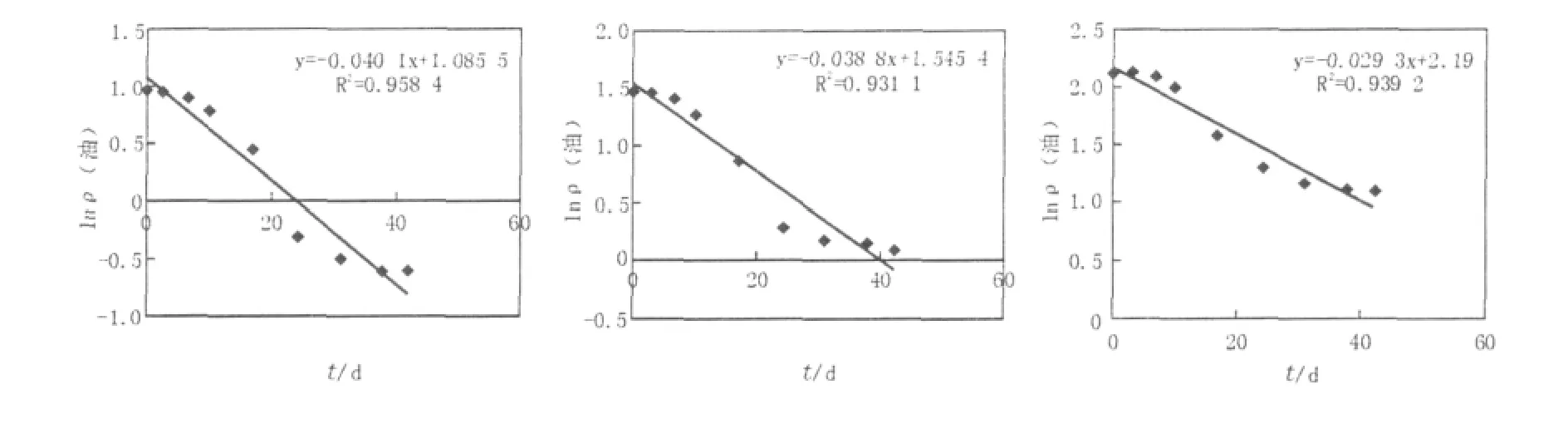
图21 #、2#、3#土样的石油烃随时间的变化规律Fig.2 Curve of remaining TPH concentration in soil under different soil samples conditions
2.2 菌株的鉴定
2.2.1 生理生化测试F1菌株革兰阳性;不抗酸;明胶液化;牛奶不凝固,但胨化;淀粉水解;纤维素上不生长;硝酸盐不还原;利用D-葡萄糖、L-阿拉伯糖、D-木糖、L-鼠李糖、D-果糖、D-甘露醇;利用蔗糖,很少利用棉子糖;不利用肌醇;不产生类黑色素;产生H2S气体。
2.2.2 分子鉴定将F1菌株16S rDNA全序列输入GenBank核酸序列数据库进行比对,发现与白色类诺卡氏菌(Nocardioides albus)之间的同源性达99.0%。选取近缘的菌株序列通过MEGA5.1的邻近相接法构建系统进化树(图3),将其初步确定为白色类诺卡氏菌(Nocardioides albus)。
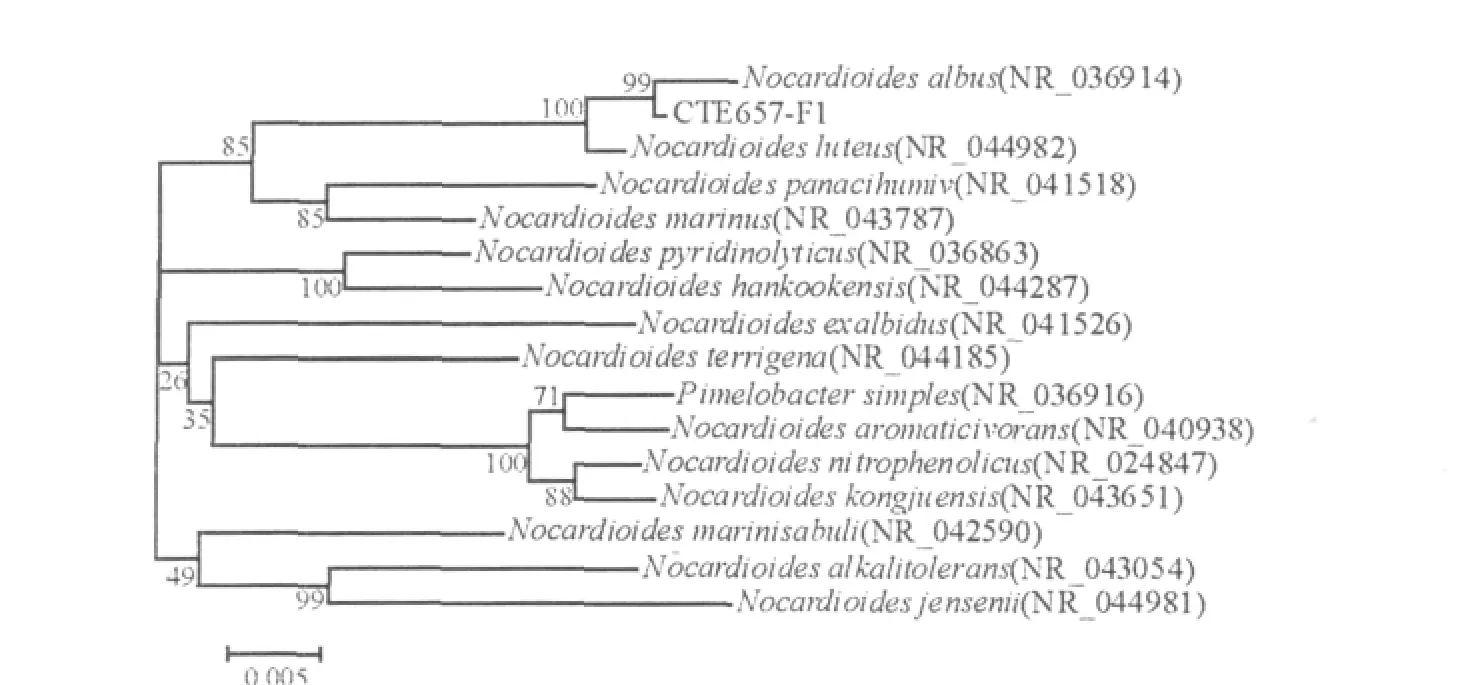
图3 F1菌株的系统发育树Fig.3 Phylogenetic tree of the strain F1
2.3 F1菌株对原油不同组分的降解
所采原油为长庆油田延长组-三叠纪-湖相成油,从原油GC-MS图谱分析可知,该地区原油正构烷烃的碳数主峰靠前为nC15,高碳数正构烷烃降解明显,奇数碳优势已不够明显,霍烷和甾烷的异构化现象明显,均说明成烃环境微生物发育,原油演化程度高,成熟度高。非烃和多环芳烃在成烃环境中热、压力能量和微生物作用下,已多数演化为类异戊二烯烷烃等烃类物质,在离子流图中较难提取,含量很少。这种特征与黄廷林等[17]研究陕北油田(同一组系)原油组分特征测定结果一致。故以氯仿提取F1降解后原油做GC-MS分析,其组分亦主要包括饱和烃(正构烷烃、霍烷、甾烷系列),芳烃、非烃含量很少。以下对降解前后,主成分正构烷烃、霍烷系列的各个物质结构鉴定、含量及降解率分析见表1、2。2系列总离子流图见图4、5。
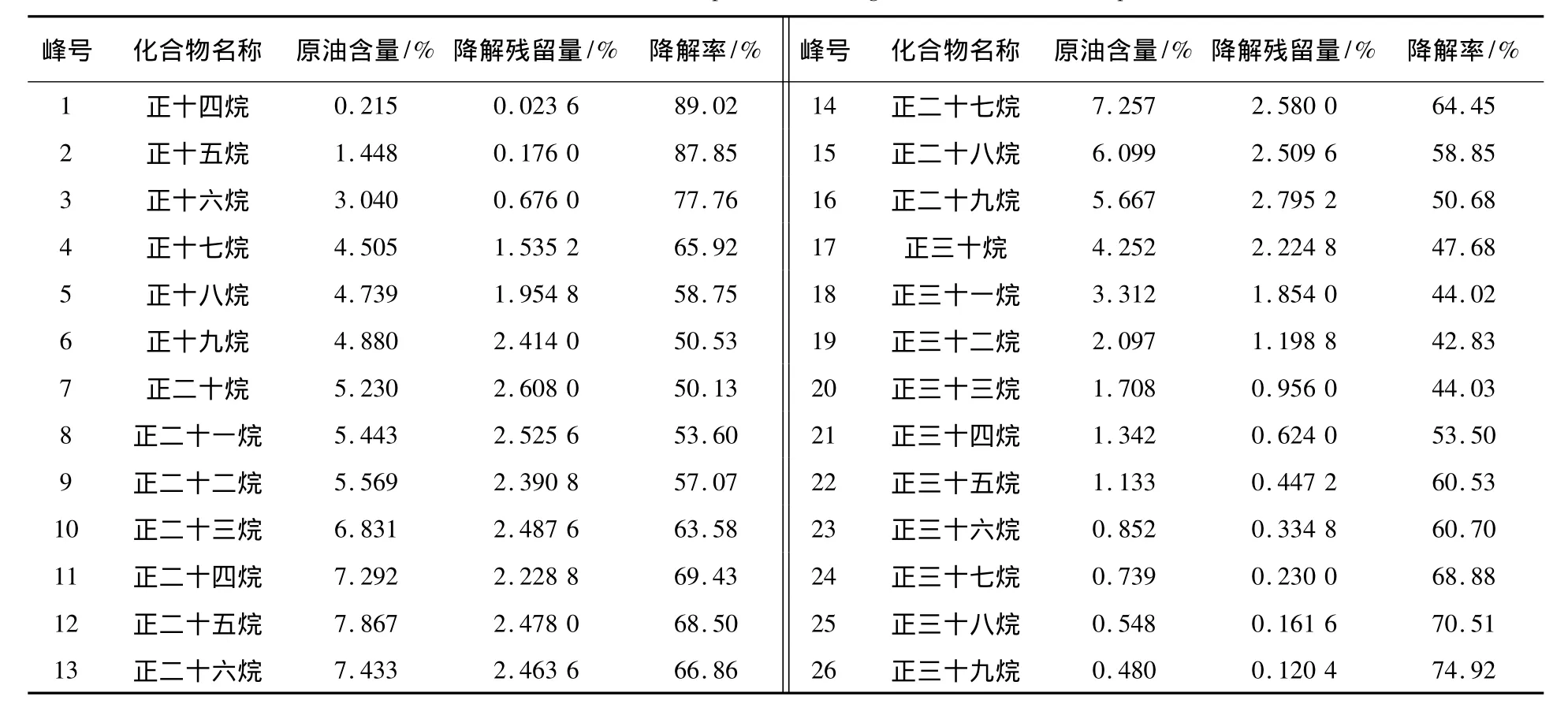
表1 7d后油样中正构烷烃组分及降解率分析Table 1 The n-alkanes components and degradation rate of oil samples

表2 7d后油样中霍烷主组分及降解率分析Table 2 The hopane components and degradation rate of oil samples
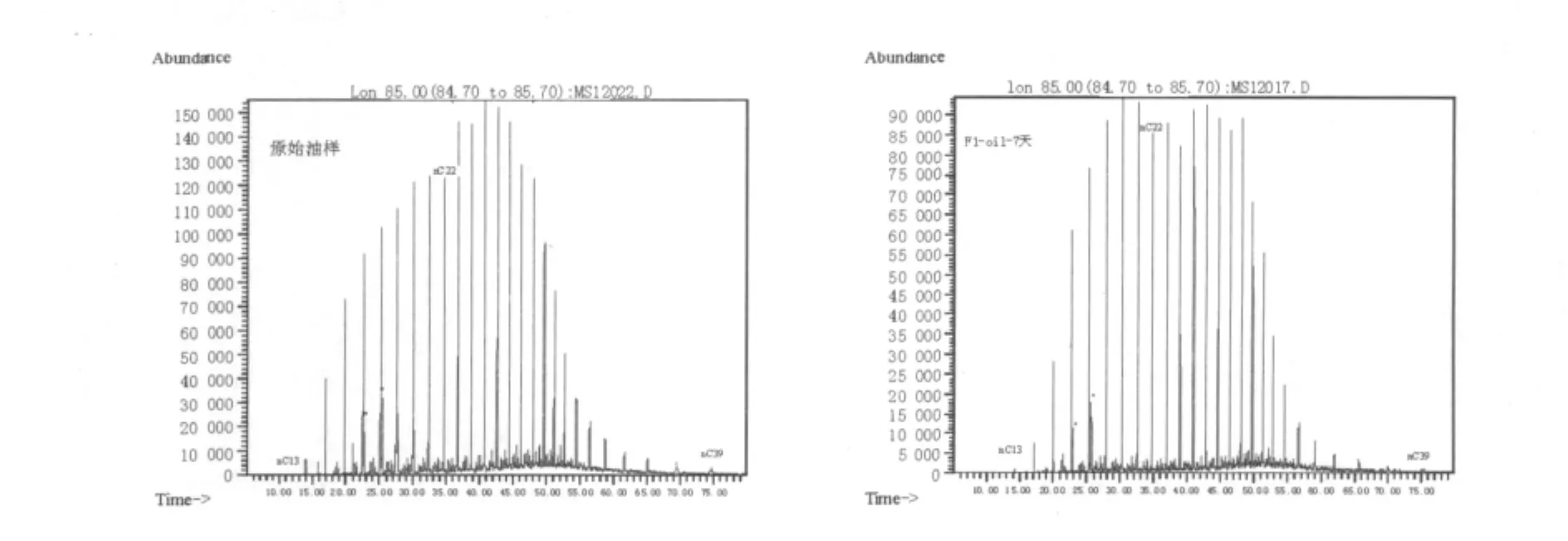
图4 降解前后正构烷烃总离子流图Fig.4 Degradation of n-alkanes before and after total ion chromatorgraphy
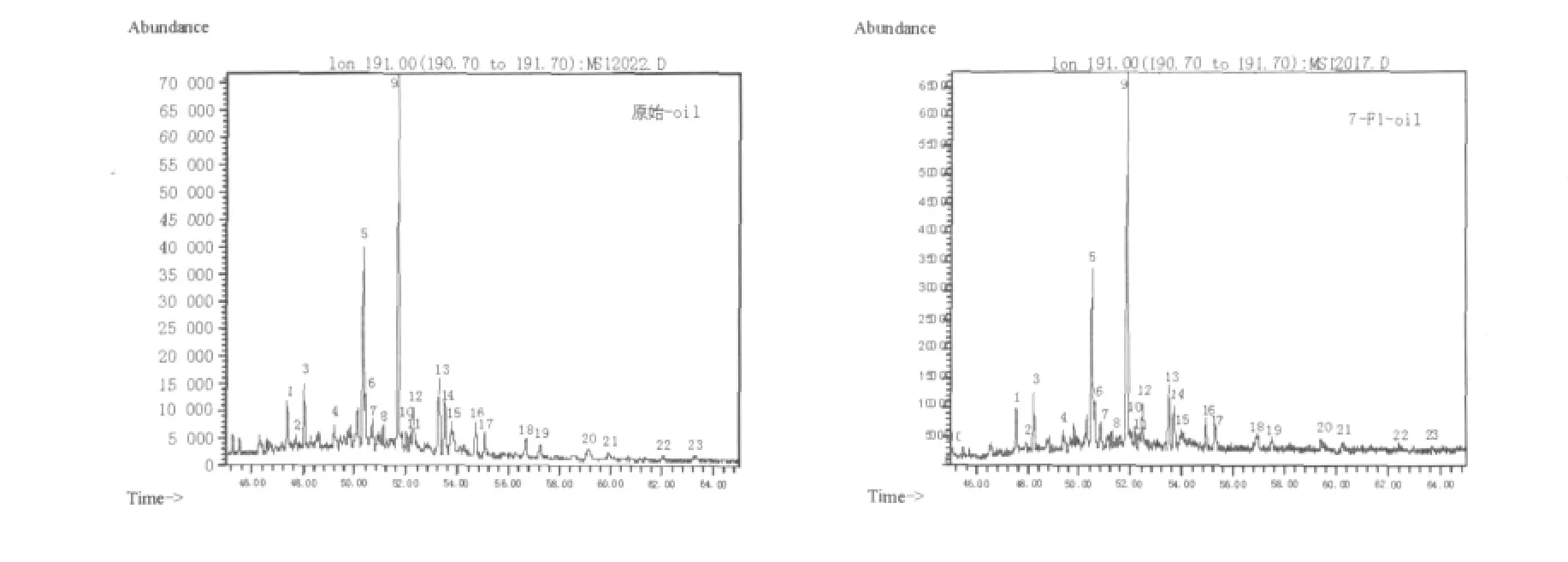
图5 降解前后霍烷总离子流图Fig.5 Degradation of hopanes before and after the total ion chromatorgraphy
由表1、2可见,等量原油经F1降解前、后,正构烷烃最大峰度从15×104下降至9×104,整体降低约40%,而且以C22为界,表现出明显的后峰前移峰形,完全符合多数石油降解菌以原油为碳源的降解演化规律,即先降解高碳数正构烷烃为低碳数正构烷烃,在整体峰度下降中还表现出另一特征:高碳数正构烷烃中奇数碳向偶数碳正构烷烃演化规律。从表1数据可见,F1菌可以广泛利用从C14~C39正构烷烃为碳源,降解率在42.8%~89%,平均64%,另外,虽然原油已经历过成烃环境微生物和热作用,奇数优势已不如成熟度低的原油,但仍可从表1看出奇数碳正构烷烃降解率普遍高于偶数碳,表现出多数降解菌在利用长链饱和烃时优先降解奇数碳正构烷烃的特征。
原始原油和经历细菌作用7 d的原油的藿烷系列碳数分布相同均为C27~C35(C28缺失),主峰相同均为C30-αβ藿烷。霍烷最大峰度从7×104降至6.5×104,降低8%,有明显高等植物母质输入,与生烃古环境一致。含量最高的17α(H),21β(H)-藿烷降解率仅是0.84%,其次是17α(H),21β(H)-30-降藿烷,降解率16.75%,平均降解10.23%。表明原油经F1作用7 d后,烷烃受到较明显的降解,五环三萜烷(藿烷)则比较稳定。如表2所见,Ts为18α(H)-22、29、30-三降藿烷,Tm为17α(H)-22、29、30-三降藿烷,Ts/Tm是石油地质领域常用的有机质演化程度参数。Ts/Tm比值越大反映出有机质受外作用力的程度越强,研究样品主要改变的外作用力是F1菌作用,所以Ts/Tm比值越大则F1菌对原油的降解越强烈。虽然原油成熟度已较高,Ts含量达到3.512%,但经F1作用,仍可以看到降解后的Tm向Ts转化,Tm降解率8.22%,Ts降解率-4.85%,表明F1菌株能较好地促使五环三萜类化合物立体构型中不稳定构型向稳定性构型转化。
3 讨论
F1菌株的形态特征和生理生化试验指标等实验结果与白色类诺卡氏菌(Nocardioides albus)属的基本特征一致,同时,16S rDNA序列及同源性与Nocardioides albus的16S rDNA序列有99.0%同源性,并且在系统进化树上表明它和Nocardioides albus属的菌具有较近的遗传距离。因此,将其初步确定为白色类诺卡氏菌(Nocardioides albus)。
F1菌株在含油浓度0.3%、0.5%、1.0%土样中降解原油的半衰期分别为17.2、18.2、23.7 d,42 d后均达到78%以上。
等量原油经F1降解前后,表现出先降解高碳数正构烷烃为低碳数正构烷烃,高碳数正构烷烃中奇数碳向偶数碳正构烷烃演化规律,平均降油率为64%;F1菌株还能较好地促使五环三萜类化合物立体构型中不稳定构型向稳定性构型转化。
[1] Guzev V S,Khalimov E M,Volde M I,et al.Regulatory effect of glucose on hydrocarbons oxidizing microorganisms in soil[J].Microbiology New York,1997,66(2):124-128.
[2]Kishore E D,Ashis K M.Crude petroleum-oil biodeg-radation efficiency of Bacillus subtilis and Pseudomonas aeruginosa strains isolated from a petroleum-oil contami-nated soil from North-East India[J].Bioresource Tech-nology,2007,98(7):1339-1345.
[3] Alejandro R G,Mar A C,Ferre-RO,et al.Bioremediation of crude oil polluted seawater by a hydrocarbon-degrading bacterial strain immobilized on chitin and chitosan flakes[J].International Biodete-rioration&Biodegradation,2006,57(4):222-228.
[4] Ayotamuno M J,Kogbara R B,Ogajs O T,et al.Bioremediation of a crude-oil polluted agricultural-soilat Port Harcourt,Nigeria[J].Applied Energy,2006,83(11):1249-1257.
[5] Sorkhoh NA,Ghannoum MA,Ibrahim AS,et al.Crude oil and hydrocarbon degrading strains of Rhodococcus rhodochrous isolated from soil and marine environments in Kuwait[J].Environ Pollut,1990,65(1):1-17.
[6] Song RH,Hua ZZ,Chen J.Effects of different substrates and environmental factors on hydrocarbon accsess mode and degrading ability of two Pseudomonas aeruginosa strain[J].Chin J Appl Environ Biol,2007,13(6):843-847.
[7] Saadoun I.Isolation and characterization of bacteria from crude petroleum oil contaminated soil and their potential to degrade diesel fuel[J].J Basic Microbiol,2002,42(6):420-428.
[8] Mark A S,James S B,Cheryl A P,et al.Evaluat ion of two commercial bio-augmentation products for enhanced removel of petroleum from a wet land[J].Ecological Engineering,2004,23:263-277.
[9] 沈薇,杨树林,陆晓,等.铜绿假单胞菌BS-03对原油的降解作用[J].环境科学与技术,2006,29(1):16-19.
[10] 顾传辉,陈桂珠.石油污染土壤生物降解生态条件研究[J].生态科学,2000,19(4):67-71.
[11] 刘鹏,李大平,王晓梅,等.石油污染土壤的生物修复技术研究[J].化工环保,2006,26(2):91-94.
[12] Belhaj A,Desnoues N,Elmer ich C.Alkane biodegradation in Pseudomonas aeruginosa strains isolated from a polluted zone:Identification of alkB and alkB-related genes[J].Res Microbiol,2002,153(6):339-344.
[13] 东秀珠,蔡妙英.常见细菌系统鉴定手册[M].北京:科学出版社,2001.
[14] 沈萍,陈向东.微生物学实验(第4版)[M].北京:高等教育出版社,2007.
[15] 陈雪婷,郭婷婷,田威,等.1株土壤放线菌的分类鉴定及其抗菌活性的研究[J].微生物学杂志,2010,30(2):68-71.
[16] Willumsen P A,Arvin E.Kinetics of degradation of surfactant solubilized fluoranthene by a Sphingomonas paucimobilis[J].Environmental Science&Technology,1999,33(15):2571-2578.
[17] 黄廷林,徐金兰,唐智新,等.生物菌剂对石油污染土壤生物修复作用的研究[J].环境科学,2009,30(6):1838-1843.

