谷氨酸棒杆菌生产缬氨酸的代谢工程研究进展
王小元
(食品科学与技术国家重点实验室,江南大学,江苏 无锡 214122)
谷氨酸棒杆菌生产缬氨酸的代谢工程研究进展
王小元
(食品科学与技术国家重点实验室,江南大学,江苏 无锡 214122)
L-缬氨酸是人体必需的三种支链氨基酸之一,在生命代谢过程中起着非常重要的作用,因此被广泛应用于食品、医药及饲料等行业。目前,L-缬氨酸主要采用微生物发酵法生产,而谷氨酸棒杆菌是最常用的生产菌种。作者分析了谷氨酸棒杆菌中L-缬氨酸的生物合成途径和代谢调控,综述了对其进行代谢工程改造来提高L-缬氨酸产量的最新研究进展。
谷氨酸棒杆菌;L-缬氨酸生产;代谢工程;发酵;支链氨基酸
自从1957年Kinoshita等人[1]报道了谷氨酸棒杆菌(C.glutamicum)可以发酵生产谷氨酸,该菌已逐渐被用来发酵生产各种氨基酸,包括L-缬氨酸(L-valine)。L-缬氨酸是人体必需的一种支链氨基酸,具有多种生理功能,因此被广泛应用于食品、医药及饲料等行业。例如,L-缬氨酸在食品工业中用作营养强化剂和增香剂,在医药工业中用于制造复合氨基酸注射液和合成抗生素,在饲料行业中作为一种限制性氨基酸添加剂。由于其用途广泛,市场上L-缬氨酸总是处于供不应求局面,带动企业在L-缬氨酸产量及其生产成本等方面的良性竞争。目前,多数企业使用的L-缬氨酸生产菌来自于反复诱变,因而其遗传背景不明,很难通过进一步诱变来提高L-缬氨酸产量。近年来,随着谷氨酸棒杆菌全基因组测序及基因功能注释的完成[2],代谢工程已被于构建L-缬氨酸生产菌,成为提高L-缬氨酸发酵生产水平的最有效方法。众所周知,优良的生产菌种是提高发酵产品产量和质量的保障。作者在分析谷氨酸棒杆菌中L-缬氨酸的生物合成途径和代谢调控机理的基础上,对其生产L-缬氨酸的代谢工程改造的研究进行综述。
1 谷氨酸棒杆菌中L-缬氨酸分子的生物合成途径
谷氨酸棒杆菌中L-缬氨酸的合成途径见图1。从丙酮酸出发,L-缬氨酸的合成先后涉及到乙酰羟酸合酶(AHAS)、乙酰羟酸同分异构酶(AHAIR)、二羟酸脱水酶(DHAD)和支链氨基酸转氨酶(TA)等[3-5]。首先,由两个基因ilv B和ilv N共同编码的AHAS将两分子的丙酮酸缩合成2-乙酰乳酸;其次,由基因ilvC编码的AHAIR将2-乙酰乳酸转化成双羟基异戊酸;再次,由基因ilv D编码的DHAD将双羟基异戊酸脱水形成2-酮异戊酸;最后,由基因ilv E编码的TA将2-酮异戊酸转化成L-缬氨酸;由pd x R和avt A编码的蛋白质在L-缬氨酸合成的最后一步也起到转氨酶的作用[6]。另外,TA也能催化L-亮氨酸和L-异亮氨酸合成途径的最后一步反应[5]。
谷氨酸棒杆菌中L-缬氨酸的合成途径还与其它一些主要代谢产物的合成途径相互交错,见图1。首先,L-缬氨酸合成的关键前体物质丙酮酸(Pyruvate)同时也被用于合成L-丙氨酸(L-alanine)、乙酰Co A(Acetyl Co A)和草酰乙酸(Oxaloacetate)。其次,L-缬氨酸的合成与L-异亮氨酸(L-isoleucine)的合成共享AHAS、AHAIR、DHAD和TA等4种酶,但是这些酶在不同的合成途径选用不同的底物。例如,AHAS以丙酮酸为底物合成L-缬氨酸,而用丙酮酸和2-酮丁酸二者为底物则合成L-异亮氨酸。AHAS对2-酮丁酸的亲和性远高于丙酮酸,因此在有2-酮丁酸存在时,丙酮酸被用来优先合成L-异亮氨酸,不利于 L-缬氨酸的积累[7]。最后,L-缬氨酸合成前体2-酮异戊酸的同时也被用于合成L-亮氨酸(L-leucine)和 D-泛酸(D-pantothenate)。针对这些特点,在优化谷氨酸棒杆菌生产L-缬氨酸时,不仅要加强L-缬氨酸的合成,还要考虑减弱其它相关代谢产物的合成,积累关键前体物质,将碳流导向L-缬氨酸的合成。
2 谷氨酸棒杆菌中L-缬氨酸合成相关的调控机制
微生物细胞内存在复杂的代谢网络,许多分子的合成都在DNA或蛋白质层次上受到严格调控,L-缬氨酸也不例外。L-缬氨酸合成途径中的一些关键酶受到产物抑制或转录弱化作用调控。胞内合成的L-缬氨酸的胞外分泌也受到调控。因此,要对L-缬氨酸生产菌进行理性的代谢工程优化,必须对其调控机制进行全面了解。
2.1 氨基酸产物对乙酰羟酸合酶的反馈抑制
L-缬氨酸反馈抑制的主要对象是其合成途径上的第一个关键酶AHAS。谷氨酸棒杆菌中AHAS全酶是四聚体,由两个相同的大亚基和两个相同的小亚基构成。大亚基为催化亚基,由ilv B基因编码;而小亚基为调节亚基,由ilv N基因编码。3种支链氨基酸均可以反馈抑制AHAS的小亚基[7-8]。L-缬 氨 酸、L-异 亮 氨 酸 和 L-亮 氨 酸 对AHAS的 半 抑 制 浓 度 分 别 为 0.9、3.1 和 6.0 mmol/L[3]。当浓度取5.0 mmol/L时,无论是单一的支链氨基酸,还是任意两种或三种支链氨基酸组合,对AHAS活性的抑制程度均不会超过57%[8]。这些数据说明3种支链氨基酸在AHAS小亚基上的结合位点是相同的,但它们与该结合位点的亲和性有差异。通过定点突变,对谷氨酸棒杆菌AHAS小亚基上20、21和22位的氨基酸进行替换,可获得一个不受任何支链氨基酸反馈抑制的突变体[8]。
2.2 编码乙酰羟酸合酶的基因转录弱化
在谷氨酸棒状杆菌染色体上,基因ilv B、ilv N和ilv C串联构成一个操纵元ilv BNC。Northern印迹实验证明ilv BNC操纵元可以转录3种长度分别为3.9、2.3、1.1 kb的 m RNA;它们分别对应于ilv BNC、ilv NC和ilvC3种DNA 片段[4]。如果将ilv B的上游序列删除,则只能获得长度分别为2.3 kb和1.1 kb的m RNA;如果将ilv N的上游序列删除,则只能获得长度为1.1 kb的 mRNA[4]。这些数据说明ilv BNC操纵子中含有3个启动子,因而基因ilvC可被转录3次,导致其表达效率在3个基因中最高。进一步研究发现,在ilv B上游292 bp处的一段DNA能表达一个短肽。这个短肽含有25个氨基酸,其中包括2个L-异亮氨酸、3个L-缬氨酸和2个L-亮氨酸,且短肽形成序列的后面存在能形成RNA茎环结构和转录终止子结构的序列[9],说明这个短肽是对操纵元ilv BNC具有弱化调节作用的前导肽。前导肽翻译偶联的弱化作用对il-v BNC的转录调控进一步被Mobach等人用lacZ作为报告基因实验证实[9]。
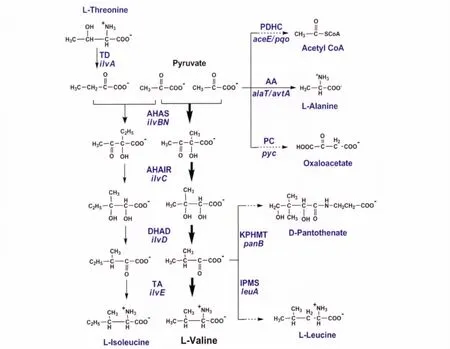
图1 谷氨酸棒杆菌中L-缬氨酸的生物合成途径Fig.1 Biosynthesis of L-valine in C.glutamicum
2.3 L-缬氨酸胞外分泌的调控
如果胞内的L-缬氨酸不能被及时分泌到胞外,积累的L-缬氨酸就会抑制其生物合成途径中关键酶的活性,并弱化编码关键酶的基因转录,使L-缬氨酸的合成速度降低。胞内的L-缬氨酸必须通过膜转运酶Brn F和Brn E分泌到胞外[10]。全局基因表达分析发现,L-异亮氨酸的加入可以增加野生型谷氨酸棒杆菌中BrnF和BrnE的表达,但是对lrp敲除菌株没有影响。通过与lrp和brn F的启动子的转录融合表达分析,发现在培养基中添加3种支链氨基酸或L-甲硫氨酸均可以刺激brn FE的表达,但是这种刺激作用需要调控因子Lrp的存在[11]。芯片分析、带转变实验和DNAse足迹分析证明Lrp结合在lrp和brn F之间的DNA上[11]。
3 L-缬氨酸代谢工程菌研究进展
L-缬氨酸工业生产菌主要来自于传统诱变育种[12],但目前代谢工程正在被用于谷氨酸棒杆菌的改良:利用已知的遗传学信息,对L-缬氨酸代谢网络进行系统分析,并采用基因工程技术改造谷氨酸棒杆菌以提高L-缬氨酸的产量[13-14]。近年来,一些适用于用于谷氨酸棒杆菌的表达载体已经被构建[15-17]。这些表达载体一般为大肠杆菌和谷氨酸棒杆菌的穿梭载体,含有较多的限制酶单酶切位点,有的是诱导性表达,有的是组成型表达。在谷氨酸棒杆菌中进行基因敲除的各种方法已经被建立[18-19]。由于同一启动子在大肠杆菌和谷氨酸棒杆菌中的活性差别很大,所以针对谷氨酸棒杆菌中启动子的研究也已经展开[20-21]。目前,人们已经从阻止杂酸合成、积累关键前体物质、解除反馈抑制和优化启动子等方面入手构建出一些能高产L-缬氨酸的代谢工程菌,见图2。通过解析影响L-缬氨酸合成的关键因素,对谷氨酸棒杆菌ATCC13032的基因组进行优化或在其中高效表达关键基因均可以大幅度地提高 L-缬氨酸的产量[8,15,22-24]。
图2 谷氨酸棒杆菌L-缬氨酸生产菌的代谢工程优化Fig.2 Metabolic engineering of L-valine production strains
3.1 切断旁支路并加强主干道碳流
如图1所示,L-缬氨酸的合成与L-异亮氨酸、L-亮氨酸和D-泛酸的合成交错在一起。因此,要提高L-缬氨酸的产量,首先要通过基因敲除阻止杂酸合成,然后通过高效表达来进一步加强L-缬氨酸合成。L-异亮氨酸和L-缬氨酸的合成途径共享的4个酶需要不同的底物。合成L-异亮氨酸最关键的前体是L-苏氨酸在ilv A编码的苏氨酸脱氨酶作用下产生的2-酮丁酸,所以可以通过敲除基因ilv A阻止L-异亮氨酸的合成。2-酮异戊酸是L-缬氨酸、L-亮氨酸和D-泛酸等3种酸的共同合成前体。由leu A编码的异丙基苹果酸合酶是L-亮氨酸合成途径中的第一个关键酶,通过敲除基因leu A可以阻止L-亮氨酸的合成。从2-酮异戊酸到泛酸的合成涉及到3个基因pan B、panC和pan E,其中两个关键基因panB和panC在染色体上位置相邻,通过敲除这两个基因可以阻止D-泛酸的合成。从丙酮酸出发合成L-缬氨酸需要5个基因ilv B、ilv N、ilv C、ilv D和ilv E。在基因组中,ilv B、ilv N和ilvC3个基因是串联的,ilv D与ilv B只相隔两个基因,而ilv E却远离其他基因。所以,基因ilv BNCD可以作为一个整体从基因组中扩增出来,通过载体高效表达来提高L-缬氨酸的产率。2002年,Radmacher等人通过缺失ilv A和pan BC基因并过量表达il-v BNCD基因构建了一个谷氨酸棒杆菌L-缬氨酸高产 工 程 菌 株 ATCC 13032Δilv AΔpan BCpJC1ilv BNCD[15]。该菌株利用4 g/d L葡萄糖摇瓶培养48 h能产生91.9 mmol/L(10.8 g/L)的L-缬氨酸。
3.2 积累关键前体和储备能源
L-缬氨酸合成的关键前体丙酮酸是细胞内非常重要的代谢产物,因此,降低丙酮酸的消耗也可以增加L-缬氨酸产量。谷氨酸棒杆菌中丙酮酸的消耗方式主要有下列几种:一是通过ala T和avt A等基因编码的丙氨酸氨基转移酶(AA)生成L-丙氨酸[25];二是通过aceE等基因编码的丙酮酸脱氢酶复合体(PDHC)直接合成乙酰-CoA,或通过pqo基因编码的丙酮酸/奎宁氧化还原酶合成乙酸,再进一步合成乙酰-CoA;三是通过丙氨酸羧化酶(PC)合成草酰乙酸。敲除这些相关基因,就可以通过积累丙酮酸而增加L-缬氨酸产量或通过减少杂酸含量而降低其生产成本。比如,在谷氨酸棒杆菌ATCC 13032ΔilvAΔpanBCpJC1ilvBNCD[15]中进一步敲除alaT基因,L-缬氨酸的产量虽然增加不明显,但杂酸L-丙氨酸的含量降低了80%,最终导致下游分离纯化成本的降低[25]。通过敲除aceE基因并过表达ilv BNCE而构建的ATCC13032ΔaceEpJC4ilv BNCE分批发酵能产生210 mmol/L(24.6 g/L)的 L-缬氨酸[22],说明丙酮酸的累积确实能增加L-缬氨酸产量。进一步敲除pqo基 因,得 到 的 菌 株 ATCC13032ΔaceEΔpqopJC4ilv BNCE能进一步提高L-缬氨酸的产量。由于培养丙酮酸脱氢酶缺陷型谷氨酸棒杆菌必须添加乙酸,这会影响葡萄糖的消耗,进而影响L-缬氨酸的合成[26]。Blombach等人[23]通过一系列实验发现用乙醇代替乙酸可以解决这个问题。添加乙醇 来 分 批 发 酵 ATCC13032ΔaceEΔpqopJC4ilv BNCE,葡萄糖的消耗速率是乙酸的6倍,66 h后积累了301 mmol/L (35.3 g/L)的 L-缬氨酸[23]。通过降低谷氨酸棒杆菌中H+-ATPase的活性也可以积累丙酮酸[24]。将ATCC13032中染色体上atpG基因817位的T突变成C,导致其编码的H+-ATPase的273位的Ser变成Pro,得到突变株A-1。在A-1中导入质粒p VKilv N53C摇瓶发酵72 h能产生95.7 mmol/L(11.2 g/L)的L-缬氨酸[24]。质粒p VKilv N53C含有ilv N53和il-vC两个基因,其中基因ilv N53编码的AHAS小亚基在C-端缺少53个氨基酸,导致AHAS具有抗L-缬氨酸反馈抑制的能力。
辅因子也会对L-缬氨酸的合成造成影响。在L-缬氨酸的合成途径中,消耗1 mol的葡萄糖,能产生2 mol NADH,同时消耗2 mol NADPH,才能合成1 mol L-缬氨酸。为了消除这种辅因子的影响,可以敲除编码磷酸葡萄糖异构酶的基因pgi,增加通过磷酸戊糖途径的碳流而生成更多的NADPH[27]。 这 样 获 得 的 菌 株的ATCC13032ΔaceEΔpqoΔpgipJC4ilv BNCE分 批 发 酵 能 产 生412 mmol/L(48.3 g/L)的L-缬氨酸[28]。最近,Hasegawa等人通过修饰AHAIR和取代TA的方式,将对辅因子NADPH的需求转变成对NADH的需求,也大幅度提高了L-缬氨酸的产量[29]。
3.3 解除反馈抑制和优化启动子活性
Elisakova等人[8]通过定点突变技术将染色体上ilv N基因编码的AHAS的小亚基的第20~22位氨基酸由原来的GlyIleIle突变为Asp AspPhe,导致AHAS完全解除了3种支链氨基酸的反馈抑制,在此基础上敲除了ilv A和pan B基因,并转入重组质粒p ECKAilv BNC,构建的工程菌株ilv NM13Δilv AΔpanBpECKAilv BNC能产生130 mmol/L(15.2 g/L)的 L-缬氨酸。以ilv NM13菌株为背景,利用染色体定点突变技术,Holakto等人[30]首先通过减弱ilv A和leu A基因的启动子活性,导致L-异亮氨酸和L-亮氨酸的合成速率下降,其次增强ilvD和ilvE基因的启动子活性,所得菌株ilv NM13ΔpanBP-ilv AM1CGP-ilv DM7P-ilv EM6在48 h内摇瓶发酵能产生136 mmol/L (15.9 g/L)的L-缬氨酸。这些数据说明通过谷氨酸棒杆菌染色体上的定点突变来提高L-缬氨酸的产量也是可行的。
4 展 望
理性设计是代谢工程育种策略的最大优势,这样构建的谷氨酸棒杆菌不仅能够最大限度地积累L-缬氨酸,而且能够最大限度的减少杂酸,简化后续分离提纯工艺,降低生产成本。目前,谷氨酸棒杆菌L-缬氨酸生产菌的理性设计研究主要围绕L-缬氨酸的生物合成途径,从以下几个方面展开:首先,在DNA层次上进行其编码基因的序列分析,通过定点突变消除转录弱化的调控和改变启动子的活性;其次,在蛋白质层次上解析这些酶的催化结构域和调节结构域,通过理性改造提高其催化活性和抗反馈抑制能力;最后,通过高效表达其编码基因将碳流最大限度地导向L-缬氨酸的合成。
L-缬氨酸的生物合成途径固然是优化改进谷氨酸棒杆菌的关键,但并不是全部。要构建最优的谷氨酸棒杆菌L-缬氨酸生产菌,还有很多其它的因素要考虑。未来代谢工程研究应针对谷氨酸棒杆菌细胞的整体代谢网络,结合转录组学、蛋白组学、代谢组学和计算机建模等现代生物技术[31],全面分析影响L-缬氨酸生产的所有节点,提出全局性的菌种改进优化策略。
(References):
[1]Kinoshita S,Udaka S,Shimono M.Studies on the amino acid fermentation.Part 1.Production of L-glutamic acid by various microorganisms[J].J Gen Appl Microbiol,1957,3:193-205.
[2]Kalinowski J,Bathe B,Bartels D,et al.The completeCorynebacteriumglutamicumATCC13032 genome sequence and its impact on the production of L-aspartate-derived amino acids and vitamins[J].J Biotechnol,2003,104:5-25.
[3]Leyval D,Uy D,Delaunay S,et al.Characterisation of the enzyme activities involved in the valine biosynthetic pathway in a valine-producing strain ofCorynebacteriumglutamicum[J].J Biotechnol,2003,104:241-252.
[4]Keilhauer C,Eggeling L,Sahm H.Isoleucine synthesis inCorynebacteriumglutamicum:molecular analysis of the ilvB-ilv N-ilvC operon[J].J Bacteriol,1993,175:5595-5603.
[5]Mc Hardy AC,Tauch A,Ruckert C,et al.Genome-based analysis of biosynthetic aminotransferase genes ofCorynebacteriumglutamicum[J].J Biotechnol,2003,104:229-240.
[6]Marienhagen J,Kennerknecht N,Sahm H,et al.Functional analysis of all aminotransferase proteins inferred from the genome sequence ofCorynebacteriumglutamicum[J].J Bacteriol,2005,187:7639-7646.
[7]Eggeling I,Cordes C,Eggeling L,et al.Regulation of acetohydroxy acid synthase inCorynebacteriumglutamicumduring fermentation of alfa-ketobutyrate to L-isoleucine[J].Appl Microbiol Biotechnol,1987,25:346-351.
[8]Elisáková V,Pátek M,Holátko J,et al.Feedback-resistant acetohydroxy acid synthase increases valine production inCorynebacteriumglutamicum[J].Appl Environ Microbiol,2005,71:207-213.
[9]Morbach S,Junger C,Sahm H,et al.Attenuation control ofilv BNCinCorynebacteriumglutamicum:evidence of leader peptide formation without the presence of a ribosome binding site[J].J Biosci Bioeng,2000,90:501-507.
[10]Kennerknecht N,Sahm H,Yen MR,et al.Export of L-isoleucine fromCorynebacteriumglutamicum:a two-gene-encoded membe of a new translocator family[J].J Bacteriol,2002,184(14):3947-3956.
[11]Lange C,Mustafi N,Frunzke J,et al.Lrp ofCorynebacteriumglutamicumcontrols expression of the brnFE operon encoding the export system for L-methionine and branched-chain amino acids[J].J Biotechnol,2011,doi:10.1016/j.jbiotec.2011.06.003.
[12]Tsuchida T,Yoshinaga F,Kubota K.Production of L-valine by 2-thiazolealanine resistant mutants derived from glutamic acid bacteria[J].Agric Biol Chem,1975,39:1319-1322.
[13]Nielsen J.Metabolic Engineering:techniques for analysis of targets for genetic manipulations[J].Biotechnol Bioeng,1998,58:125-132.
[14]Bailey J E.Towards a science of metabolic engineering[J].Science,1991,252:1668-1674.
[15]Radmacher E,Vaitsikova A,Burger U,et al.Linking central metabolism with increased pathway flux:L-valine accumulation byCorynebacteriumglutamicum[J].Appl Environ Microbiol,2002,68:2246-2250.
[16]Xu D,Tan Y,Huan X,et al.Construction of a novel shuttle vector for use inBrevibacteriumflavum,an industrial amino acid producer[J].J Microbiol Methods,2010,80:86-92.
[17]Xu D,Tan,Y,Shi,F,et al.An improved shuttle vector constructed for metabolic engineering research inCorynebacteriumglutamicum[J].Plasmid,2010,64:85-91.
[18]Okibe N,Suzuki N,Inui M,et al.Efficient markerless gene replacement inCorynebacteriumglutamicumusing a new temperature-sensitive plasmid[J].J Microbiol Methods,2011,85(2):155-163.
[19]Tan,Y,Xu,D,Li,Y,et al.Construction of a novel sacB-based system for marker-free gene deletion inCorynebacteriumglutamicum[J].Plasmid,2012,67:44-52.
[20]Holátko J,Elisáková V,Prouza M,et al.Metabolic engineering of the L-valine biosynthesis pathway inCorynebacterium glutamicumusing promoter activity modulation[J].J Biotechnol,2009,139(3):203-210.
[21]Xu,D,Tan,Y,Li,Y,et al.Construction of a novel promoter-probe vector and its application for screening strong promoter forBrevibacteriumflavummetabolic engineering[J].World J Microbiol Biotechnol,2011,27:961-968.
[22]Blombach B,Schreiner ME,Holátko J,et al.L-valine production with pyruvate dehydrogenase complex-deficientCorynebacteriumglutamicum[J].Appl Environ Microbiol,2007,73:2079-2084.
[23]Blombach B,Arndt A,Auchter M,et al.L-valine production during growth of pyruvate dehydrogenase complex deficientCorynetacteriumglutamicumin the presence of ethanol or by inactivation of the transcriptional regulator SugR[J].Appl Environ Microbiol,2009,75:1197-1200.
[24]Wada M,Hijikata N,Aoki R,et al.Enhanced valine production inCorynebacteriumglutamicumwith defective H+-ATPase and C-terminal truncated acetohydroxyacid synthase[J].Biosci Biotechnol Biochem,2008,72:2959-2965.
[25]Marienhagen J,Eggeling L.Metabolic function ofCorynebacteriumglutamicumaminotransferases Ala T and Avt A and impact on L-valine production[J].Appl Environ Microbiol,2008,74:7457-7462.
[26]Wendisch VF,de Graaf AA,Sahm H,et al.Quantitative determination of metabolic fluxes during coutilization of two carbon sources:comparative analyses withCorynebacteriumglutamicumduring growth on acetate and/or glucose[J].J Bacteriol,2000,182(11):3088-3096.
[27]Bartek T,Blombach B,Zönnchen E,et al.Importance of NADPH supply for improved L-valine formation inCorynebacteriumglutamicum[J].Biotechnol Prog,2010,26:361-371.
[28]Blombach B,Schreiner M E,Bartek T,et al.Corynebacteriumglutamicumtailored for high-yield L-valine production[J].Appl Microbiol Biotechnol,2008,79:471-479.
[29]Hasegawa S,Uematsu K,Natsuma Y,et al.Improvement of the redox balance increases L-valine production byCorynebacteriumglutamicumunder oxygen deprivation[J].Appl Environ Microbiol,2011,doi:10.1128/AEM.07056-11.
[30]Holátko J,ElišákováV,Prouza M,et al.Metabolic engineering of the L-valine biosynthesis pathway inCorynebacterium glutamicumusing promoter activity modulation[J].J Biotechnol,2009,139:203-210.
[31]Park J H,Lee K H,Kim T Y,et al.Metabolic engineering ofEscherichiacolifor the production of L-valine based on transcriptome analysis andinsilicogene knockout simulation[J].Proc Natl Acad Sci USA,2007,104:7797-7802.
Metabolic Engineering inCorynebacteriumglutamicumto Increase L-Valine Production
WANGXiao-yuan
(State Key Laboratory of Food Science and Technology,Jiangnan University,Wuxi 214122,China)
L-valine,one of the three branched-chain amino acids,is essential for human,and plays an important role in the metabolism of life,therefore,it is widely used in products of food,medicine and feed.L-valine is mainly produced by bacterial fermentation,and the most used bacterium is Corynebacterium glutamicum.In this article,the pathway and regulation of L-valine biosynthesis in C.glutamicum are analyzed and researches on metabolic engineering to increase L-valine production in C.glutamicum are reviewed.
Corynebacteriumglutamicum,L-valine production,metabolic engineering,fermentation,branched-chain amino acids
Q 933
A
1673-1689(2012)03-0225-07
2012-02-20
王小元(1965-),男,山西垣曲人,工学博士,教授,博士研究生导师,主要从事工业微生物代谢工程方面的研究。E-mail:xiaoyuanwang@hotmail.com

