生物电化学法转化甘油生产1,3-二羟基丙酮
张雨薇, 杨雪鹏, 魏东芝, 艾志录
(1.河南农业大学 食品科学技术学院,河南 郑州 450002;2.郑州轻工业学院 食品与生物工程学院,河南 郑州 450002)
生物电化学法转化甘油生产1,3-二羟基丙酮
张雨薇1,2, 杨雪鹏2, 魏东芝2, 艾志录*1
(1.河南农业大学 食品科学技术学院,河南 郑州 450002;2.郑州轻工业学院 食品与生物工程学院,河南 郑州 450002)
氧化葡萄糖酸杆菌中依赖辅基吡咯喹啉醌(Pyrroloquinoline Quinone,PQQ)的膜结合甘油脱氢酶(Glycerol dehydrogenase,GDH)是酶法转化甘油生成 1,3-二羟基丙酮(1,3-Dihydroxyacetone,DHA)的关键酶。以铁氰化钾为电子媒介体,采用生物电化学法,再生甘油脱氢酶的辅基PQQ,从而实现酶法循环转化甘油生产DHA。设计电耦联反应装置,在(28±2)℃,370 m V电压下反应18 h,DHA质量浓度达到27.21 g/L,甘油转化率为52.93%。
1-3二羟丙酮;甘油脱氢酶;生物电化学法;氧化葡萄糖酸杆菌
二羟基丙酮或1,3-二羟基丙酮,英文名为1,3-dihydroxyacetone 或 dihydroxyactone, 简 写 为DHA[1],是一种重要的医药中间体和功能添加剂,在国外已得到广泛应用。作为生产DHA的原料——甘油随着近年来生物柴油的迅速发展而大量产生。因此,生物法转化甘油生产DHA的研究对于延伸石化产品生产链,创造更好的经济和社会效益,提升行业竞争力具有积极作用。
生物法生产DHA可以分为微生物法和酶法两种。其中酶法生产过程中需要大量辅酶,而辅酶价格昂贵,因此在酶法生产中有必要对辅酶进行循环再生。目前,报道的辅酶再生的方法主要集中在双酶耦联反应[2-3]。
作者针对氧化葡糖酸杆菌膜结合甘油脱氢酶(GDH)(EC1.1.99.22)[4],设计生物电化学法再生甘油脱氢酶辅基PQQ,从而实现甘油到二羟基丙酮的持续转化,进而提高产品得率。
1 材料与方法
1.1 材料
1.1.1 菌种氧化葡萄糖酸杆菌(Gluconobacter oxy dans):作者所在实验室保存。
1.1.2 培养基斜面培养基:8 g/d L 山梨醇,2 g/d L酵母粉,1 g/d L 氯化钠,2 g/d L 琼脂,自然p H。
种子培养、基础发酵培养基:8 g/d L山梨醇,2 g/d L酵母粉,1 g/d L氯化钠,自然p H。
1.1.3 主要试剂二羟丙酮显色液:二苯胺4.8 g,浓硫酸48 m L,冰醋酸432 m L,混匀,避光保藏;吩嗪 硫 酸 甲 酯 (PMS)、2,6-二 氯 酚 吲 哚 酚 纳(DCIP):美国Sigma公司;酵母粉:Oxoid公司;D-山梨醇:北京Solarbio公司;甘油、铁氰化钾等试剂均为分析纯。
1.1.4 主要仪器UV2300紫外可见分光光度仪:上海光谱仪器有限公司;HZQ-F160全温振荡培养箱:上海福玛实验设备有限公司;Cs350电化学工作站:武汉科思特仪器有限公司;DS65A高速冷冻离心机:美国Beckman公司;ZF-3恒电位仪:上海正方电子电器有限公司;甘油含量测定试剂盒:北京五洲原业科贸公司。
1.2 方法
1.2.1 氧化葡萄糖酸杆菌的培养将保藏斜面菌种转接斜面培养温度28℃,培养周期2~3 d。挑取一环斜面菌种,接种于装有50 m L种子培养基的150 m L摇瓶中,28℃、200 r/min摇床培养24 h。
按体积分数10%接种量将种子培养液接入1 L发酵培养基中,200 r/min、28℃培养至对数后期(约36 h)。
1.2.2 细胞膜组分的制备离心收集菌体,收集的菌体用蒸馏水洗涤两次后重悬于50 mmol/L醋酸钠(p H 5.0)缓冲液中,通过匀浆机破碎细胞,利用超速离心机100 000g离心60 min,上清液为细胞质组分,沉淀为细胞膜组分,用相同的缓冲液悬浮[5-6]。
1.2.3 膜结合甘油脱氢酶的制备将膜组分重新重悬于含体积分数1%Triton X-100的40 mmol/L、p H 5.0的醋酸钠缓冲液中,于4℃缓慢搅伴60 min。1 000 r/min离心30 min去沉淀,上清液作为待纯化的样品。
经过CM-Cellulose(1×10)柱和Sephacryl HR 400(1×120)凝胶层析柱得到分离纯化的氧化葡萄糖酸杆菌膜结合甘油脱氢酶[7-8]。
1.2.4 甘油脱氢酶活性测定以PMS为电子受体,在催化反应过程中检测600 nm吸收值的变化。酶活力测定的反应体系组成为:0.325 mmol/L PMS 0.45 m L、0.25 mmol/L DCIP 0.45 m L、100 mmol/L pH 6.0磷酸缓冲液3 m L和水4.5 m L,即配即用。首先向比色皿里加入基本反应液0.4 m L、200 mmol/L甘油0.1 m L置于1 cm的比色皿中,30℃ 预热5 min,600 nm下吸收值平衡,然后加入酶液10μL立即进行时间扫描。在p H 6.0下DCIP的消光系数为10.8 L/mmol,一个酶活力单位(U)定义为1分钟还原1μmol的DCIP的酶量。
1.2.5 蛋白质质量浓度的测定采用Lowry法[9]测定蛋白质质量浓度,以牛血清白蛋白作为标准品。称取牛血清白蛋白10 mg,用0.15 mol/L NaCl溶液溶解,并定容至10 mL,最终质量浓度为1 mg/mL。
1.2.6 线性循环伏安曲线线性循环伏安曲线的测定在Cs350电化学分析系统上进行,铂盘电极为工作电极,铂丝电极为对电极,饱和甘汞电极(SCE)为参比电极。所有实验均在(28±2)℃、含0.5 mmol/L K3[Fe(CN)6],0.1 mol/L KNO3,60 g/L甘油的电解液中进行。扫描速率为16 m V/s,扫描范围为-200~+500 m V。
1.2.7 生物电化学耦联反应生物电化学反应的装置见图1。铂盘电极为工作电极,铂电极为对电极,饱和甘汞电极(SCE)为参比电极,向反应容器中加入55 m L反应液,加入5 m L(约5 U)纯化后的甘油脱氢酶酶液通电后反应开始,电压为370 m V,反应18 h。所有反应均在在(28±2)℃进行。每隔2 h取1 m L反应液,测定反应液中甘油和二羟丙酮的含量。

图1 生物电化学反应装置示意图Fig.1 Experimental setup of bio-electrochemical preparation of 1,3-Dihydroxyacetone using GDH
1.2.8 DHA定量分析方法将反应液离心(5 000 r/min,10 min),取0.5 m L上清液稀释至5 m L,取0.5 m L十倍稀释液与4.5 m L显色液在试管中混匀,置于沸水浴中反应15 min,流动水冷却15 min后于分光光度计测量620 nm处的吸光值。这一方法可在甘油存在下,定量检测出发酵液中质量浓度为0~3.5 mg/m L的DHA[10]。
1.2.9 甘油定量分析方法使用甘油含量测定试剂盒(北京五洲原业科贸公司)测定反应液中甘油残余量。
2 结果与分析
2.1 膜结合甘油脱氢酶的制备
氧化葡萄糖酸杆菌膜结合甘油脱氢酶的制备主要经过3个步骤:1)细胞膜组分的分离;2)表面活性剂溶解膜蛋白;3)CM-纤维素柱和Sephacryl HR 400(1×120)凝胶柱层析。氧化葡萄糖酸杆菌中膜结合甘油脱氢酶的蛋白质分离纯化过程见表1。

表1 膜结合蛋白的纯化总表Tab.1 Purification of membrane-bound glycerol dehydrogenase from G.oxydans
氧化葡萄糖酸杆菌中存在着两种形式的甘油脱氢酶,其中膜结合脱氢酶(EC1.1.99.22)代谢途径是不需要ATP和辅酶因子NAD+,甘油可被细胞膜上的甘油脱氢酶一步直接氧化成DHA,这一过程的电子传递链由泛醌、细胞色素O和细胞色素O还原性酶组成[11]。因此通过分离纯化的膜结合甘油脱氢酶无法连续利用甘油催化生成DHA。
2.2 循环伏安曲线
分别向含有0.5 mmol/L K3[Fe(CN)6],0.1 mol/L KNO3,60 g/L甘油的电解液中添加2、4、6、8 U的甘油脱氢酶,得到的循环伏安曲线见图2。随着甘油脱氢酶浓度的增加,还原电流响应降低。
随着甘油脱氢酶的加入,一部分[Fe(CN)6]3-与PQQH2反应,见图3。电极表面的[Fe(CN)6]3-浓度降低,还原电流相应降低。反应方程式为:

图2 不同GDH浓度下铁氰化钾循环伏安曲线Fig.2 Cyclic Voltammogram of K3[Fe(CN)6]in the presence of GDH
通过循环伏安曲线,可以确定生物电化学法可以催化甘油脱氢酶辅基PQQ的再生,使膜结合甘油脱氢酶可以在只有电子媒介体存在而不添加任何辅酶的情况下连续催化甘油生成二羟基丙酮。

图3 生物电化学法催化甘油生成二羟基丙酮原理Fig.3 Bio-electrochemical preparation of DHA from glycerol using GDH
2.3 生物电化学反应
在生物电化学反应装置中加入含有10 mmol/L K3[Fe(CN)6],60 g/L甘油的电化学反应液55 m L,加入5 m L(约5 U)纯化后的甘油脱氢酶,在(28±2)℃,370 m V电压下反应18 h。甘油脱氢酶催化甘油生成DHA反应曲线见图4。
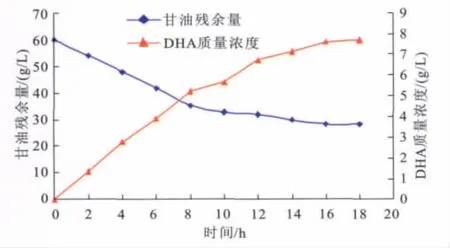
图4 生物电化学法生产DHA曲线Fig.4 Time courses of bio-electrochemical conversion of DHA using GDH
由图4可见,在电化学的作用下,膜结合甘油脱氢酶可以持续催化甘油生成DHA,反应18 h后,DHA质量浓度达27.21 g/L,甘油转化率达到52.93%,电耦联反应速率1.51 g/(L·h)。
3 结 语
通过实验证明,生物电化学法可以持续利用氧化葡萄糖酸杆菌膜结合甘油脱氢酶制备1,3-二羟基丙酮,而不需要添加其他辅酶。18 h内DHA的质量浓度达到27.21 g/L,甘油转化率为52.93%。
与传统的微生物发酵法和酶法相比,电耦联法生产过程中产生的副产物较少,有利于DHA分离和纯化;且操作简单不需要添加大量辅酶,有利于节约成本。
作者只针对生物电化学法催化甘油生成DHA可行性进行了初步研究,生物电化学法应用于生产中仍需要对膜结合甘油脱氢酶的分离纯化以及反应条件进一步研究和优化。
(References):
[1]宋如,钱仁渊,仝艳.等.二羟基丙酮生产研究进展[J].化工技术与开发,2009,38(7):25-30.
SONG Ru,QIANG Ren-yuan,TONG Yan,et al.Research advances in Dihydroxyace-tone production[J].Technology and Development of Chemical Industry,2009,38(7);25-30.(in Chinese)
[2]方柏山,陈宏文.一种由生物催化转化甘油制备1,3-丙二醇和二羟基丙酮的方法:CN1840668 A[P],2006-01-27.
[3]Nemeth A,Balassy A,Sevella B.Difficulties and solutions for the assays of the key enzymes of a new enzymatic glycerol bioconversion[J].Period Polytech Chem Eng,2008,52(1):17-22.
[4]刘耀平,徐明恺,金玉兰,等 .氧化葡萄糖酸杆菌酶学和分子生物学研究[J].微生物学杂志,2003,23(3):39-47.
LIU Yao-ping,XU Ming-kai,JIN Yu-lan,et al.Effect of antibiotics on pathogenic microbes[J].Journal of Microbiology,2003,23(3):39-47.(in Chinese)
[5]Yang X P,Wei L J,Lin J P,et al.Membrane-bound pyroloquinoline quinone-dependent dehydrogenase inGluconobacteroxydansM5,responsible for production of 6-(2-hydroxyethyl)Amino-6-deoxy-L-sorbose[J].Applied and Environmental Microbiology,2008,74(16):5250-5253.
[6]韦柳静,林金萍,杨雪鹏,等.氧化葡萄糖酸杆菌DSM 2003膜结合乙醇脱氢酶的纯化鉴定和性质研究[J].食品科学,2010,34(13):164-168.
WEI Liu-Jin,LIN Jin-Ping,YANG Xue-peng,et al.Purification,identification and characterization of membrane-bound alcohol dehydrogenase fronGluconobacteroxydansDSM 2003[J].Food Science,2010,34(13):164-168.(in Chinese)
[7]Ameyama M,Shinafawa E,Matsushita K,et al.Solubilization,purification and properties of membrane-bound glycerol dehydrogenase fromGluconobacterindustrius[J].Agric Biol Chem,1985,49(4):1001-1010.
[8]陈宏,吴雅红,吴振华,等.克雷伯杆菌甘油脱氢酶的分离纯化及性质[J].无锡轻工大学学报,2005,24(1):1-5.
CHEN Hong,WU Ya-hong,WU Zhen-hua,et al.Purification and characterization of glycerol dehydrogenase fromKlebsiellapneumoniae[J].Journal of Wuxi University of Light Indusrty,2005,24(1):1-5.(in Chinese)
[9]Lowry O,Rosebrough N,Farr A,et al.Protein measurement with the Folin phenol reagent[J].Journal of Biological Chemistry,1951,193(1):265-275.
[10]郑裕国,张霞,沈寅初 .微生物转化甘油生产1,3二羟基丙酮的菌株筛选[J].浙江工业大学学报,2001,9(2):124-127.
ZHENG Yu-guo,ZHANG Xia,SHEN Yan-chu.Screening of 1,3-dihydroxyacet on producing strain using glycerol as bioconversion substrate[J].Journal of Zhejiang University of technology,2001,9(2):124-127.(in Chinese)
[11]孙丽慧,胡忠策,郑裕国,等.微生物法生产1,3-二羟基丙酮代谢工程研究进展[J].生物工程学报,2010,26(9):1218-1224.
SUN Li-hui,HU Zhong-che,ZHENG Yu-guo,et al.progress in metabolic engineering of microbial production of 1,3-dihydroxyacetone[J].Chinese Journal of Biotechnology,2010,26(9):1218-1224.(in Chinese)
Bio-Electrochemical Synthesis of 1,3-Dihydroxyacetone from Glycerol
ZHANGYu-wei1,2,YANGXue-peng2,WEIDong-zhi2,AIZhi-lu*1
(1.College of Food Science and Technology,He'nan Agricultural University,Zhengzhou 450002,China;2,College of Food and Biological Engineering,Zhengzhou University of Light Industry,Zhengzhou 450002,China)
The membrane-bound glycerol dehydrogenase(GDH)was the key enzyme of biocon version of glycerol to 1,3-dihydroxyacetone byGluconobacteroxydans.The membrane fraction ofGluconobacteroxydanswas collected by ultra-centrifugation,and GDH was isolated from the membrane fraction and purified by CM-cellulose column and Sephacryl HR 400 column chromatography.The electrochemical regeneration of the membrane-bound glycerol dehydro genase was studied by cyclic voltammetry.Using this system,the bio-electrochemical preparation of 1,3-dihydroxyacetone(DHA)from glycerol without coenzyme was investigated.When the temperature was 28±2℃,during 18 h,the DHA production reached at 27.21g/L and the conversion rate of glycerol was 52.93%.
1,3-dihydroxyacetone,glycerol dehydrogenase,bio-electrochemistry,Gluconobacteroxydans
Q 815
A
1673-1689(2012)03-0266-05
2011-03-04
国家自然科学基金项目(20976053);郑州轻工业学院博士科研基金项目。
*
艾志录(1965-),男,河南辉县人,工学博士,教授,硕士研究生导师,主要从事农产品精深加工方面的研究。E-mail:zhila@163.com

