铜绿假单胞菌对支气管扩张患者气道中基质金属蛋白酶-9和金属蛋白酶组织抑制因子-1表达的影响
金 前,黄飞华,周 颖,张影清,柴秀娟
1浙江省立同德医院呼吸科,杭州 310012
2嘉兴市第一医院呼吸科,浙江嘉兴 314000
铜绿假单胞菌对支气管扩张患者气道中基质金属蛋白酶-9和金属蛋白酶组织抑制因子-1表达的影响
金 前1,黄飞华1,周 颖1,张影清2,柴秀娟1
1浙江省立同德医院呼吸科,杭州 310012
2嘉兴市第一医院呼吸科,浙江嘉兴 314000
目的对不同细菌感染的支气管扩张 (BE)患者气道中基质金属蛋白酶-9(MMP-9)、金属蛋白酶组织抑制因子-1(TIMP-1)的表达进行研究,分析铜绿假单胞菌 (PAE)对MMP-9、TIMP-1表达的影响。方法采用病例对照研究的方法,分设BE组及对照组,BE组又根据支气管肺泡灌洗液 (BALF)培养结果分为PAE组及其他菌株组两个亚组。收集患者的BALF,ELISA法检测其中MMP-9和TIMP-1的浓度,并计算TIMP-1/MMP-9比值。同时取气管内膜活检组织,免疫组织化学法检测其中MMP-9及TIMP-1的表达。结果MMP-9在PAE组及其他菌株组的BALF中均明显升高 (P均=0.0000);MMP-9在PAE组 (P=0.0421)及其他菌株组 (P=0.0003)支气管内膜活检组织中的表达亦明显升高。TIMP-1在PAE组BALF中的浓度明显低于其他菌株组 (P=0.0324);BALF中TIMP-1/MMP-9比值在BE组明显低于对照组 (P=0.0000),PAE组明显低于其他菌株组 (P=0.0026)及对照组 (P=0.0000),而其他菌株组又明显低于对照组 (P=0.0000)。结论PAE感染可能是通过促使MMP-9分泌并抑制TIMP-1同步分泌而使BE病情恶化。
铜绿假单胞菌;支气管扩张;基质金属蛋白酶-9;金属蛋白酶组织抑制因子-1
支气管扩张 (bronchiectasis,BE)是支气管永久性扩张,具有潜在破坏性,可导致呼吸道反复化脓性感染、排痰功能下降、呼吸短促及咯血,从而耗费巨大的医疗资源。虽然欠缺BE流行病学方面的统计数据,但随着结核病在世界范围内的抬头和过敏性支气管肺曲霉病发病率的升高,BE发病率亦不断升高[1]。BE并发症的治疗耗费了巨大的医疗资源,BE的10年死亡率也高达30%[2],故开发有效的对因治疗措施迫在眉睫。目前针对BE发病机制的研究较少,从而使该病在阻遏其进展方面的措施极其欠缺。
铜绿假单胞菌 (pseudomonas aeruginosa,PAE)是BE患者气道感染最常见的病原菌,大部分BE患者气道中存在该细菌定植,该定植菌大量繁殖是BE患者症状加重的主要原因,并促使BE患者出现各种并发症。BE以支气管基质破坏为主要病理基础,而基质金属蛋白酶 (matrix metalloproteinases,MMPs)能降解细胞外基质成分,且BE主要为中性粒细胞浸润,该细胞可产生MMP-9[3],从而对支气管基质产生一定破坏。金属蛋白酶组织抑制因子-1(tissue inhibitor of metalloproteinase-1,TIMP-1)是MMP-9的天然抑制剂,能抑制MMP-9活性,减少MMP-9对基质的破坏降解。目前PAE导致BE病情进展、恶化的机制尚不明确,而PAE与MMPs之间的关系亦不清楚。本研究对不同细菌感染的BE患者支气管肺泡灌洗液 (bronchoalveolar lavage fluid,BALF)及支气管内膜活检组织中MMP-9、TIMP-1的表达进行研究,分析了PAE对MMP-9、TIMP-1表达的影响,以期遏制PAE在BE病情进展中的作用。
对象和方法
对象 2008年7月至2010年8月在浙江省立同德医院及嘉兴市第一医院的就诊的BE患者30例,其中,男18例,女12例,平均年龄 (47.0±16.1)岁;对照组为同时期因体检偶然发现肺部单个阴影(阴影平均直径≤2 cm)而行支气管镜检查,但气管镜及其他实验室检查无异常的健康人 (n=30),其中,男18例,女12例,平均年龄 (45.7±14.4)岁;两组在年龄和性别构成方面差异无统计学意义(P>0.05)。BE组纳入标准:根据病史及高分辨率计算机体层X线摄影术 (high resolution computerized tomography,HRCT)确诊为BE,无哮喘、慢性阻塞性肺疾病 (chronic obstructive pulmonary disease,COPD)等其他呼吸道疾病。BE分级标准:(1)重度:频发肺部感染及咳黏液脓性痰 (每年3~6次),双侧多节段支气管膨大变形,变形支气管周边肺组织有不同程度的纤维化;(2)中度:每年发作2~3次的肺部感染及咳脓痰,单侧支气管柱状及膨大变形;(3)轻度:每年极少发作肺部感染且几乎无咳痰的患者[4]。BE组30例患者中,轻度10例,其中,男6例,女4例,平均年龄 (46.4±15.8)岁;中度10例,其中,男6例,女4例,平均年龄(46.9±18.8)岁;重度10例,其中,男6例,女4例,平均年龄 (47.6±15.2)岁;3组在年龄和性别构成方面差异无统计学意义 (P>0.05)。本研究经浙江省立同德医院及嘉兴市第一医院医学伦理委员会审查通过,所有研究对象均签署了知情同意书。
标本采集及保存 在使用抗生素前采集BALF标本,BE组及对照组分别于病变最严重肺段及右肺下叶基底段行支气管肺泡灌洗,具体为:将20 ml 35~37℃生理盐水注入相应的段支气管内,约1 min后将灌洗液吸入无菌塑料器皿中,如此重复5次,灌洗完毕后将BALF摇匀,并立即取20 ml送至细菌培养室。剩余BALF予以离心,上清液保存于-20℃冰箱备用。BE组及对照组分别于病变最严重肺段、右肺下叶基底段经支气管镜夹取支气管内膜活检组织3块 (病情不允许者不行支气管内膜活检术),活检组织以甲醛溶液浸泡后石蜡包埋切片备用。
BALF中MMP-9和TIMP-1浓度的检测 BALF
上清液置于37℃恒温箱孵育,采用ELISA法检测MMP-9和TIMP-1的浓度,并计算TIMP-1/MMP-9比值。MMP-9及TIMP-1 ELISA试剂盒购自上海蓝基生物科技有限公司,按照说明书使用。
支气管内膜组织中MMP-9和TIMP-1表达的检测 支气管内膜组织以甲醛溶液固定后石蜡包埋,连续切片,常规脱蜡水化后用免疫组织化学SP法检测支气管内膜组织中 MMP-9、TIMP-1的表达 (人MMP-9、TIMP-1免疫组织化学试剂盒均购自上海蓝基生物科技有限公司)。结果判断采用半定量积分法[5],根据每张切片的着色细胞比例及着色深浅计分,着色细胞比例:≤1/3为1分,1/3~2/3为2分,≥2/3为3分;着色深度:无着色为0分,浅黄色为1分,棕黄色为2分,棕褐色为3分。然后根据两者乘积判断阳性等级:0分为阴性 (-),1~2分为弱阳性 (+),2~4分为阳性 (++),>4分为强阳性 (+++)。最后取3块活检组织平均分。
统计学处理 采用Stata 11.0统计软件,组间比较采用两个独立样本均数t检验,PAE与其他菌株在BE轻、中、重组中的分布情况及组织标本的免疫组织化学结果采用Cochran-Mantel-Haenszel方法通过计算行平均分检验,P<0.05为差异有统计学意义。
结 果
痰培养结果 对照组BALF培养均为阴性。BE组30例患者的BALF中,24例细菌培养为阳性,其中PAE 11例,其他菌株13例 (肺炎克雷伯杆菌3例,产碱假单胞菌3例,大肠埃希菌3例,阴沟肠杆菌2例,金黄色葡萄球菌1例,鲁氏不动杆菌1例)。PAE组11例患者中,男7例,女4例,平均年龄 (47.5±15.5)岁;轻、中、重度患者分别为2、4、5例。其他菌株组13例患者中,男8例,女5例,平均年龄 (49.2±15.5)岁;轻、中、重度患者分别为3、5、5例。两组在年龄、性别构成和轻、中、重度构成方面差异均无统计学意义 (P均>0.05)。
BE组及对照组BALF中TIMP-1、MMP-9的浓度及其比值 BE组BALF中MMP-9浓度为 (210.22±34.61)ng/ml,明显高于对照组的(111.17±23.98)ng/ml(P=0.0000);BE组和对照组的TIMP-1浓度分别为(567.11±153.58)和 (601.64±165.17)pg/ml,差异无统计学意义 (P=0.4052)。对照组TIMP-1/MMP-9比值为 (5.38±0.13) ×10-3,明显高于BE组的 (2.69±0.54) ×10-3(P=0.0000)。
PAE组、其他菌株组及对照组BALF中TIMP-1、MMP-9的浓度及其比值 PAE组的TIMP-1浓度为(507.92±148.77)pg/ml,明显低于其他菌株组的(640.53±135.56)pg/ml(P=0.0324),但与对照组的 (601.64±165.17)pg/ml差异无统计学意义(P=0.1069);TIMP-1/MMP-9比值为(2.13±0.58)×10-3,明显低于其他菌株组的 (3.16±0.85)×10-3(P=0.0026)及对照组的 (5.38±0.13) ×10-3(P=0.0000);MMP-9浓度为(507.92±148.77)ng/ml,明显高于其他菌株组的 (206.38±25.22)ng/ml(P=0.0070)及对照组的 (111.17±23.98)ng/ml(P=0.0000)。其他菌株组的TIMP-1浓度与对照组差异无统计学意义 (P=0.4601),TIMP-1/MMP-9比值明显低于对照组 (P=0.0000),MMP-9浓度明显高于对照组 (P=0.0000)。
MMP-9及TIMP-1在PAE组、其他菌株组及对照组中的表达 对照组支气管内膜各层均未见明显染色颗粒,MMP-9表达呈阴性 (图1),TIMP-1在黏膜固有层、黏膜下层仅见少量染色颗粒,TIMP-1表达为弱阳性 (图2)。PAE组支气管黏膜固有层、黏膜下层及透明软骨周围均可见棕褐色染色颗粒,MMP-9分布较广,可存在于组织深部,且MMP-9表达为强阳性 (图3)。其他菌株组支气管黏膜固有层中可见MMP-9染色颗粒,而黏膜下层未见明显染色颗粒,MMP-9主要存在于组织表浅部位,且MMP-9表达为弱阳性 (图4)。PAE组TIMP-1染色颗粒主要分布在黏膜固有层、黏膜下层,分布不均,以局灶性分布为主,表达部位相对表浅 (图5)。其他菌株组中有1例患者TIMP-1表达为强阳性,病理切片上可见其黏膜上皮及固有层有较多的TIMP-1染色颗粒,与该患者MMP-9染色颗粒的分布深度一致 (图6)。
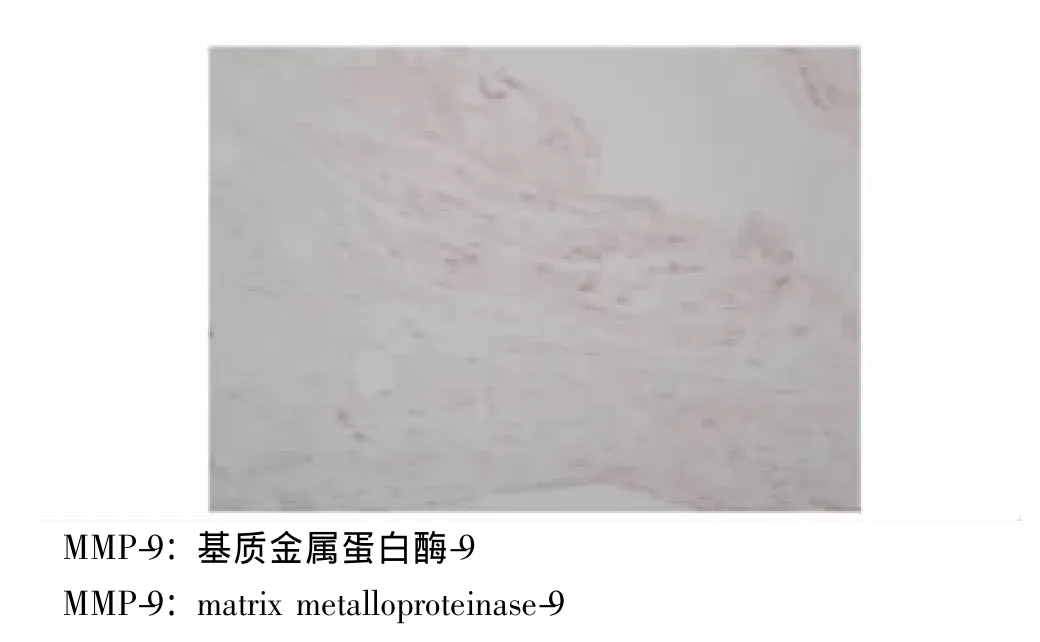
图1 对照组支气管内膜MMP-9免疫组织化学染色结果(×400)Fig 1 Immunohistochemistry result of MMP-9 in the bronchic endomembrane tissue of a subject from the control group(×400)
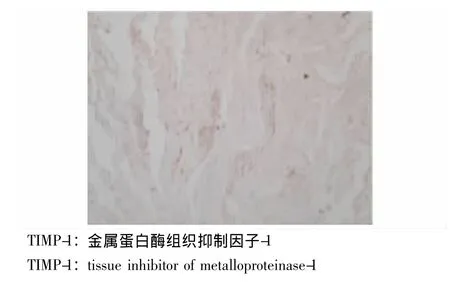
图2 对照组支气管内膜TIMP-1免疫组织化学染色结果(×400)Fig 2 Immunohistochemistry result of TIMP-1 in the bronchic endomembrane tissue of a subject from the control group(×400)
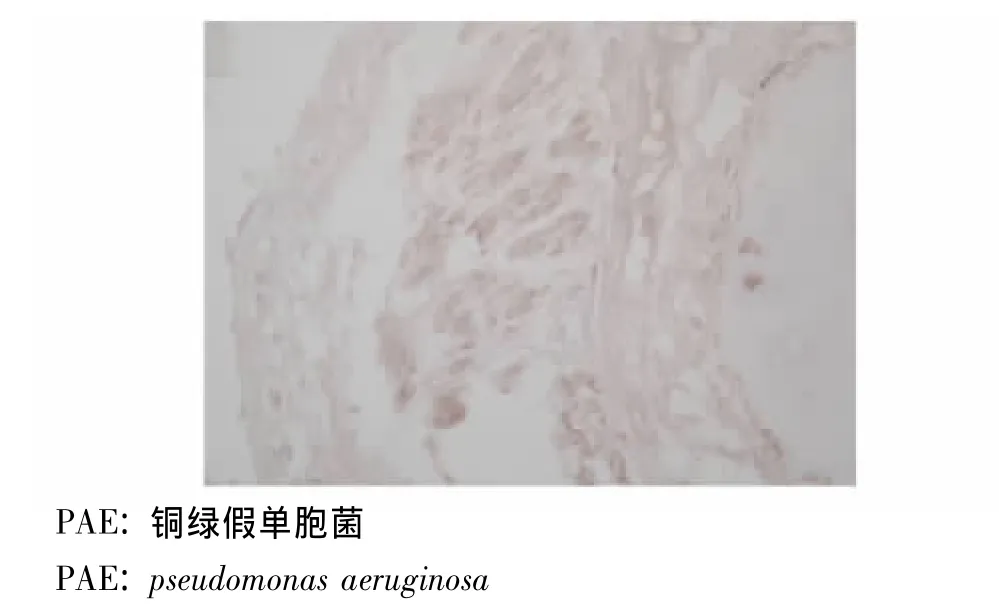
图3 PAE组支气管内膜MMP-9免疫组织化学染色结果(×400)Fig 3 Immunohistochemistry result of MMP-9 in the bronchic endomembrane tissue of a patient from PAE group(×400)
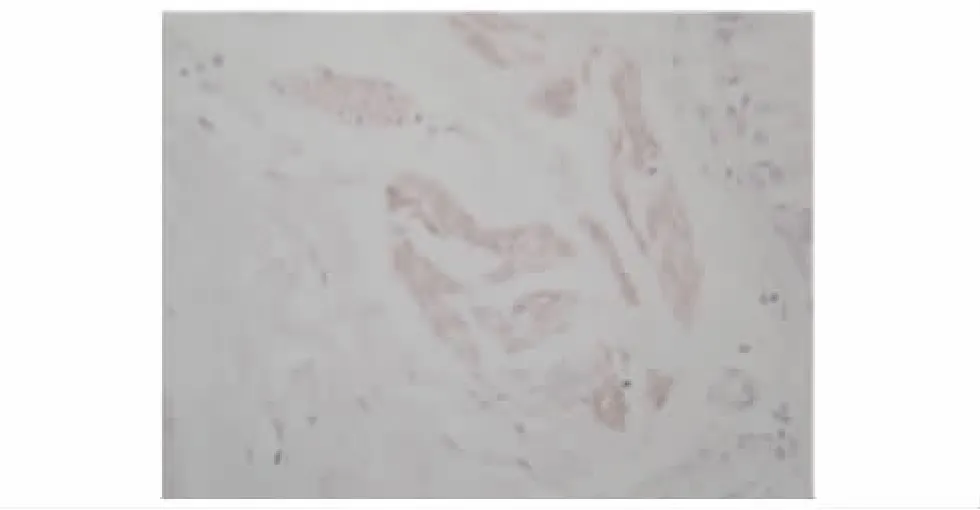
图4 其他菌株组支气管内膜MMP-9免疫组织化学染色结果 (×400)Fig 4 Immunohistochemistry result of MMP-9 in the bronchic endomembrane tissue of a patient from the other bacteria group(×400)
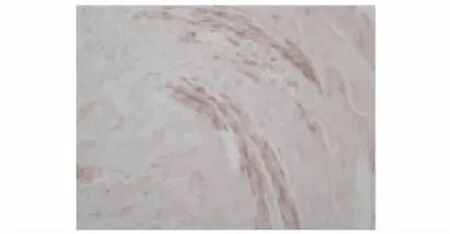
图5 PAE组支气管内膜TIMP-1免疫组织化学染色结果(×400)Fig 5 Immunohistochemistry result of TIMP-1 in the bronchic endomembrane tissue of a patient from PAE group(×400)
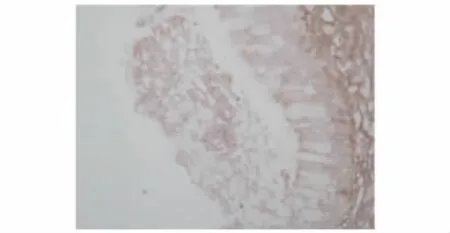
图6 其他菌株组支气管内膜TIMP-1免疫组织化学染色结果 (×400)Fig 6 Immunohistochemistry result of TIMP-1 in the bronchic endomembrane tissue of a patient from the other bacteria group(×400)
BE组及对照组支气管内膜组织中MMP-9及TIMP-1的表达比较 PAE组中1例重度BE患者不能行支气管内膜活检,其他菌株组中重度和轻度BE患者各有1例不能接受活检,BALF培养为阴性的BE患者及对照组均能行支气管内膜活检,不能行活检的原因为气管镜下见活动性出血。BE组MMP-9的表达较对照组明显升高 (P=0.0000),TIMP-1在两组间的表达差异无统计学意义 (P=0.7387)(表1)。
PAE组、其他菌株组及对照组中支气管内膜组织中MMP-9及TIMP-1表达的比较 PAE组中支气管内膜组织中MMP-9的表达较其他菌株组 (P=0.0421)和对照组明显升高 (P=0.0000),其他菌株组支气管内膜组织中MMP-9的表达亦明显高于对照组 (P=0.0003);TIMP-1的表达在3组间差异均无统计学意义 (P均>0.05)(表2)。
讨 论
BE是支气管永久性扩张,具有潜在破坏性,可导致呼吸道反复化脓性感染、排痰功能下降,继而出现呼吸短促及咯血。PAE是BE患者呼吸道反复感染最常见的病原菌,反复感染导致支气管基质进一步破坏。MMP-9在支气管壁表达较多,对基质的降解能力亦较强,TIMP-1为MMP-9的天然抑制剂,能特异性地与MMP-9催化中心的锌离子结合,从而封闭MMP-9的催化活性。TIMP-1和MMP-9在体内维持一定的动态平衡,一旦该平衡被打破,即TIMP-1/MMP-9比值发生变化,使MMP-9相对过多,将产生一系列病理变化[6],故除了 MMP-9升高之外,TIMP-1/MMP-9比值的变化也是基质破坏的关键所在。
本研究结果显示,BE患者BALF及支气管内膜活检组织中MMP-9的表达均有明显升高,而在BE组中,PAE组BALF及支气管内膜活检组织中MMP-9的表达均明显高于其他菌株组,当然,两亚组的该指标均高于对照组;TIMP-1的表达在PAE组与对照组之间差异不明显,而PAE组BALF中TIMP-1浓度却明显低于其他菌株组。在支气管内膜活检组织的免疫组织化学染色中,MMP-9在PAE组中的表达较为广泛,黏膜下层及透明软骨周围均可见明显表达,故初步考虑PAE感染对基质破坏相对严重;而在其他菌株组,MMP-9表达以组织表浅为主,且TIMP-1的表达能覆盖到MMP-9表达的区域,故可相对减少MMP-9对基质的破坏。简言之,BE组MMP-9表达明显升高,其中PAE亚组升高尤为明显,而PAE亚组TIMP-1分泌却未同步上升,从而使该亚组TIMP-1/MMP-9比值明显下降。
在本研究纳入的BE患者中,24例痰培养阳性的病例分为PAE组及其他菌株组两个亚组,两组的严重程度分布上并无差异,但两组间MMP-9、TIMP-1表达及TIMP-1/MMP-9比值情况有显著差异,故该差异并不受病情严重程度的影响,而在于两组病原菌方面的区别。PAE归属于假单胞菌属,是需氧革兰染色阴性杆菌,有研究表明,在PAE性角膜炎患者中检测到一定量的假单胞菌外蛋白酶、假单胞菌弹性蛋白酶及各种促炎细胞因子,而PAE可能通过这些这些蛋白酶及因子刺激MMP-9的过度表达,从而加重对基质的破坏[7-8],这也可能是PAE组MMP-9表达高于其他任何组的原因之一。PAE组TIMP-1未能同步上升的机制目前尚不明确,值得进一步研究。

表1 BE组及对照组支气管内膜组织中MMP-9及TIMP-1表达情况Table 1 Expressions of MMP-9 and TIMP-1 in the bronchic endomembrane tissue of BE group and control group
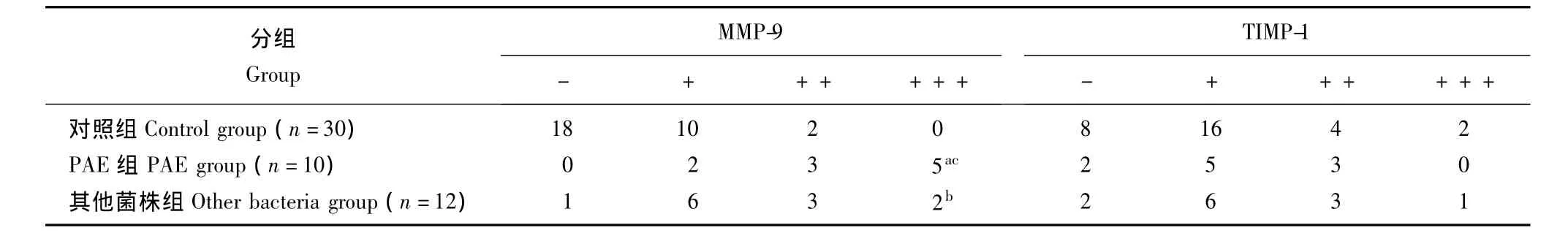
表2 PAE组、其他菌株组及对照组支气管内膜组织中MMP-9及TIMP-1表达情况Table 2 Expressions of MMP-9 and TIMP-1 in the bronchic endomembrane tissue of PAE group,other bacteria group,and control group
综上,BE感染PAE后,气道局部MMP-9分泌明显升高,而TIMP-1的分泌未能同步上升,故TIMP-1/MMP-9比值下降,相对于其他菌株感染,TIMP-1/MMP-9比值下降更为明显,提示BE患者发生PAE感染更能使疾病进展。若能使TIMP-1或其类似物在这类患者中增多,则可减少基质破坏,并在理论上阻止病情的进展。目前国际上并无促进TIMP-1合成分泌的药物问世,但基因重组MMPs抑制剂的研究已较成熟,有一部分已应用于临床,并通过FDA认证后上市[9],重组MMPs抑制剂在控制BE病情进展方面有较高的价值,可以从MMPs抑制剂方面着手,以期开发出控制BE病情进展的新药。
[1]Smith MP.Non-cystic fibrosis bronchiectasis[J].J R Coll Physicians Edinb,2011,41(2):132-139.
[2]Frey JG.Bronchiectasis:a reemerging disease[J].Rev Med Suisse,2007,3(99):477-478,480-483.
[3]Heissig B,Nishida C,Tashiro Y,et al.Role of neutrophilderived matrix metalloproteinase-9 in tissue regeneration[J].Histol Histopathol,2010,25(6):765-770.
[4]Sepper R,Konttinen YT,Ding Y,et al.Human neutrophil collagenase(MMP-8),identified in bronchiectasis BAL fluid,correlates with severity of disease[J].Chest,1995,107(6):1641-1647.
[5]Choi HJ,Park KJ,Shin JS,et al.Tumor budding as a prognostic marker in stage-Ⅲ rectal carcinoma[J].Int J Colorectal Dis,2007,22(8):863-868.
[6]Amǎlinei C,Cǎruntu ID,Giuşcǎ SE,et al.Matrix metalloproteinases involvement in pathologic conditions[J].Rom J Morphol Embryol,2010,51(2):215-228.
[7]Miyajima S,Akaike T,Matsumoto K,et al.Matrix metalloproteinases induction by pseudomonal virulence factors and inflammatory cytokinesin vitro[J].Microb Pathog,2001,31(6):271-281.
[8]Kimura K,Nomi N,Yan ZH,et al.Inhibition of poly(I:C)-induced matrix metalloproteinase expression in human corneal fibroblasts by triptolide [J].Mol Vis,2011,17:526-532.
[9]Mishra A,Bhattacharya P,Paul S,et al.An alternative therapy for idiopathic pulmonary fibrosis by doxycycline through matrix metalloproteinase inhibition [J].Lung India,2011,28(3):174-179.
Effect of Pseudomonas Aeruginosa on the Expressions of Matrix Metalloproteinase-9 and Tissue Inhibitor of Metalloproteinase-1in the Airway of Bronchiectasis Patients
JIN Qian1,HUANG Fei-hua1,ZHOU Ying1,ZHANG Ying-qing2,CHAI Xiu-juan1
1Department of Respiratory Medicine,Tongde Hospital of Zhejiang Province,Hangzhou 310012,China2Department of Respiratory Medicine,the First Hospital of Jiaxing,Jiaxing,Zhejiang 314000,China
JIN Qian Tel:0571-89972427,E-mail:jinqian0504@hotmail.com
ObjectiveTo study the expressions of matrix metalloproteinase-9(MMP-9)and tissue inhibitor of metalloproteinase-1(TIMP-1)in the airway of bronchiectasis(BE)patients,and evaluate the effect ofpseudomonas aeruginosa(PAE)on the expression of TIMP-1 and MMP-9.MethodsIn this casecontrol study,subjects were divided into BE group and control group,and the BE group was further divided into PAE group and other bacteria group based on the culture results of bronchoalveolar lavage fluid(BALF).BALF was obtained by bronchoscopy,the expressions of MMP-9 and TIMP-1 were determined by ELISA,thenthe ratio of TIMP-1/MMP-9 was calculated.Furthermore,the tissue of bronchic endomembrane was obtained by transbronchial biopsy and the expressions of MMP-9 and TIMP-1 were determined using immunohistochemical method.ResultsThe levels of MMP-9 in the BALF of PAE group and other bacteria group were significantly higher than that in control group(P=0.0000 both),and the expressions of MMP-9 in bronchic endomembrane of PAE group and other bacteria group were also significantly higher(P=0.0421 and 0.0003,respectively).The level of TIMP-1 in BALF of PAE group was significantly lower than that in other bacteria group(P=0.0324).The ratio of TIMP-1/MMP-9 in BALF of BE group was significantly lower than that in control group(P=0.0000),and this ratio of PAE group was significantly lower than those in both other bacteria group and control group(P=0.0026 and 0.0000,respectively).ConclusionPAE infection in BE patients can suppress the expression of TIMP-1 and stimulate the expression of MMP-9,and thus make the disease even worse.
pseudomonas aeruginosa;bronchiectasis;matrix metalloproteinase-9;tissue inhibitor of metalloproteinase-1
Acta Acad Med Sin,2012,34(4):384-389
金 前 电话:0571-89972427,电子邮件:jinqian0504@hotmail.com
R562.2+2
A
1000-503X(2012)04-0384-06
10.3881/j.issn.1000-503X.2012.04.014
浙江省医药卫生科学研究基金 (2008B033)Supported by the Scientific Research Foundation of Zhejiang Medical and Health System(2008B033)
2011-09-27)
·综 述·

