3.6-mT正弦交变电磁场对体外培养大鼠成骨细胞增殖与分化的影响
周 建,王嘉琪,葛宝丰,马小妮,陈克明,韦 哲
中国人民解放军兰州军区兰州总医院 1骨科研究所 2医学工程科, 兰州 730050
3.6-mT正弦交变电磁场对体外培养大鼠成骨细胞增殖与分化的影响
周 建1,王嘉琪1,葛宝丰1,马小妮1,陈克明1,韦 哲2
中国人民解放军兰州军区兰州总医院1骨科研究所2医学工程科, 兰州 730050
目的研究正弦交变电磁场 (SEMFs)对体外培养大鼠成骨细胞增殖与分化的影响。方法体外分离培养大鼠颅骨成骨细胞,传代后随机分为6组,分别用频率50 Hz、强度为3.6 mT SEMFs处理,处理时间分别为每天0.5、1.0、1.5、2.0、2.5 h。结果SEMFs处理后3~5 d,细胞呈现特征样分布。SEMFs处理后9 d,0.5 h组碱性磷酸酶(ALP)活性显著增加,ALP组织化学染色和钙化结节面积结果与ALP活性一致。在SEMFs处理后48 h和96 h,骨保护素和胶原ⅠmRNA表达水平明显高于对照组,尤以0.5 h组最明显。结论50 Hz、3.6 mT SEMFs可抑制成骨细胞增殖,但能促进体外培养成骨细胞分化成熟。
成骨细胞;正弦交变电磁场;胶原Ⅰ;骨保护素
自从骨骼的压电效应被发现以来,电磁场被应用于临床骨折延迟愈合、骨不连接和骨质疏松等骨病的治疗已有30多年时间[1]。虽然电磁的骨病治疗已有如此长的应用时间,但其作用机制和应用的磁场参数选择还存在很大分歧[2]。文献报道磁场效应存在一个非线性效应窗口[3],同时也有实验研究发现,3.6 mT为正弦交变磁场的一个强度效应窗口[4]。本研究评估了50 Hz 3.6 mT不同处理时间的正弦交变电磁场 (sinusoidal electromagnetic fields,SEMFs)对体外培养成骨细胞增殖与分化的影响,以期为电磁场应用于骨痛、骨折延迟愈合,骨质疏松等相关疾病的治疗提供一个细胞水平的实验依据。
材料和方法
材料 出生48 h以内的SPF级SD大鼠 [甘肃省中医学院动物实验中心,合格证号SCXK(甘)2004-0006-152],胎牛血清 (兰州民海生物公司),α-MEM培养基、Ⅱ型胶原酶 (Gibco公司,美国),RNAiso Reagent kit、 TakaRa Prime ScriptTMSYBRⓇPremix Ex TaqTMⅡPCR扩增试剂盒 (大连宝生物公司),地塞米松、磷酸化抗坏血酸、β-磷酸甘油钠、青霉素、链霉素、胰蛋白酶 (Sigma公司,美国),茜素红 (上海生工)。
正弦交变磁场发生仪 实验所用磁场发生仪由本实验组与兰州理工大学共同研制,线圈内径为180 mm,频率、磁感应强度均精确可调。磁感应信号经计算机控制程序产生后,经过信号放大器放大后传入磁场线圈,磁场发生装置各部分组成见图1。经中国人民解放军兰州军区医学计量测试研究站测定表明,磁场发生仪运行期间磁场环境均匀稳定,报告编号:医计磁字ccqd-2008-01。仪器经紫外线照射消毒后放入细胞培养箱内,由导线与外部控制装置相连。实验期间培养箱内温度控制在 (37±0.2)℃。
成骨细胞的分离培养 取出生48 h以内SD大鼠10只,处死后放入75%乙醇溶液浸泡10 min,取颅骨,去除骨膜、血管及结缔组织,PBS漂洗。将颅骨剪成约1 mm×1mm大小的骨片,加入0.25%胰蛋白酶2~3 ml,37℃预消化10 min,弃消化液后重复1次;PBS漂洗骨片,换0.1% Ⅱ型胶原酶消化,37℃水浴消化4次,第1次10 min弃消化液,以后每次20 min,收集并合并消化液,200目细胞筛过滤,滤液1000 r/min离心5 min,沉淀用PBS漂洗后用含有10%胎牛血清的α-MEM培养液悬浮,吹打均匀后,调整细胞浓度至3×104个细胞/ml,37℃ 5%CO2培养箱中培养,每3天换液1次,待细胞生长融合至80%以上时,0.25%胰蛋白酶消化传代。
细胞分组与磁场处理 将第1代传代细胞 (P1)调整浓度至3×104个细胞/ml接种于60 mm培养皿,随机分为6组,依次置于50 Hz,0 mT(对照组)和3.6 mT(处理组,处理时间0.5、1.0、1.5、2.0、2.5 h)。
增殖分析 P1代细胞接种12 h后采用磁场处理,其中0 h不用任何磁场处理,用作对照组。48、72、96 h后换含0.5%MTT的无血清培养基继续培养4 h,弃培养液,加入DMSO摇床震荡10 min,待紫色结晶沉淀彻底溶解后于570 nm波长测定光密度值 (optical density,OD)。

图1 磁场原理示意图Fig 1 Schematic representation of the electromagnetic fields device
成骨细胞成熟分化分析 将P1代细胞接种于35 mm培养皿,每3天换液1次,待细胞70%~80%融合成片时加入成骨性诱导剂 (50 mg/L磷酸化抗坏血酸、10 mmol/L β-甘油磷酸钠和1×10-8mol/L的地塞米松),开始磁场处理。
碱性磷酸酶活性测定:第3、6、9和12天分别测定各组碱性磷酸酶 (alkaline phosphatase,ALP)活性,ALP活性测定按试剂盒说明书操作,每组分别按缓冲液∶基质液=1∶1加入充分摇匀;然后37℃水浴15 min,加入3倍于基质液显色液,充分混匀显色后,测定507 nm处OD值,换算成金氏单位。
茜素红钙化结节染色:磁场处理第10天,弃培养液,PBS漂洗2遍,加入10%甲醛溶液固定10 min,弃固定液,加入 pH 8.9、0.1%的茜素红染色液,37℃水浴1 h,流动水冲洗,换固定液照相记录结果。照相后采用Image-Pro Plus 6.0灰度分析软件,扫描钙化结节染色区域的面积,应用公式:培养皿的面积× (钙化结节染色区域扫描面积/照片中培养皿的扫描面积)。
基因表达水平分析
总RNA提取:P1代细胞在第1次磁场处理后24、72、96 h后弃培养液,加入无酶PBS漂洗2次,加入1 ml RNAiso Reagent Kit裂解细胞,收集裂解液后加入200 μl氯仿4℃ 13 500 r/min离心15 min,取上清液加入等体积的异丙醇冰上静置15 min,4℃13 500 r/min离心15 min弃上清液,75%乙醇重悬浮沉淀4℃ 13 500 r/min离心5 min,弃上清后 -70℃保存,琼脂糖凝胶电泳检测RNA完整性,测定OD260nm、OD280nm、OD320nm、OD230nm值,调整总RNA的浓度。
逆转录:使用TakaRa Prime ScriptTMreagent Kit(TakaRa Code:DRR037A)反转录试剂盒合成反转录出第1条cDNA链。反应体系:5×Prime ScriptTMBuffer 4 μl,Prime ScriptTMRT Enzyme MixⅠ1.0 μl,Oligo dT Primer(50 μmol/L)1.0 μl,Random 6 Primer(100 μmol/L)1.0 μl,Total RNA 10 μl(1000 ng)补 RNase Free水至20 μl。37℃反应15 min,85℃ 5 s,-20℃保存。引物设计:根据实验要求,在GenBank查询所需要基因目的序列mRNA序列,引物均由宝生物 (大连)公司根据序列设计并合成。胶原Ⅰ:NM_053356,Forward 5'-TTCCCGGTGAATTCGGTCTC-3',Reverse 5'-ACCTCGGATTCCAATAGGACCAG-3,产物长度107 bp;骨保护素 (osteoprotegerin,OPG):NM_057149.1,Forward 5'-GCAGCATCGCTCTGTTCCTGTA-3',Reverse 5'-GCATGAGTCAGGTAGTGCTTCTGTG-3',产物长度50 bp;GAPDH:NM_017008.3,Forward 5'-GGCACAGTCAAGGCTGAGAATG-3',Reverse 5'-ATGGTGGTGAAGACGCCAGTA-3',产物长度143 bp。
PCR检测:按照 Applied Biosystems公司7300仪器操作说明进行实验,其中PCR反应体系20 μl,包括 SYBRⓇPremix Ex TaqTMⅡ (2 ×)10 μl,PCR Forward Primer(10 μmol/L)0.8 μl,Reverse Primer(10 μmol/L)0.8 μl,ROX reference Dye or Dye Ⅱ(50 × )0.4 μl,cDNA 模板 (50 ng/μl)2 μl,补RNase Free水至20 μl。PCR反应条件:95℃预变性30 s;94℃变性5 s,退火31 s,40个循环。实时定量PCR(real-time PCR,RT-PCR)数据分析处理采用△△Ct处理数据,采用2-△△Ct表示数据的结果[5]。
统计学处理 采用SPSS 13.0统计软件,结果以均数±标准差表示,首先用方差分析检验各组间差异是否有统计学意义,当差异存在统计学意义时,再用多参数t检验验证各均数间差异是否有统计学意义,P<0.05为差异有统计学意义。
结 果
细胞形态观察 细胞接种培养至12 h左右贴壁,呈三角形、纺锤形或多角形等形态;24 h后数量明显增加,体积增大;3~5 d开始融合为单层,经磁场暴露处理者呈特征性旋窝样分布,对照组无此现象。经过磁场处理后10 d茜素红钙化结节染色鉴定,磁场处理组钙化面积大于未经磁场处理组的面积(图2)。
成骨细胞增殖情况 SEMFs处理48 h和72 h后,0.5、1.0、1.5、2.0h组的成骨细胞增殖均受到明显抑制 (P均<0.05);SEMFs处理96 h后,0.5 h和1.0 h组成骨细胞增殖受到明显抑制 (P均<0.05)(图3)。
ALP的活性和组织化学染色结果 SEMFs处理第9天,0.5 h和2.5 h组的ALP活性明显高于对照组 (P均<0.05);SEMFs处理第12天,0.5 h组的ALP活性明显高于对照组 (P<0.01)及其他SEMFs处理组 (P均 <0.05)(图4)。0.5 h和1.0 h组ALP活性染色面积明显大于对照组 (P<0.01),0.5 h组的ALP活性染色面积也明显大于其他SEMFs处理组 (P均 <0.05)(图5)。
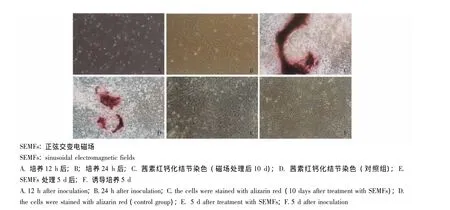
图2 成骨细胞形态 (×100)Fig 2 The osteoblast morphology(×100)
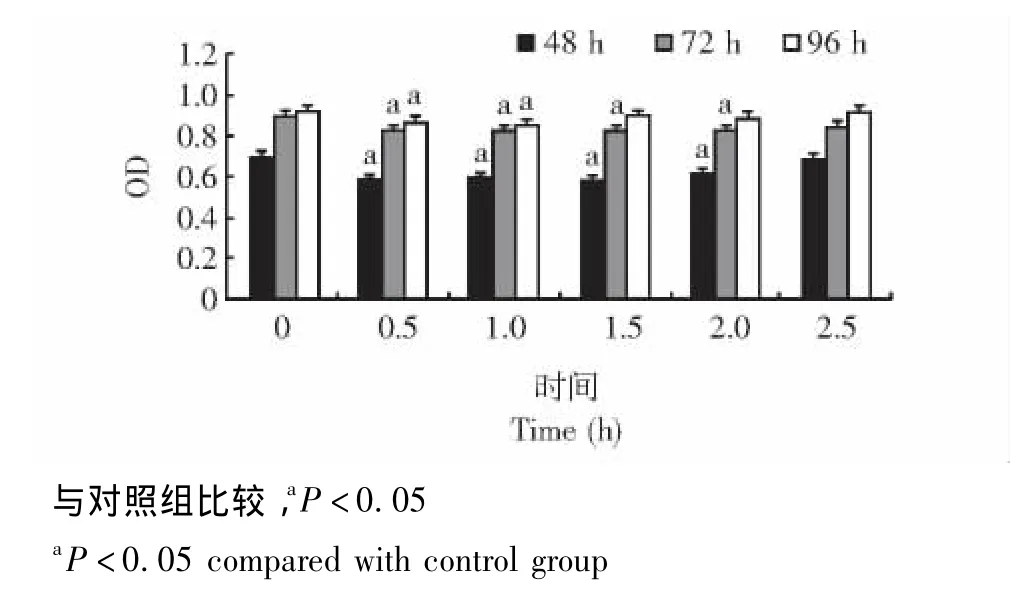
图3 成骨细胞增殖情况Fig 3 Proliferation of osteoblasts
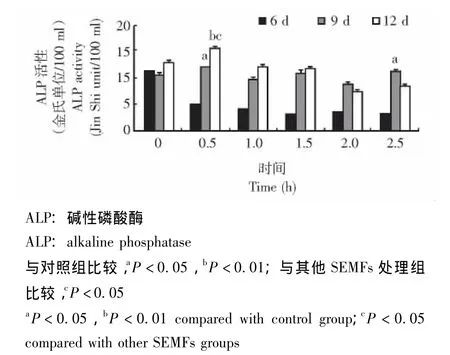
图4 各组ALP活性的比较Fig 4 Comparison of ALP activity among all groups
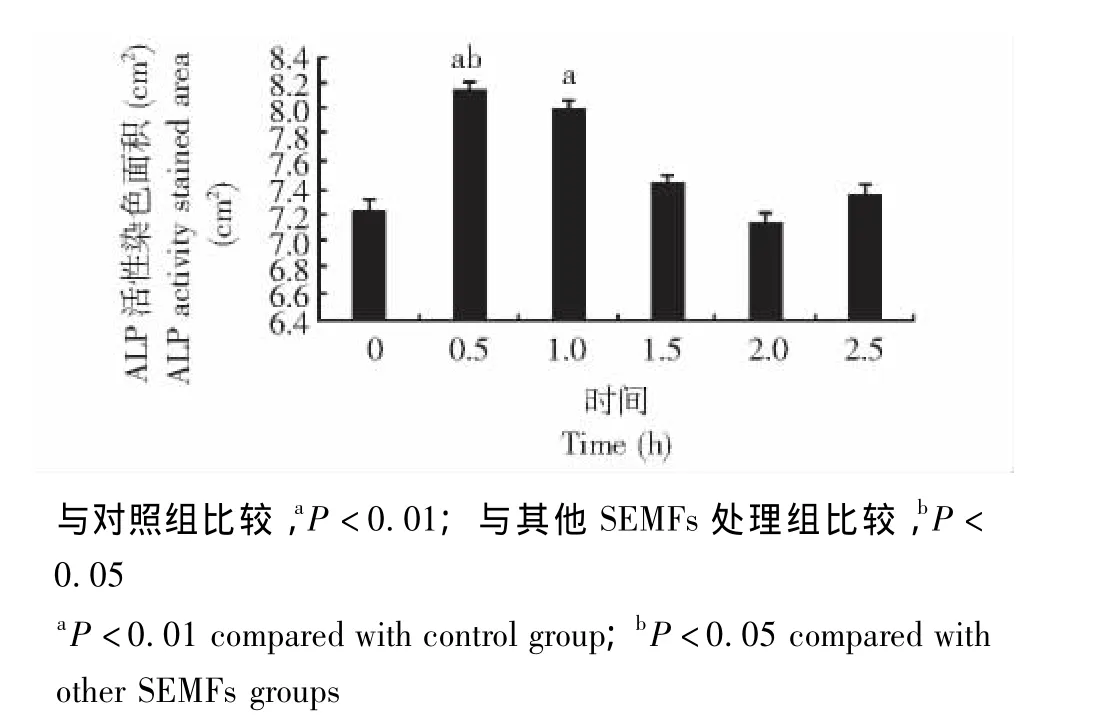
图5 各组ALP活性染色面积的比较Fig 5 Comparison of ALP activity stained areas among all groups
钙化结节染色结果 SEMFs处理10 d后,0.5 h(P<0.01)、1.0 h(P<0.01)和1.5 h组 (P<0.05)的钙化结节数均明显多于对照组 (图6)。
胶原Ⅰ和OPG mRNA表达情况 SEMFs处理大鼠成骨细胞48 h和96 h后,0.5 h(P<0.01)和1.0 h组 (P<0.05)胶原Ⅰ mRNA表达水平均明显高于对照组,处理96 h后0.5 h组的胶原Ⅰ mRNA表达水平明显高于其他SEMFs处理组 (P均<0.05)(图7)。SEMFs处理成骨细胞96 h后,与对照组相比,0.5 h(P<0.01)和1.0 h组 (P<0.05)的OPG mRNA表达水平明显高于对照组;SEMFs处理成骨细胞48 h后,0.5 h组的OPG mRNA表达水平也明显高于对照组 (P<0.05)(图8)。
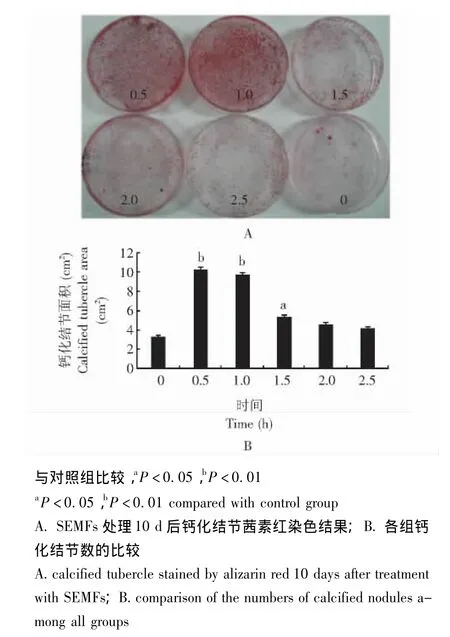
图6 钙化结节茜素红染色Fig 6 Calcified tubercles after having been stained with alizarin red
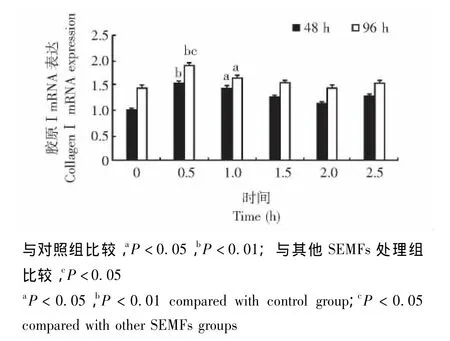
图7 各组成骨细胞胶原ⅠmRNA表达的比较Fig 7 Comparison of the collagenⅠmRNA expression of osteoblasts among all groups
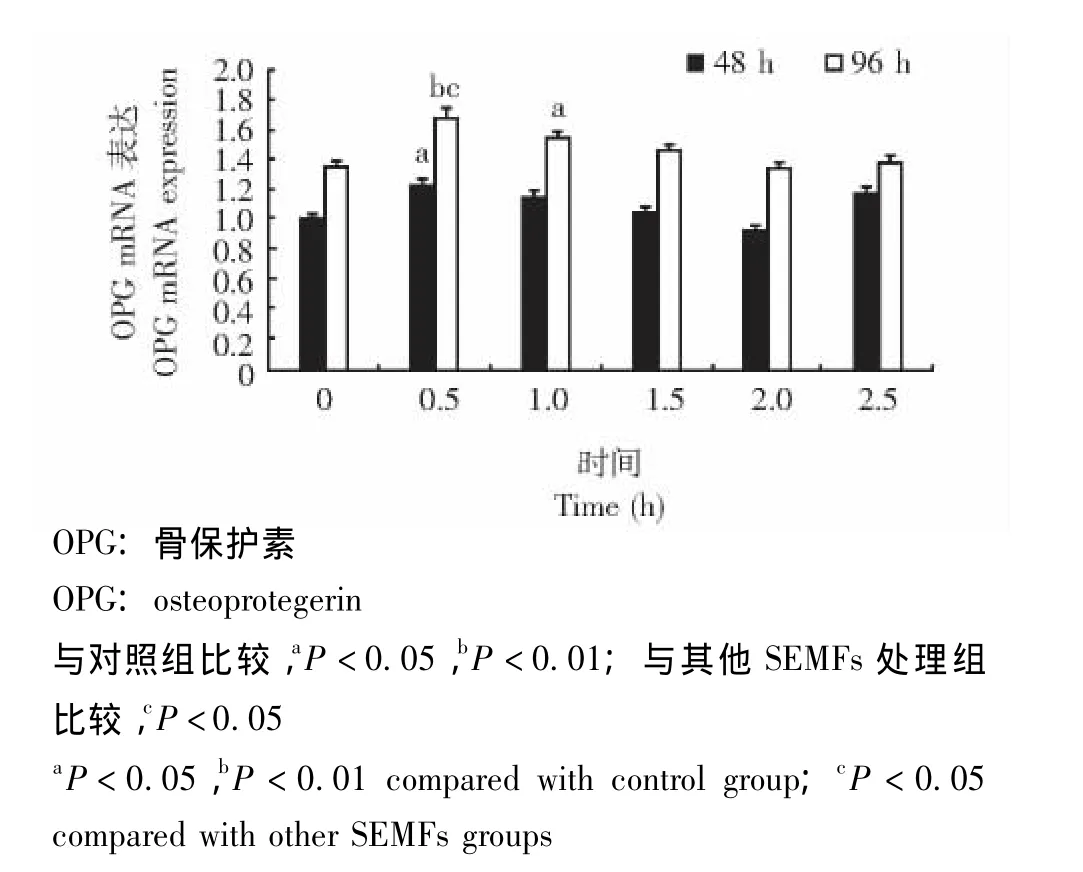
图8 各组成骨细胞OPG mRNA表达的比较Fig 8 Comparison of the OPG mRNA expression of osteoblasts among all groups
讨 论
基于多年临床数据的分析,美国食品药品监督管理局证明电磁场治疗是一种安全有效的治疗骨不连接及骨质疏松的方法[6-7],电磁场可改变骨代谢活性,增加骨密度、改善骨的生化特性以及骨吸收等[8];还可增加体外培养成骨细胞的活性,抑制破骨细胞的形成、活性和存活[9]。有研究显示,50 Hz 3.6 mT SEMFs可抑制成骨细胞增殖,也有文献报道60 Hz 2 mT SEMFs可促进RPMI 7666(B lymphoblast)增殖,但抑制T/G HA-VSMC[10],因此磁场对细胞增殖的影响与细胞种类和磁场参数相关。
ALP活性是成骨细胞成熟分化活性的主要指标,有文献报道电磁场能提高血清中和体外培养成骨细胞ALP活性[11-12],本研究结果显示,用50 Hz 3.6 mT SEMFs处理后,0.5 h组的ALP活性显著增加。Liu等[13]报道,电磁场能增加骨质疏松患者的骨密度和体外培养成骨细胞的钙盐沉积量,尤以0.5 h组钙盐沉积增加最为明显。从细胞形态学水平找到了50 Hz 3.6 mT SEMFs的一个时间效应窗口即0.5 h。
Nagarajan等[14]研究发现,电磁场能促进体外培养成细胞基因的表达。本研究分析了50 Hz 3.6 mT不同处理时间对成骨细胞胶原I和OPGmRNA的表达的影响,以期从分子水平证明不同处理时间电磁场对体外培养成骨细胞时间的效应窗口。结果发现,SEMFs能促进OPG和胶原Ⅰ mRNA的表达水平,尤其是0.5h组的表达水平明显高于对照组和其他SEMFs处理组,从基因水平证明磁场与成骨细胞之间存在一定的时间效应窗口。
综上,本研究观察了50 Hz 3.6 mT SEMFs不同处理时间对体外培养成骨细胞影响,结果发现电磁场与成骨细胞之间存在1个时间效应窗口,即50 Hz 3.6 mT 0.5 h,因此推测电磁在治疗骨质疏松、骨折延迟愈合和骨不连接等相关骨病也可能存在1个时间效应窗口,为电磁场治疗骨病参数的选择提供了一个细胞水平的实验依据,但本研究结果也有待进一步的动物实验和临床试验证实。
[1]Huang LQ,He HC,Cheng Q,et al.Clinical update of pulsed electromagnetic fields on osteoporosis[J].Chin Med J(Engl),2008,121(20):2095-2099.
[2]贾雪,何成奇.脉冲电磁场治疗绝经后骨质疏松症的研究进展 [J].华西医学,2009,24(1):247-249.
[3]Ivancsits S,Pilger A,Diem E,et al.Cell type-specific genotoxic effects of intermittent extremely low-frequency electromagnetic fields[J].Mutat Res,2005,583(2):184-188.
[4]Zhou J,Ming LG,Chen KM,et al.Effects of 50 Hz sinusoidal electromagnetic fields of different intensities on proliferation,differentiation and mineralization potentials of rat osteoblasts[J].Bone,2011,49(4):753-761
[5]Livak KJ,Schmittgen TD.Analysis of relative gene expression data using real-time quantitative PCR and the 2-△△Ctmethod[J].Methods,2001,25(4):402-408.
[6]Richard HWF,Thomas M,Nurdan O.Electromagnetic effects-from cell biology to medicine [J].Pro His Cyt,2009,43(2):177-264.
[7]Chao EY,Inoue N,Koo TK,et al.Biomechanical considerations of fracture treatment and bone quality maintenance in elderly patients and patients with osteoporosis[J].Clin Orthop Relat Res,2004,425(8):12-25.
[8]Luo E,Jiao L,Shen G,et al.Effects of the PEMFs of different intensity on BMD and biomechanical properties of rabbits’femur[J].J Biomed Eng,2005,22(6):1168-1170.
[9]Chang K,Chang WH,Yu YH,et al.Pulsed electromagnetic field stimulation of bone marrow cells derived from ovariectomized rats affects osteoclast formation and local factor production[J].Bioelectromagnetics,2004,25(2):134-141.
[10]Sul AR,Park SN,Suh H.Effects of sinusoidal electromagnetic field on structure and function of different kinds of cell lines[J].Yonsei Med J,2006,47(6):852-861.
[11]Hartig M,Joos U,Wiesmann HP.Capacitively coupled electric fields accelerate proliferation of osteoblast-like primary cells and increase bone extracellular matrix formationin vitro[J].Eur Biophys J,2000,29(7):499-506.
[12]Jiang YZ,Chen B.Short term effect of pulsed electromagnetic fields on management of osteoporosis[J].Chin J Osteoporos,2005,11(1):365-367.
[13]Liu L,Dong LP,Li XX.Clinical analysis of pulsed electromagnetic fields on osteoporosis[J].Chin J Rehabil Med,2008,121(20):2095-2099.
[14]Nagarajan S,Sukyee K,Anatoliy V,et al.Effects of BMP-2 and pulsed electromagnetic fields(PEMF)on rat primary osteoblastic cell proliferation and gene expression[J].J Orthop Res,2007,26(14):1213-1220.
Effect of 3.6-mT Sinusoidal Electromagnetic Fields on Proliferation and Differentiation of Osteoblasts In Vitro
ZHOU Jian1,WANG Jia-qi1,GE Bao-feng1,MA Xiao-ni1,CHEN Ke-ming1,WEI Zhe2
1Institute of Orthopaedics,2Department of Medical Engineering,Lanzhou General Hospital of Lanzhou Military Area Command of Chinese PLA,Lanzhou 730050,China
CHEN Ke-ming Tel:0931-8994327,E-mail:chkeming@yahoo.com.cn
ObjectiveTo investigated the effect of 50-Hz 3.6-mT sinusoidal electromagnetic fields(SEMFs)on the proliferation and differentiation of osteoblastsin vitro.MethodsThe newborn rat calvarial osteoblasts were isolated by enzyme digestion and randomly divided into 6 groups after one passage.The treatment groups under 50-Hz 3.6-mT SEMFs and controls without SEMFs treatment.The cells were exposed in the SEMFs for 0.5 h,1.0 h,1.5 h,2.0 h,and 2.5 h.They were observed under the contrast phase microscope each day.The calcified nodules were stained by alizarin red.The SEMFs were arranged in spiral appearance after 3 to 5 days.ResultsThe SEMFs showed characteristic distribution 3 to 5 days after SEMFs treatment.On the 9thday after treatment,the activity of alkaline phosphatase(ALP)significantly increased in the 0.5-h group,whereas the ALP histochemical straining results and the area of calcified nodules were consistent with ALP activity.In the 48-h and 96-h groups,the genetic expression levels of osteoprotegerin and collagen-Ⅰwere significantly higher than that in the control group;particularly,the mRNA expression increased in the 0.5-h group.ConclusionThe SEMFs at 50-Hz 3.6-mT could suppress the p roliferation of osteoblastsmaturation but stimulate the differentiation and maturation of osteoblastsin vitro.
osteoblasts;sinusoidal electromagnetic fields;collagen-Ⅰ;osteoprotegerin
Acta Acad Med Sin,2012,34(4):353-358
陈克明 电话:0931-8994327,电子邮件:chkeming@yahoo.com.cn
R318
A
1000-503X(2012)04-0353-06
10.3881/j.issn.1000-503X.2012.04.008
甘肃省科技重大专项资助项目 (09ZNKDA025)Supported by the Grant from Gansu Provincial Science and Technology Department(09ZNKDA025)
2011-07-19)
·论 著·

