抗坏血酸在离子液体修饰玻碳电极上的电化学行为
陈代武
(邵阳医学高等专科学校 药学系,湖南 邵阳422000)
抗坏血酸在离子液体修饰玻碳电极上的电化学行为
陈代武
(邵阳医学高等专科学校 药学系,湖南 邵阳422000)
利用离子液体1-丁基-3-甲基咪唑四氟硼酸盐(BMIMBF4)对玻碳电极(GCE)进行修饰,制备了BMIMBF4/GCE电极.在0.1mol/L的磷酸盐缓冲溶液中,采用循环伏安法研究了抗坏血酸在BMIMBF4/GCE电极和裸玻碳电极(GCE)上的电化学行为.结果表明,pH=5.7的磷酸盐缓冲溶液为最佳测定底液,最佳富集时间为120s;BMIMBF4/GCE对抗坏血酸的氧化反应有很好的电化学催化作用.抗坏血酸的氧化峰电流与其浓度在2.0×10-4~1.0×10-2mol/L的范围内呈良好的线性关系,相对标准偏差为4.53% (n=5).
1-丁基-3-甲基咪唑四氟硼酸盐;离子液体;玻碳电极;抗坏血酸;电化学行为
室温离子液体(RTIL)具有电化学窗口宽、导电率高、热稳定性和化学稳定性好、几乎无蒸气压、不易挥发、对有机物和无机物都有良好的溶解性等优点.这些特点特别适合于电化学与电分析化学的研究领域[1-2],它既可以作为溶剂又可以作为支持电解质,是电化学研究中的一种优良的介质功能材料.目前,应用较多的离子液体阳离子主要有4类[1]:烷基季铵离子[NRxH4-x]+、烷基季磷离子[PRxH4-x]+、1,3-二烷基取代的咪唑离子或称N,N′-二烷基取代的咪唑离子(简记为[R1R3Im]+,若2位上还有取代基,则简记为[R1R2R3Im ]+)和 N-烷基取代的吡啶离子[RPy]+.
近些年,有关离子液体在有机合成[3-5]、绿色化学[1]、分析化学[6],电化学[7],催化[1,5]等领域的报道急剧增加,有关离子液体的性质及其应用的研究受到高度关注.作者采用离子液体1-丁基-3-甲基咪唑四氟硼酸盐(BMIMBF4)修饰玻碳电极,研究其对抗坏血酸的电催化作用.
1 实验部分
1.1 仪器与试剂
电化学工作站(上海辰华仪器公司),三电极系统:工作电极为GCE或BMIMBF4/GCE、参比电极为饱和甘汞电极(SCE)、对电极为铂电极.KQ-500DE型数控超声波清洗器(昆山市超声仪器有限公司).FA/JA系列电子天平(上海民桥电子天平厂).DGG-9053A型电热恒温鼓风干燥箱(上海森估实验仪器有限公司).α-Al2O3抛光粉、无水乙醇、浓硝酸、浓硫酸、铁氰化钾、磷酸氢二钠、磷酸二氢钠、BMIMBF4、抗坏血酸(AA)均为市售分析纯试剂.实验用水均为二次蒸馏水.
1.2 电极的制备
1.2.1 打磨、测试电极的步骤
将直径为3mm的玻碳电极置于麂皮上用不同粒径的α-Al2O3打磨,抛光至镜面,洗去表面污物,依次用1∶1乙醇、1∶1HNO3和二次水在超声波清洗器中进行清洗,洗净后在空气中自然晾干.以供测定和电极进一步修饰之用.
1.2.2 [BMIM]BF4修饰电极的制作
将打磨好的玻碳电极(GCE)自然晾干,然后用10μL微量进样器取5μL[BMIM]BF4的DMF溶液([BMIM]BF4与DMF的体积比为1∶10)滴于玻碳电极表面,放置让DMF挥发掉,既得[BMIM]BF4修饰电极.
1.3 实验方法
三电极系统(工作电极为GCE或([BMIM]BF4)/GCE;参比电极为饱和甘汞电极(SCE);对电极为铂电极),在开路条件下富集240s,扫描的电位范围是-0.6~0.8V,扫速为0.05V/s,依次在磷酸盐缓冲溶液、磷酸盐缓冲溶液+0.4mmol/L AA中扫描GCE和BMIMBF4/GCE,记录其循环伏安曲线.
2 结果与讨论
2.1 AA在修饰电极上的循环伏安特性
图1为0.4mmol/L AA在0.1mol/L的磷酸盐缓冲溶液(简称PBS溶液)(pH=5.7)中于 GCE和BMIMBF4/GCE上产生的电化学响应曲线.在GCE上,AA产生一个氧化峰(图1a),氧化峰电位+0.400 V.在同一溶液中的BMIMBF4/GCE上,同样观察到AA的一个氧化峰(图1b),但峰电位负移到+0.203 V.结果表明,BMIMBF4促进电子传递作用明显,对AA具有较高的电催化氧化活性.扫描曲线中只出现氧化峰,没有出现还原峰,表明AA的氧化是完全不可逆的.
2.2 测定条件的选择
2.2.1 底液pH的影响
为了考察溶液pH 对电极测定的影响,我们在pH 分别为5.7、6.0、6.4、7.0、7.4、8.0的0.1mol/L磷酸盐缓冲溶液中考察BMIMBF4/GCE对AA的循环伏安曲线特性,结果见图2.随着溶液pH的增大,AA氧化峰的峰电流减小.在pH=5.7的0.1mol/L磷酸盐缓冲溶液中,AA循环伏安曲线的峰电流最大.主要是抗坏血酸不稳定,很容易被氧化,在碱性溶液中尤为显著,所以溶液碱性越大,AA被氧化的速度越快.溶液的pH在3.5~5.0之间,抗坏血酸生成脱氢抗坏血酸速度较慢,而且具有可逆性.当溶液呈中性和碱性时,抗坏血酸C3羟基中的氢失去,由烯二醇形成的分子内的氢键已不存在.这时的结构稳定性较低,C3上的氧负离子可能发生电子转移形成碳氧双键,此时相邻的C2上羟基极易被氧化,即抗坏血酸生成脱氢抗坏血酸的速度较快.当溶液中的H+浓度很低时,羰基质子化程度很小,反应也变为不可逆的.导致溶液中AA的浓度相对减少了,因而导致AA的氧化峰电流随溶液碱性增大而减小.因此,本实验选用pH=5.7的0.1mol/L磷酸盐缓冲溶液作为最佳的底液.
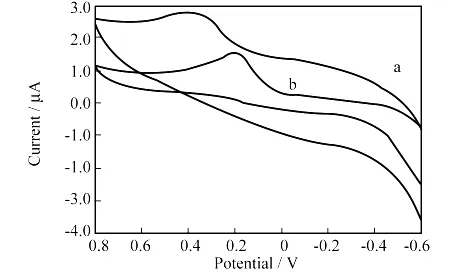
图1 0.4mmol/L AA在0.1mol/L PBS缓冲溶液中在 GCE(a)和BMIMBF4/GCE(b)上的循环伏安图Fig.1 The cyclic voltammogram of 0.4mmol/L AA on GCE(a)and BMIMBF4/GCE(b)in 0.1mol/L PBS
2.2.2 扫描速度的影响
其他条件不变,改变循环伏安法的扫描速度,将扫速分别设为0.01、0.05、0.10、0.15、0.20V/s,记录其循环伏安曲线,结果如图3所示.AA的氧化峰峰电流随着扫速的增加而增大.图3中不同扫速对应的BMIMBF4/GCE对AA的循环伏安图中的氧化峰电流值列于表1.
在扫速为0.01~0.20V/s范围内氧化峰电流与ν1/2呈良好的线性关系,线性回归方程为:IPa(μA)=7.45v1/2(V/s)-0.042 5,r=0.999 2,说明该电极反应过程是由扩散控制的.这是由于BMIMBF4的存在极大地增加了导电效率,使到电极表面的AA能够较快地发生电极反应,即电子传递速率大于物质由本体溶液到达电极表面的扩散速率,所以电极反应过程由吸附控制变为扩散控制.

图2 系列pH缓冲溶液中BMIMBF4/GCE对AA的循环伏安曲线Fig.2 The cyclic voltammogram of AA on BMIMBF4/GCE in 0.1mol/L PBS

图3 不同扫速时BMIMBF4/GCE对AA的循环伏安图Fig.3 The cyclic voltammogram of BMIMBF4/GCE with AA with different scanning speed

表1 各扫速对应的BMIMBF4/GCE对AA的循环伏安图中的氧化峰电流Table 1 The oxidation peak current of BMIMBF4/GCE with AA in the cyclic voltammogram by defenent scanning speed
2.2.3 富集时间的影响
实验发现富集电位(-0.6~0.8V)对AA的氧化还原峰影响较小.在开路下富集,AA的峰电流只略小于施加电位富集的峰电流,故实验中采用开路富集.
在GC电极上,富集时间对AA的峰电流影响较小.而在BMIMBF4/GC上,一定时间范围内,AA的峰电流随富集时间延长而增大.本实验选择富集时间为30、60、120、180、240、300s,结果见图4.结果表明,富集时间小于120s,峰电流随着富集时间的延长而增大;富集时间为120s时峰电流最大,富集时间大于120 s,峰电流趋向于稳定并稍微降低.所以本实验选用120s为最佳富集时间.
2.2.4 线性范围
在pH=5.7的磷酸盐缓冲溶液中,观察不同AA浓度的循环伏安曲线.浓度分别为0.2、0.4、1.0、3.0、6.0、10.0mmol/L AA的循环伏安曲线见图5.出峰电位均在0.265V附近,说明玻碳电极在充分抛光及活化后,能够实现较高的使用性能.同时也可以看出生成的氧化峰电流与AA的浓度密切相关.AA的浓度越大,氧化峰电流就越大.

图4 不同富集时间所对应的循环伏安曲线图Fig.4 The cyclic voltammogram of different enrichment time
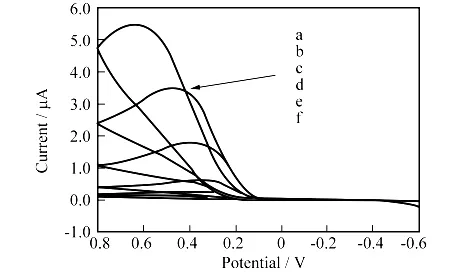
图5 不同AA浓度的循环伏安曲线图Fig.5 The cyclic voltammogram of AA
AA在0.2~10mmol/L浓度范围内与峰电流有良好的线性关系,线性回归方程为:IP(μA)=0.127 1+0.544c(mmol/L),r=0.998 5.
2.2.5 重现性实验
在最佳条件下,即在0.1mol/L磷酸盐缓冲溶液(pH =5.7)底液+0.4mmol/L AA中,开路条件下富集120s,扫描的电位范围-0.6~0.8V,扫速0.05V/s,连续测定5次,记录其循环伏安曲线,发现AA的循环伏安曲线的氧化电流峰均出现在2.8μA附近,具体数据如表2所示.所得数据计算得出5次测定的相对标准偏差(RSD)=4.53%,说明该电极的重现性良好.

表2 重现性实验结果Table 2 The reproducibility experimental results
结论:通过对离子液体修饰的玻碳电极与裸玻碳电极的研究,结果表明:BMIMBF4/GCE对AA具有较高的电催化氧化活性,BMIMBF4起到加速电子传递的作用.通过优化实验,得到了BMIMBF4/GCE测定AA的最佳实验条件为:底液pH为5.7的磷酸盐缓冲溶液,富集时间120s.AA浓度在0.2~10mmol/L范围内有良好的线性关系,实验结果的重现性好(RSD=4.53%,n=5).
[1]THOMAS W.Room-temperature ionic liquids:solvents for synthesis and catalysis[J].Chem Rev,1999,99:2071-2083.
[2]KOEN B.Ionic liquid crystals[J].Chem Rev,2005,105:4148-4204.
[3]MARTINS M A P,FRIZZO C P,MOREIRA D N,et al.Ionic liquids in heterocyclic synthesis[J].Chem Rev,2008,108:2015-2050.
[4]应安国,叶伟东,刘 泺,等.离子液体在有机合成中的应用研究进展[J].有机化学,2008,28(12):2081-2094.
[5]JAIRTON D,ROBERTO F D,PAULO A Z S.Ionic liquid(molten salt)phase organometallic catalysis[J].Chem Rev,2002,102:3667-3692.
[6]EVA AGUILERA H,RAFAEL L,SOLEDAD C,et al.Direct coupling of ionic liquid based single-drop microextraction and GC/MS[J].Anal Chem,2008,80(3):793-800.
[7]PHILIPPE H,CORINNE L.Electrochemical reactivity in room-temperature ionic liquids[J].Chem Rev,2008,108:2238-2264.
[8]汪小兰.有机化学(第3版)[M].北京:高等教育出版社,1997:170-171.
Electrochemical behavior of ascorbic acid on glassy carbon electrode modified with ionic liquid
CHEN Dai-wu
(DepartmentofPharmacology,ShaoyangMedicalCollege,Shaoyang422000,Hunan,China)
A polished glassy carbon electrode (GCE )was modified with 1-butyl-3-methyl imidazole tetrafluoroborate(BMIMBF4)ionic liquid to generate BMIMBF4/GCE electrode.The electrochemical behavior of ascorbic acid on the modified BMIMBF4/GCE electrode and bare GCE was investigated in a phosphate buffer solution by cyclic voltammetry.Results indicate that phosphate buffer solution of pH =5.7is the optimal substrate solution,and the optimal enrichment time is 120s.BMIMBF4/GCE possesses excellent electrochemical catalytic activity for the oxidation reaction of ascorbic acid.The oxidation peak current of ascorbic acid is linearly proportional to its concentration in the range of 2.0×10-4-1.0×10-2mol/L (r=0.998 5),with relative standard deviation of 4.53% (n=5).
1-butyl-3-methyl imidazole tetrafluoroborate;ionic liquid;glassy carbon electrode;ascorbic acid;electrochemical behavior
O 651
A
1008-1011(2012)01-0071-04
2011-08-21.
湖南省教育厅自然科学基金资助项目(09C049),湖南省科技厅科技计划项目(2009FJ3062).
陈代武(1968-),男,教授,研究方向为分析化学,E-mail:swcdwu@163.com.

