8′-取代吲哚螺噁嗪光致变色化合物的合成及光谱性质
陈 川,田晓慧,孙金煜,元以中
(华东理工大学 材料科学与工程学院,上海200237)
8′-取代吲哚螺噁嗪光致变色化合物的合成及光谱性质
陈 川,田晓慧*,孙金煜,元以中
(华东理工大学 材料科学与工程学院,上海200237)
通过在螺噁嗪结构中的萘环8′-位上引入不同的取代基,合成了三种螺噁嗪光致变色化合物;对三种产物的光谱性质进行了对比研究,并考察了其光照褪色速率和抗疲劳性能.结果表明:改变8′-位取代基,合成化合物的闭环吸收峰的位置几乎不受影响,但开环吸收峰发生显著变化,随着取代基极性增加明显红移.增加溶剂的极性,可使同一化合物的开环吸收峰红移.
螺噁嗪;光致变色化合物;合成;光谱性质
螺噁嗪是一类光化学性质较偶氮类、螺吡喃类更为优异的光致变色化合物[1-3],该类化合物在紫外光激发下,分子中螺C-O键发生异裂开环,相应的电子组态发生异构和重排,从而形成一个正负电荷分离的共振体系,这种开环结构对取代基以及所处的溶剂环境非常敏感,对应的吸收光谱,以及开、闭环反应所需时间都会发生变化.近年来,人们通过优化螺噁嗪骨架结构[4-6]、键入修饰基团[7-8]或改变螺噁嗪分子所处的环境[9-11]等方法获得了一系列新的光学或热学性能更优良的螺噁嗪化合物.最近作者合成了水溶性的螺噁嗪三苯基膦盐化合物[12],该化合物的开环体构成正、负电荷分离的共振体系,该结构因存在一定的电子离域性,而易受溶剂极性的影响.在含水乙醇溶液中表现出敏感于pH值的光照显色效应.作者在此基础上引入不同极性基团,制备了二种新的螺噁嗪类化合物,并与螺噁嗪三苯基膦盐化合物进行了对比研究.这三种化合物结构中在萘环8′-位上具有相同的亚甲基反应活性点,此活性点可继续与其他有机官能团进行反应,获得性能更优良、用途更广泛的螺噁嗪类化合物.通过研究所得化合物的光谱性质,发现8′-位上取代基的变化明显影响其光致变色性能、褪色速率及抗疲劳性.
1 实验部分
1.1 仪器与试剂
Avance-500型核磁共振仪(CDCl3为溶剂,TMS为内标);UV-2102紫外分光光度计;X-4显微熔点仪(温度计未校正);英国Micromass公司GCT气相色谱质谱联用仪;UV-LED电光源.
除特殊说明外,所用试剂、药品均为国产分析纯或化学纯,使用前采用常规方法进行无水处理.1,3,3-三甲基-2-亚甲基吲哚啉购自百灵威公司,使用前经减压蒸馏处理;四溴化碳、亚磷酸三乙酯购自阿拉丁试剂公司.
1.2 8′-羟甲基螺噁嗪(化合物Ⅰ)的合成
6-羟甲基-2-萘酚(2)按照文献[13]方法合成.8′-羟甲基螺噁嗪(Ⅰ)按照文献[4]方法合成,mp:175~177℃ (文献值:178℃).目标化合物的合成路线见图1.

图1 目标化合物的合成路线Fig.1 Synthetic routes of the compounds
1.3 中间体8′-溴甲基螺噁嗪(4)的合成
1.8g(5mmol)羟甲基螺噁嗪和3.3g(9.96mmol)四溴化碳溶于50mL CH2Cl2中,通N2保护,搅拌,冰盐浴中使其温度降至0℃以下,逐滴缓慢加入30mL溶有2.1g(8mmol)三苯基磷的CH2Cl2溶液,滴加完毕后,加热回流2h,加入100mL乙醚,过滤,浓缩溶剂,柱层析(洗脱剂:V石油醚/V乙酸乙酯=10∶1)分离,得到白色固体8′-溴甲基螺噁嗪(4)1.3g,产率60%.1H NMR(500MHz,CDCl3)δ:1.36(s,6H,CH3);2.78(s,3H,N-CH3);4.78(s,2H,CH2);6.60(d,J=7.66Hz,1H,H-7);6.93(t,J=6.93Hz,1H,H-5);7.05(d,J= 8.87Hz,1H,H-5′);7.11(d,J= 7.32Hz,1H,H-4);7.25(m,1H,H-6);7.28(s,1H,H-2′);7.62(d,J= 8.72Hz,1H,H-9′);7.67(d,J=8.94Hz,1H,H-6′);7.71(s,1H,H-7′);8.58(d,J=8.70Hz,1H,H-10′).MS,m/z:422.1(M++1)
1.4 目标化合物Ⅱ的合成
将1.3g(3mmol)8′-溴甲基螺噁嗪(4)加入到10mL的亚磷酸三乙酯中,通N2保护,160℃回流7h,减压蒸馏蒸去多余的亚磷酸三乙酯,柱层析(洗脱剂:乙酸乙酯)分离,得白色固体8′-磷酸二乙酯甲基螺噁嗪(Ⅱ)1.3g,产率为90%.mp:129~131℃;1H NMR(500MHz,CDCl3)δ:1.26(t,6H,CH3(OEt));1.35(s,6H,CH3);2.75(s,3H,N-CH3);3.30(s,2H,CH2);4.03(m,4H,CH2(OEt));6.57(d,J= 7.75Hz,1H,H-7);6.90(t,1H,J= 7.40Hz,H-5);7.00(d,J= 8.87Hz,1H,H-5′);7.08(d,J= 7.27Hz,1H,H-4);7.22(t,J= 7.66Hz,1H,H-6);7.26(s,1H,H-2′);7.52(d,J= 8.68Hz,1H,H-9′);7.61(d,J=8.90Hz,1H,H-6′);7.74(s,1H,H-7′);8.50(d,J= 8.64Hz,1H,H-10′).MS,m/z:478.2(M+),479.2(M++1),480.2(M++2).
1.5 目标化合物Ⅲ的合成
按照文献[12]的方法合成.mp:249~251℃.1H NMR(500MHz,CDCl3)δ:1.32(s,6H,CH3);2.72(s,3H,N-CH3);5.61(d,2H,J= 14.1Hz,CH2);6.55(d,1H,J= 7.6Hz,H-7);6.88(t,1H,J= 7.2 Hz,H-5);6.96(d,1H,J=8.8Hz,H-5′);7.07(d,1H,J=7.2Hz,H-4);7.20(t,1H,J=7.6Hz,H-6);7.44(d,1H,J= 8.5Hz,H-9′);7.64(m,7H,H-6′);7.71(s,1H,H-7′);7.78(m,10H,H-2′);8.53(d,1H,J=8.7Hz,H-10′).MS,m/z:683(M+).
2 结果与讨论
2.1 化合物在不同溶剂中的光致变色性质
由于目标化合物Ⅰ、Ⅱ、Ⅲ在传统的螺萘噁嗪萘环的8′-位上引入了三种不同的基团,其中在化合物Ⅱ和化合物Ⅲ中更引入了C-P键,P元素的电负性小于氧元素,因此,使这三种物质具有完全不同的极性,通过薄层层析和理论分析得出化合物Ⅰ、化合物Ⅱ、化合物Ⅲ的极性是依次增大的,并且三种取代基团占据的空间也是依次增大的,决定了它们具有不同的光致变色性质.
将三种物质分别溶于氯仿中制成浓度为1×10-4mol/L的溶液,并用365nm的紫外灯照射1min左右,可以发现三种溶液都由无色变成了蓝色,并将光照前与光照后的溶液用紫外-可见分光光度计进行紫外吸收测试,得到吸收谱图如图2所示.光照后吸收谱图与光照前吸收谱图相比较,闭环体的吸收峰的峰位没有发生变化,但吸光度值在吸收峰λ=254nm处减小了,这说明闭环体结构的浓度减小了,并且在500~600nm处出现了新的开环特征吸收峰,此吸收峰的峰位随着化合物8′-位上取代基极性的增加发生了红移,如图3所示.这表明螺噁嗪类化合物本身闭环体对8′-位取代基并不敏感,而在经紫外光照后,发生开环,所形成的开环体对其非常敏感.

图2 化合物的紫外-可见吸收谱图Fig.2 UV-Vis absorption spectra of the compounds
为了研究螺噁嗪类化合物溶液的光致变色性质,我们选择了三种不同极性的溶剂,对化合物溶液的紫外吸收以及褪色速率进行了测试.
分别配制了化合物Ⅰ、Ⅱ、Ⅲ的氯仿溶液、丙酮溶液、乙醇溶液.并对这九种溶液分别用365nm的紫外灯照射,照射时间为1min,溶液颜色发生了变化,测得了它们在光照后开环体的紫外特征吸收峰的波长,数值如表1所示.
从表1可以得出,对于同种溶剂下的三种化合物,经紫外光照后,开环吸收峰的峰位发生了显著的变化,且均随着8′-位取代基极性的增加,开环吸收峰发生了红移;对于同种化合物,在三种不同溶剂中,经紫外光照后的开环特征吸收峰的峰位随着溶剂极性的增加也发生了红移.这表明螺噁嗪类化合物在溶液中的开环体对溶剂的极性也非常敏感.

图3 紫外光照后化合物的紫外-可见吸收谱图Fig.3 UV-Vis absorption spectra of the compounds after UV irradiation
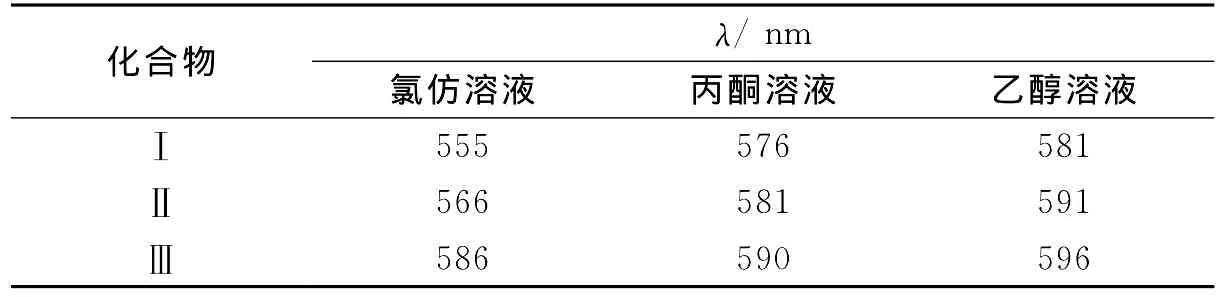
表1 化合物在不同溶剂中光照后的紫外吸收数据Table 1 The absorption data of the compounds in different solvents
通过以上分析可以看出,此类螺噁嗪光致变色化合物在开环过程中,发生了电子组态的异构和重排,从而形成一个正负电荷分离的共振体系,由于电子在分子内具有一定的离域程度,当共振体系所处的溶剂的极性不同时,开环体分子为了使其内部能量最小,达到最稳定的状态,会以不同的形态存在,此时,电子在开环体分子内的离域程度将会不同程度地受到溶剂极性的影响,从而使开环体的吸收谱图发生变化,主要表现为溶剂的极性增加,电子的离域程度增强,开环体吸收峰红移等;此外,这种正负电荷分离的共振体系还敏感于萘环8′-位上的取代基,取代基极性的不同也会影响开环体在溶剂中所呈现的形态,电子在共振体系中的离域程度就会随之发生改变,研究结果表明,随着8′-位取代基的极性增强,电子的离域程度增大,开环体的吸收峰发生了红移.
2.2 化合物在不同溶剂中的褪色动力学性质
经紫外光照后,螺噁嗪化合物发生开环,但在可见光或热的作用下,开环体结构会发生闭环,恢复为原来物质的结构,此时蓝色会褪去,而螺噁嗪类光致变色化合物开环体的褪色过程符合一级反应动力学.
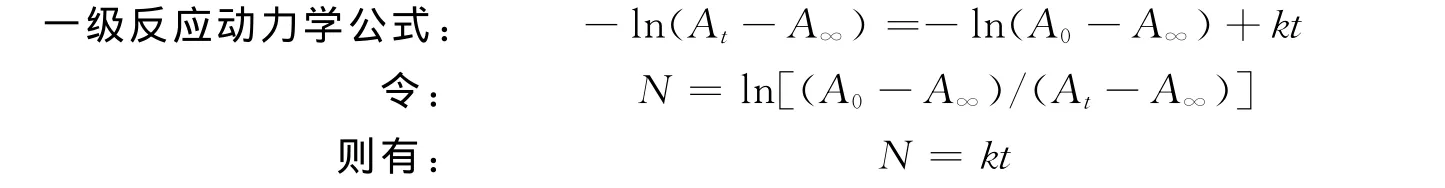
进行拟合计算,进而得到化合物在溶剂中的褪色速率常数,其中At、A0、A∞分别表示在t时刻、初始时刻以及颜色完全褪去后开环体特征吸收峰的吸光度值,A∞的值为0.将九种化合物溶液进行紫外光照,开环变色后,测其在开环体特征吸收波长下吸光度随时间的变化(吸光度值随时间会逐渐减小),然后通过动力学公式进行拟合计算,得出化合物在溶剂中的褪色速率常数k.图4给出了拟合后三种化合物在氯仿溶剂中的褪色动力学图,表2给出了这九种溶液的动力学数据.
综合图4及表2数据可以得出,对与同一种光致变色化合物在三种不同极性的溶剂中,表现出随着溶剂极性的增加,褪色速率常数依次增大,而半衰期数值依次减小;对于同种溶剂中三种不同光致变色化合物,随着萘环8′-位取代基极性的增加,其褪色速率常数依次减小,而半衰期数值依次增大.

图4 化合物在氯仿中的褪色动力学Fig.4 Decay rate of the compounds
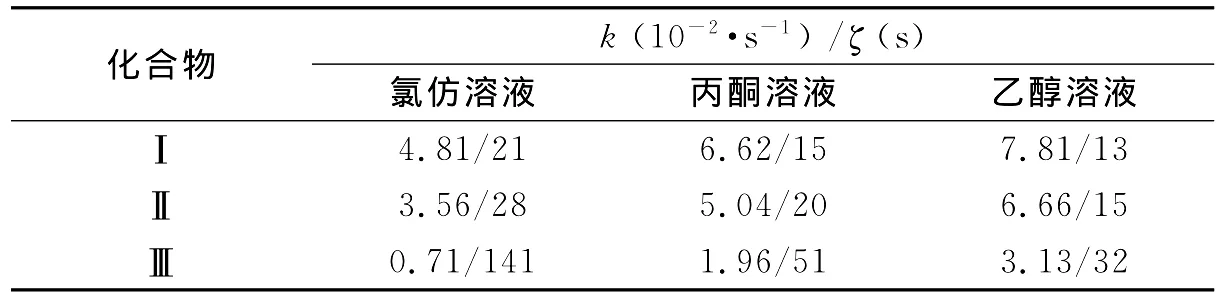
表2 化合物在不同溶剂中的物理特性Table 2 The physical properties of the compounds in different solvents
2.3 抗疲劳性
用UV-LED电光源,调到100%的光强,光照距离小于2cm,功率达到1 500mW/cm2,对三种化合物的氯仿溶液连续10次呈色褪色反复光照,每次光照时间为10s,然后对其进行紫外-可见吸收测试,闭环体特征吸收峰的吸光度值减小了,其中化合物Ⅰ减小到82.53%,化合物Ⅱ减小到87.90%,化合物Ⅲ减小到81.95%.显示三种化合物都具有较好的抗疲劳性,其中化合物Ⅱ的抗疲劳性尤为显著.
3 结论
不同极性的溶剂对所得的螺噁嗪类光致变色化合物的闭环吸收峰几乎没有影响,但对开环吸收峰影响显著,说明开环体是以正、负电荷分离的方式存在.萘环8′-位上的取代基的极性明显影响开环吸收峰,以及螺噁嗪类化合物的稳定性和抗疲劳性,说明此类光致变色化合物的开环体存在敏感于8′-位取代基的电荷转移结构,由此表明在8′-位上引入更多不同基团,可以改变螺噁嗪光致变色化合物的开环状态,调整对应的性质,以达到我们所期许的性能.
[1]樊美公.光化学基本原理与光子学材料科学[M].北京:科学出版社,2001:226-229.
[2]WEISS V,KRONGAUZ V A.Photokinetics in photochromic polymers studied by holographic recording[J].Phys Chem,1994,98:7562-7565.
[3]TAMAI N,MIYASAKA H.Ultrafast dynamics of photochromic systems[J].Chem Rev,2000,100:1875-1890.
[4]SAMMAT A,LOKSHIN V,CHAMONTIN K,et al.Synthesis and unexpected photochemical behaviour of biphotochromic systems involving spirooxazines and naphthopyrans linked by an ethylenic bridge[J].Tetrahedron,2001,57:7349-7359.
[5]ORTIEA F,LEVI D,BRUN P.Photokinetic behaviour of biphotochromic supramolecular systems:part 1.a bis-spirooxazine with a(z)ethenic bridge between each moiety[J].J Photochem Photobiol A:Chem,2001,138:123-141.
[6]SUCH G K,EVANS R A,DAVIS T P.The use of block copolymers to systematically modify photochromic behavior[J].Macromolecules,2006,39:9562-9570.
[7]ZHANG Shu Xiao,FAN Mei Gong,LIU Yuan Yuan,et al.Inclusion complex of spironaphthoxazine withγ-cyclodextrin and its photochromism study[J].Langmuir,2007,23:9443-9446.
[8]YAN V W,KO Chi Chiu,WU Li Xin,et al.Syntheses,crystal structure,and photochromic properties of rhenium(I)complexes containing the spironaphthoxazine moiety[J].Organometallics,2000,19:1820-1822.
[9]WHELAN J,WOJTYK J T C,BUNCEL E.Enhanced bistability of a photochromic microparticle in condensed medium[J].Chem Mater,2008,20:3797-3799.
[10]ROMANI A,CHILDICHIMO G,FORMOSO P,et al.Photochromic behavior of a spiro-indolino-oxazine in reversemode polymer-dispersed liquid crystal films[J].J Phys Chem B,2002,106:9490-9495.
[11]LWVY D.Photochromic S\sol-gel materials[J].Chem Mater,1997,9:2666-2670.
[12]曹慧君,田晓慧,陈 川,等.螺噁嗪三苯基膦盐的合成及酸敏光致变色性质[J].化学通报,2010,6:560-563.
[13]MILLER L E,HANNEMAN W W,JOHN W L,et al.The reactivity of the methyl group in 2-methyl-3-nitronaphthalene[J].J Am Chem Soc,1954,76(1):296-197.
Synthesis and spectrometric properties of 8′-substituted spironaphthooxazine photochromic compounds
CHEN Chuan,TIAN Xiao-hui*,SUN Jin-yu,YUAN Yi-zhong
(CollegeofMaterialsScienceandEngineering,EastChinaUniversityofScienceandTechnology,Shanghai200237,China)
Different substituent groups were introduced onto the 8′-position of the naphthalene ring in spirooxazine to synthesize three kinds of spironaphthooxazine photochromic compounds.The spectrometric properties of three products were comparatively examined,and their rate of decoloration and fatigue resistance were also investigated.Results show that the influence of the polar 8′-substituent group on the ring closing absorption peak can be ignored,but it is substantial to the position of the ring opening absorption peak.Besides,obvious red shift of the ring opening absorption peak can be observed with the increase of the polarity of the substituent group,and increasing polarity of the solvents also leads to red shift of the ring opening absorption peak.
spirooxazine;photochromic compound;synthesis;spectrometric properties
O 621.3
A
1008-1011(2012)01-0004-05
2011-08-17.
上海市基础研究重点项目 (09JC1404300),国家863子项目 (2009AA035002).
陈 川(1987-),男,硕士生,主要从事光电材料的研究.*
.

