进展期胃癌新辅助化疗疗效的Meta 分析
肖 凤,刘 彬,高红英,伍吉云,朱清仙△
(1.南昌大学医学院病理学系,江西南昌 330006;2.井冈山大学医学院基础医学部,江西吉安 343000)
胃癌是世界第4位高发恶性肿瘤,其病死率在癌症死因中居第2位。在我国,胃癌的发病率或病死率均居恶性肿瘤之首[1]。早期胃癌手术切除后5年生存率往往超过90%。但胃癌早期缺乏特异性的症状,大多数患者就诊时已进入进展期,此期患者即使接受了根治手术治疗,其5年生存率也只有20%~30%。针对进展期胃癌术后的化疗效果并不理想。Wilke 等[2]在1989 年首先报道了新辅助化疗在胃癌治疗中的应用。近年来,新辅助化疗作为胃癌综合治疗的一种方法已得到越来越多的关注。但针对进展期胃癌新辅助化疗的价值仍有争论。为进一步明确新辅助化疗对进展期胃癌的治疗作用,本研究拟对中、英文相关随机对照试验(randomized controlled trials,RCT)研究的结果进行Meta分析,就其疗效和手术风险进行比较,以期为临床决策分析提供依据。
1 资料与方法
1.1资料来源及检索策略 本资料检索时间为1980年1月至2011年8月。检索语种限于中文和英语。文献类型为RCT和半随机对照试验(quasi-randomized controlled trials,q-RCT),无论是否隐藏或采用盲法。检索词英文为:neoadjuvant chemotherapy,preoperative chemotherapy,gastric cancer,neoplasm,stomach neoplasm,survival rate 等;中文:新辅助化疗、术前化疗、胃癌、胃肿瘤、手术治疗及生存率等。计算机检索Cochrane Library、PubMed、Embase、中国生物医学文献数据库(Chinese Biomedical Literature Database,CBM)、中文科技期刊全文数据库(Chinese Scientific Journal Full-text Database,CSJD)、中国期刊全文数据库(Chinese Journal Full-text Database,CJFD)等数据库;手工检索国内、外肿瘤会议摘要及交流文献,以及中国肿瘤防治数据库有关资料。
1.2纳入/排除标准 入选文献必须是:(1)进展期胃癌的患者,其种族、国籍、年龄、性别不限,术后有随访;(2)每个试验的两组之间在性别、年龄、肿瘤病理类型、肿瘤分期方面比较,差异无统计学意义(P>0.05);(3)试验包含平行的对照组,即仅行胃癌根治性/姑息性切除手术(原发包块切除),术前不接受任何途径的化疗或仅接受安慰剂治疗;(4)治疗组为胃癌根治性/姑息性切除术前接受不同药物、不同剂量的静脉化疗者。排除标准为:(1)胃癌合并其他疾病者;(2)任何时间接受了放疗、免疫治疗、生物治疗者;(3)失访率超过20%的研究;(4)重复报道的数据;(5)最终无法得到生存率及非随机对照试验的文献一律排除。符合标准的灰色文献、仅有摘要的文献同样纳入,通过与作者联系补充数据。

表1 胃癌新辅助化疗的临床随机对照试验方法质量学评价
1.3纳入试验的筛选 两位研究者独立阅读所获文献题目和摘要,在排除明显不符合纳入标准的试验后,对可能符合纳入标准的试验阅读全文,以确定是否真正符合纳入标准。两位研究者交叉核对纳入试验的结果,对有分歧而难以确定其是否纳入的试验,通过讨论或由第三研究者决定其是否纳入。
1.4文献质量评价方法 对最后纳入文献的质量评价参照Cochrane系统评价员手册5.0.2 推荐的偏倚风险的评价工具进行评价[3]。
1.5统计学处理 采用Cochrane协作网提供的RevMan 5.0.2统计软件。计数资料采用相对危险度(RR) 作为疗效分析统计量;计量资料采用加权均数差或标准化均数差,两者的效应量均以95%可信区间(CI) 表示。采用χ2检验判断各研究间的异质性。各研究间无统计学异质性时,采用固定效应模型进行合并分析,若存在统计学异质性且在允许范围之内,则采用随机效应模型进行合并分析,并解析其异质性来源。
2 结 果
2.1文献检索结果和纳入研究的基本特征 初检有关文献380篇。仔细阅读文章题目、摘要后排除综述79篇,放疗加化疗88篇,免疫治疗50篇,放疗67篇,其他非RCT、非临床研究文献56篇。剩余40篇查找原文,排除未达到纳入标准的文献22 篇,最终18篇文献纳入本文Meta分析。18个研究均为RCT,其中6个研究来自西方国家(意大利、德国、法国、英国、荷兰、希腊各1个),12个研究来自亚洲国家(中国5个、日本6个和韩国1个),共有2 685例患者入选,其中实验组(行新辅助化疗)1 267例,对照组1 418例,文献发表时间1982~2010年。实验组和对照组在性别、年龄、肿瘤病理类型、肿瘤分期方面比较,差异均无统计学意义(P>0.05)。
2.2纳入研究的质量评价 文献质量按Jadad等[4]质量评价方法进行评价,评价内容包括随机方法、分配隐藏、盲法、随访等情况。将得分大于或等于4的研究为高质量,<4的研究为低质量。文献质量评价采用两人独立完成,有异议者通过讨论或由第三研究者决定其是否纳入。文献质量评价见表1。
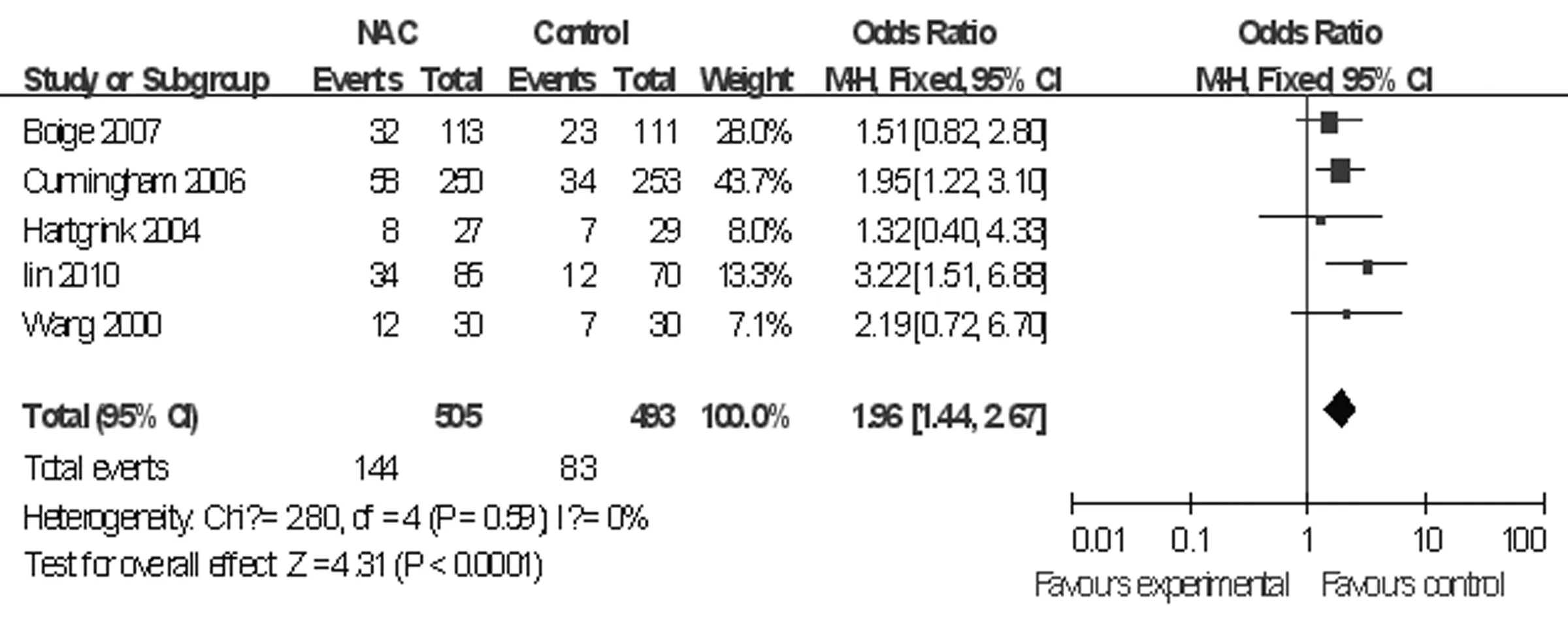
图1 新辅助化疗组与单纯手术组5年生存率的比较
2.3统计分析结果 进展期胃癌患者行新辅助化疗与无新辅助化疗(术前无化疗)治疗5年生存率、总体生存率、围术期病死率和手术切除率比较见图1~4。总体生存率是指随访2年以上的病例中位生存率。总体生存率Meta分析共有15个研究,2 151例患者纳入,各研究间无异质性(P=0.10,I2=33%),选用固定效应模型,OR=1.40,95%CI:1.17~1.68,P=0.000 3;5年生存率Meta分析纳入5个研究,共有998例患者,各研究间无异质性(P=0.59,I2=0%),选用固定效应模型,OR=1.96,95%CI:1.44~2.67,P<0.01;手术切除率Meta分析纳入11个研究,共有1 739例患者,各研究间无异质性(P=0.11,I2=37%),选用固定效应模型,OR=1.60,95%CI:1.29~1.97,P<0.01;围术期病死率Meta分析纳入5个研究, 895例患者纳入,各研究间无异质性(P=0.68,I2=0%),选用固定效应模型,OR=1.06,95%CI:0.60~1.82,P=0.86。新辅助化疗组与无新辅助化疗(术前无化疗)组总体生存率、5年生存率、手术切除率比较,差异均有统计学意义(P<0.05),而两组围术期病死率比较,差异无统计学意义(P>0.05)。按Jadad质量评价方法评价,纳入的18项临床RCT,得分最高为7,最低为1,得分大于或等于4的研究有7个,<4的研究也有11个。
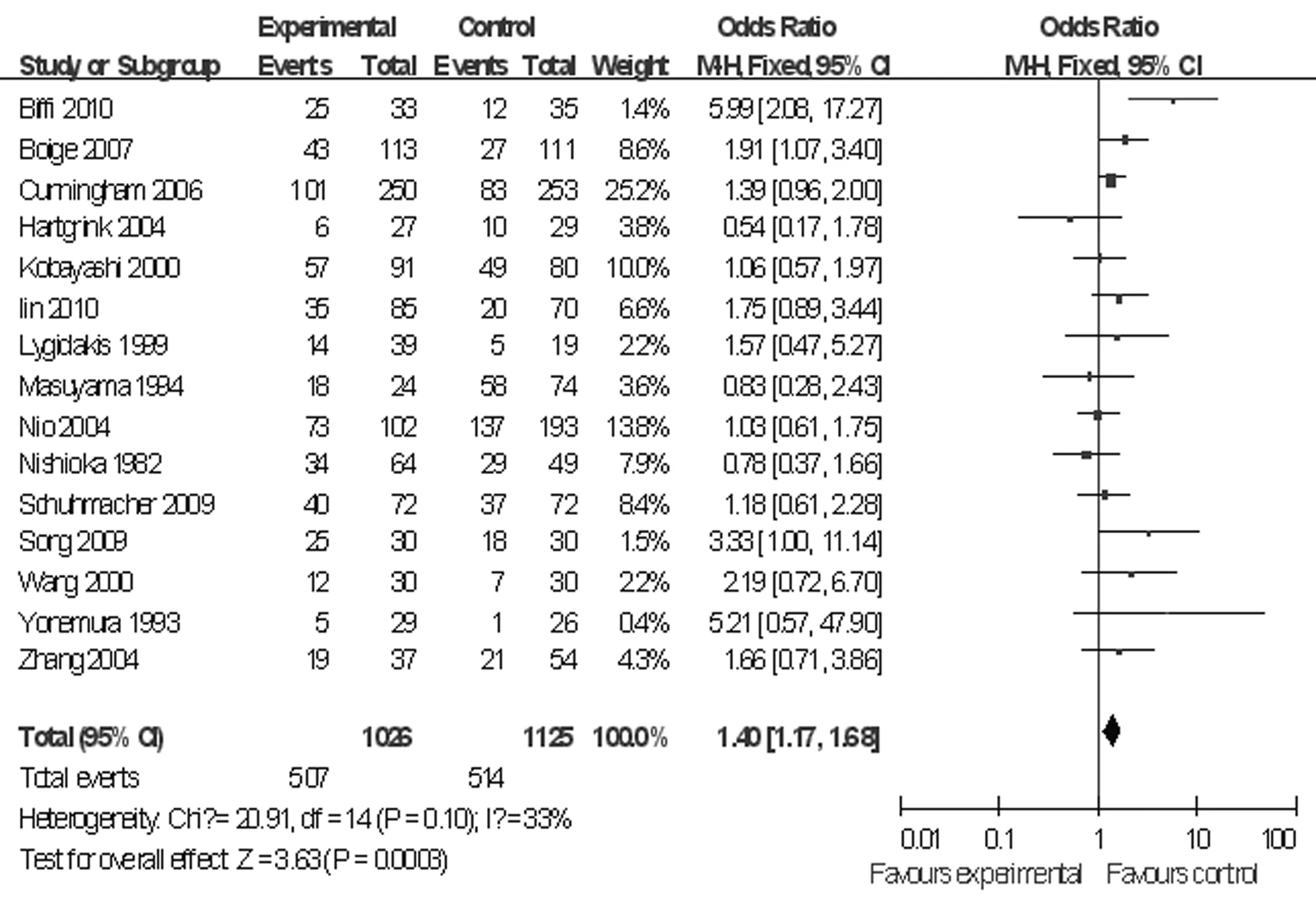
图2 新辅助化疗组与手术组的总体生存率的比较

图3 新辅助化疗组与手术组的围术期死亡率的比较
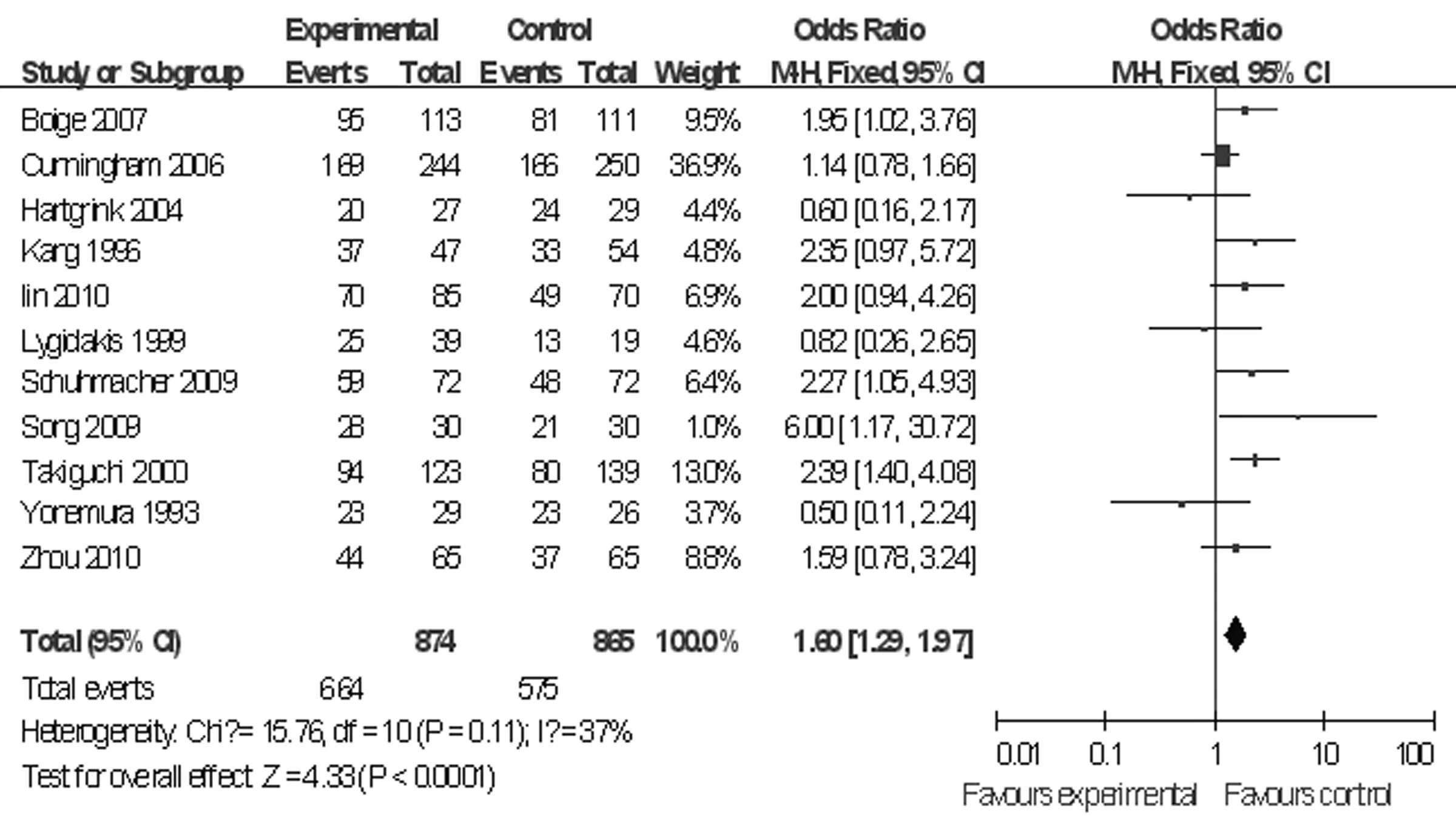
图4 新辅助化疗组与手术组的手术切除率的比较
3 讨 论
1982年Frei[23]首先提出了新辅助化疗的概念。新辅助化疗是指在手术前给予3个疗程左右的辅助化疗,其作用机制不同于手术后6~12个疗程的辅助化疗。很多试验都表明,通过临床检查或手术发现有40%~75%的可手术患者实际上都有亚临床转移或肿瘤已侵犯临近的组织、器官[24-25]。胃癌新辅助化疗的优势与其他非消化道肿瘤及胃癌术后辅助化疗相比,胃癌新辅助化疗可以不受术后胃肠道重建带来的消化功能减弱和体力下降的影响,并且其耐受性显著好于术后辅助化疗,患者可以接受更高剂量强度的化疗。本研究共纳入18个进展期胃癌新辅助化疗的临床RCT,共有2 685例患者入选。本研究结果表明进展期胃癌新辅助化疗后5年生存率和总体生存率均有明显提高,这与新辅助化疗降低肿瘤术前分期,提高手术切除率,治疗微小转移病灶等机制密切相关。本研究结果还显示,新辅助化疗组的手术切除率明显高于对照组,而两组的围术期病死率比较,差异无统计学意义(P>0.05),这表明进展期胃癌新辅助化疗不会增加手术风险。本研究与以往研究相比,样本量更大,分布范围更广,尤其包括了很多亚洲的病例,补增了新近的临床RCT[5-9],提供了更多进展期胃癌新辅助化疗疗效的证据,采用这样更详细研究资料的结果所做的系统分析,相信具有更强的说服力,亦能产生更准确的研究结果。
本研究纳入的18项临床RCT,研究证据的质量参差不齐,其中有7个研究属于高质量(≥4),11个研究属于低质量(<4),主要是随机分配不合理、随机分配方案隐藏的实施不明确或缺乏,无实施盲法或实施不清楚,因此可能产生选择、实施和结果的测量偏倚,从而影响结果及其论证强度。
总之,本研究结果显示,进展期胃癌行新辅助化疗不会增加手术的风险,能够提高胃癌手术切除率和患者的生存率。因本研究纳入的病例所使用的化疗方案不尽相同,故进展期胃癌新辅助化疗方案及新化疗药物的选用可能值得进一步研究。
[1]林三仁,张莉.胃癌研究的回顾与展望[J].胃肠病学,2002,7(3):133-1441.
[2]Wilke H,Preusser P,Fink U,et al.Preoperative chemotherapy in locally advanced and nonresectable gastric cancer:a phaseⅡstudy with etoposide,doxorubicin,and cisplatin[J].J Clin Oncol,1989,7(9):1318-1326.
[3]Higgins J,Green S.Cochrane handbook for systematic reviews of interventions[M].England:John Wiley & Sons Led,2008:78.
[4]Jadad AR,Moore RA,Carroll D,et al.Assessing the quality of reports of randomized clinical trials:is blinding necessary?[J].Control Clin Trials,1996,17(10):1-12.
[5]Biffi R,Fazio N,Luca F,et al.Surgical outcome after docetaxel-based neoadjuvant chem- otherapy in locally-advanced gastric cancer[J].World J Gastroenterol,2010,16(7):868-874.
[6]林孟波,薛芳沁,王金泗.Ⅲ期胃癌术前新辅助化疗85例临床分析[J].福建医药杂志,2010,32(5):20-22.
[7]周堃,纪俊标.Ⅲ期胃癌新辅助化疗效果的临床分析[J].基础与临床,2010,36(19):2333-2334.
[8]宋延强,李扬,庞新建,等.新辅助化疗FOLFOX4方案治疗进展期胃癌的效果[J].齐鲁医学杂志,2009,24(5):385-387.
[9]Schuhmacher C,Gretschel S,Lordick F,et al.Neoadjuvant chemotherapy compared with surgery alone for locally advanced cancer of the stomach and cardia:European Organisation for Research and Treatment of Cancer randomized trial40954[J].J Clin Oncol,2010,28(35):5210-5218.
[10]Boige V,Pignon J,Saint-Aubert B,et al.Final results of a randomized trial comparing preoperative 5-fluorouracil(F)/cisplatin(P) to surgery alone in adenocarcinoma of stomach and lower esophagus(ASLE):FNLCC ACCORD 07-FFCD 9703 trial[J].Proc Am Soc Clin Oncol,2007,25(18S):4510.
[11]Cunningham D,Allum WH,Stenning SP,et al.MAGIC Trial Participants.Perioperative chemotherapy versus surgery alone for resectable gastroesophageal cancer[J].N Engl J Med,2006,355(18):11-20.
[12]Hartgrink HH,van de Velde CJ,Putter H,et al.Neo-adjuvant chemotherapy for operable gastric cancer:long term results of the Dutch randomized FAMTX trial[J].Eur J Surg Oncol,2004,30(12):643-649.
[13]Nio Y,Koike M,Omori H,et al.A randomized consent design trial of neoadjuvant chemotherapy with tegafur plus uracil(UFT) for gastric cancer-a single institute study[J].Anticancer Res,2004,24(10):1879-1887.
[14]Zhang CW,Zou SC,Shi D,et al.Clinical significance of preoperative regional intra-arterial infusion chemotherapy for advanced gastric cancer[J].World J Gastroenterol,2004,10(3):3070-3072.
[15]Kobayashi T,Kimura T.Long-term outcome of preoperative chemotherapy with 5′-deoxy-5-fluorouridine(5′-DFUR) for gastric cancer[J].Gan To Kagaku Ryoho,2000,27(9):1521-1526.
[16]Wang XL,Wu GX,Zhang MD,et al.A favorable impact of preoperative FPLC chemotherapy on patients with gastric cardia cancer[J].Oncol Rep,2000,7(5):241-244.
[17]Takiguchi N,Oda K,Suzuki H,et al.Neoadjuvant chemotherapy with 5-fluorouracil(5-FU) or low dose cis-platinum(CDDP) + 5-FU in the treatment of gastric carcinoma with serosal invasion[J].Proc Am Soc Clin Oncol,2000,19(7):A1178.
[18]Lygidakis NJ,Sgourakis G,Aphinives P.Upper abdominal stop-flow perfusion as a neo and adjuvant hypoxic regional chemotherapy for resectable gastric carcinoma.A prospective randomized clinical trial[J].Hepatogastroenterology,1999,46(15):2035-2038.
[19]Kang YK,Choi DW,Im YH,et al.A phase Ⅲ randomized comparison of neoadjuvant chemotherapy followed by surgery versus surgery for locally advanced stomach cancer[J].Gan To Kagaku Ryoho,1994,21(13):2253-2255.
[20]Masuyama M,Taniguchi H,Takeuchi K,et al.Recurrence and survival rate of advanced gastric cancer after preoperative EAP-Ⅱ intra-arterial infusion therapy[J].Gan To Kagaku Ryoho,1994,21(13):2253-2255.
[21]Yonemura Y,Sawa T,Kinoshita K,et al.Neoadjuvant chemotherapy for high-grade advanced gastric cancer[J].World J Surg,1993,17(12):261-262.
[22]Nishioka B,Ouchi T,Watanabe S,et al.Follow-up study of preoperative oral administration of an antineoplastic agent as an adjuvant chemotherapy in stomach cancer[J].Gan To Kagaku Ryoho,1982,9(14):1427-1432.
[23]Frei E.Clinical cancer research:an embattled species[J].Cancer,1982,50(10):1979-1992.
[24]Katlic MR,Wilkins EW Jr,Grillo HC.Three decades of treatment of esophageal squamous carcinoma at the Massachusetts General Hospital[J].J Thorac Cardiovasc Surg,1990,99(5):929- 938.
[25]Kelsen D.Multimodality therapy for adenocarcinoma of the esophagus[J].Gastroenterol Clin North Am,1997,26(3):635-645.

