高黏附力双歧杆菌的筛选与鉴定
万翠香,章昭琳,王报贵,魏华,甘艳云
(1.南昌大学食品科学与技术国家重点实验室,南昌 330047;2.南昌大学中德联合研究院,南昌 330047;3.江西省新余市农业局,江西新余 338000)
高黏附力双歧杆菌的筛选与鉴定
万翠香1,2,章昭琳1,王报贵1,魏华1,2,甘艳云3
(1.南昌大学食品科学与技术国家重点实验室,南昌 330047;2.南昌大学中德联合研究院,南昌 330047;3.江西省新余市农业局,江西新余 338000)
利用体外细胞培养法,从实验室现有的10株双歧杆菌中筛选具有较强粘附能力的菌株。采用革兰氏染色法和平板计数法,评价了这10株双歧杆菌对HT-29细胞的粘附性能,通过测定这10株双歧杆菌的16S rRNA基因序列(16S rDNA)进行分类学鉴定。结果显示,WBBI01,WBBI02,WBIN03,WBBI06具有极强的黏附力,其黏附指数分别达1.97×103,2.17×103,3.57×103,1.88×103。经16S rDNA测序鉴定WBBI01,WBIN03,WBBI06均与两歧双歧杆菌S17有极高的同源性,而WBBI02属于长双歧杆菌。结果表明,双歧杆菌黏附性能具有明显的种属特异性,不同种属双歧杆菌的粘附能力相差极大,以两歧双歧杆菌的黏附性能最强,婴儿长双歧杆菌为最弱。
益生菌;16S rDNA;黏附;双歧杆菌;黏附指数
0 引言
双歧杆菌是动物肠道内最重要的生理性细菌之一,能与肠道上皮细胞紧密联系形成生物学屏障[1,2],而黏附是其与宿主相互作用的第一步[3],外源双歧杆菌能否在肠道内黏附和定殖是评定益生菌制剂效果的指标之一。因此对双歧杆菌黏附性能的研究具有重要的实际意义。
本研究采用体外细胞培养法[4],以实验室现有的10株双歧杆菌为对象,通过革兰氏染色法和平板计数法评价各双歧杆菌的黏附性能,筛选具有较强黏附力的菌株;采用分子生物学手段对各双歧杆菌进行了鉴定,并结合DNAMAN软件分析了各菌株之间亲缘关系。本研究为双歧杆菌的黏附机制及保护作用研究提供了良好的模式材料和方法,筛选获得的高黏附性能的双歧杆菌菌株为开发益生菌制剂提供材料。
1 实验
1.1 材料
菌株和细胞:10株双歧杆菌均由本实验室保藏;人结肠癌细胞系HT-29细胞株由南昌大学一附院馈赠。
培养基:MRS(Solarbio);DMEM培养液(Hyclone);胰蛋白酶-EDTA消化液(Solarbio);胎牛血清(GIBCO),pH 7.4 PBS缓冲液,Taq PCR mix(Takara),T-载体(Takara)。
主要仪器:二氧化碳培养箱(Thermo),低速离心机(湘仪离心机),倒置光学显微镜,厌氧培养箱,血球计数板等。
1.2 方法
1.2.1 双歧杆菌的细胞黏附实验[5]
HT-29细胞常规培养,实验之前将细胞接至6孔细胞板培养14 h,每孔中加入1 mL益生菌的菌悬液(细菌数为1×108~2×108mL-1)和1 mL新鲜的DMEM[6](pH=4.5)培养液,于37℃质量分数为5%的CO2,质量分数为95%空气的二氧化碳培养箱中共孵育3 h。孵育结束后,轻柔吸走上清,预冷PBS漂洗细胞4次,以除去未黏附的细菌,甲醛固定,革兰氏染色,镜检初步评价黏附能力。
1.2.2 双歧杆菌的细胞黏附能力测定
将黏附结束的细胞培养板用2 mL冷PBS轻柔洗涤4次,之后加入400 L胰蛋白酶消化液消化1 min,加入600 L预冷的PBS终止反应并轻轻吹打,将细胞及黏附的细菌制成菌悬液,吸到试管中,在振荡器上充分振荡,使细菌能够分散悬浮[7,8]。然后将菌悬液进行梯度稀释,稀释到105,然后从各个稀释度取10 L分区点滴到MRS平板培养基上,吹干后倒置于厌氧培养箱37℃培养24 h后,进行活菌计数,每株设立两个平行样本,每样本设立3个重复。对照组细胞培养皿的细胞悬液用血细胞计数板对细胞个数进行计数。根据活菌计数的结果以及对照培养皿细胞计数的结果,计算双歧杆菌对HT-29[9]细胞的黏附效果。黏附指数以100个细胞上黏附的细菌数表示。
1.2.3 高黏附力双歧杆菌的鉴定
利用16S rDNA分子生物学特征鉴定[10]。根据V3区两端保守区设计引物,则能够扩增细菌V3区相对应的可变区片段,测序分析比较来初步确定菌种的位置。设计引物为F:5’-GGTGAGAGTGGCGAACGGGT-3’,R:5’-AACGAGCGCAACCCTCGC-3’。以待测菌基因组为模板进行PCR扩增,PCR反应条件:95℃10 min,然后于94℃10 min,67℃30 s,72℃1.5 min扩增30个循环,72℃10 min。PCR产物经胶回收后克隆到T载体上进行测序。序列的同源性在GeneBank数据库中使用BLAST工具进行比较,并确定待测菌的分类地位。
2 结果
2.1 革兰氏染色法检测10株双歧杆菌的黏附能力
通过放大80倍的显微镜观察了10株双歧杆菌对HT-29细胞的黏附能力,结果如图1所示。由图1可以看出,双歧杆菌属的各种间不同菌株在体外对HT-29细胞的黏附能力相差很大,其中WBBI01, WBBI02,WBIN03,WBBR05,WBBI06,WLABO9双歧杆菌均有较强的黏附力,WBBR04与WBLO01的黏附力较弱,而WBAN07双歧杆菌黏附力极弱或几乎没有。
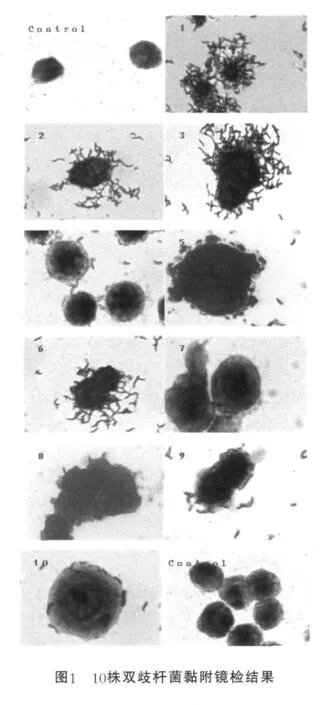
2.2 平板计数法评价10株双歧杆菌的黏附能力
结果显示:10株双歧杆菌对HT-29细胞的黏附指数(菌体数目/100 HT-29 cell)分别为1.97×103,2.17× 103,3.57×103,2.82×102,1.71×103,1.88×103,5.00× 10,5.71×102,9.14×102,3.06×102,如图2所示。

2.3 双歧杆菌的16SrDNA鉴定
提取菌株的总DNA进行PCR扩增,得到约1.4 kb的DNA片段。克隆测序后,将测定结果用Blastn进行序列同源性比对,根据比对结果分析10株菌株,采用16S rDNA序列分析的方法鉴定到属,具体结果如表1所示。

表1 16S rDNA鉴定结果
2.4 10株双歧杆菌的同源性分析
本研究选取了4个系统发生组的双歧杆菌典型株/标准株,另外以位于高GC含量的革兰氏阳性菌Listeria monocytogenesM7作为外群,基于Clustal V计算方法构建了以16S rDNA序列为基础的系统发育树状图(见图3)。

图3中,显示了所测序的10株双歧杆菌与其它同属标准株以及其它细菌的亲缘关系。树状图通过DNAMAN软件中的Align程序基于Clustal V方法构建,并以Listeria monocytogenesM7作为外群。树状图上方标尺bar(0.05)为千个核苷酸的替换率。
3 讨论
双歧杆菌在肠道中的黏附及定植,对维持肠道菌群的结构及功能起主导作用,因此,研究双歧杆菌的黏附机制对认识微生态学的基本规律有着重要意义。粘附性能检测是益生菌筛选的重要指标之一[11-12],目前国内外学者普遍采用体外培养肠上皮细胞的方法来评价菌株的黏附能力[13]。
1985年Huub等人开启了双歧杆菌黏附作用研究的先河,但其研究仅针对两歧双歧杆菌的脂磷壁酸(LTA),因此具有一定的局限性。20世纪90年代,Elo等人[14]采用体外细胞培养方法研究了4株双歧杆菌对人肠癌细胞(Caco-2)的粘附能力,其研究发现:两歧双歧杆菌12-1和SBT 2752,长双歧杆菌SBT-2919和SBT2934均对Caco-2细胞几乎没有粘附或粘附力非常弱。2005年Candela等人[15]同样采用体外细胞培养方法对比了7株双歧杆菌菌株对人肠道上皮细胞(Caco-2)的黏附能力,其研究表明双歧杆菌对Caco-2的黏附具有种属特异性,其中两歧双歧杆菌S17的黏附值(菌体数目/100 Caco-2cell)高达5.85×103,而长双歧杆菌E18和动物双歧杆菌BBSF的黏附力较弱,其黏附值(菌体数目/100 Caco-2cell)分别为1.94×102,1.77×102。Crociani等人[16]将体外细胞培养方法与体内试验进行了比较,验证了双歧杆菌体外黏附实验的准确性,为以后体外细胞培养方法研究双歧杆菌黏附作用提供了理论依据。
16S rDNA是编码原核生物核糖体小亚基rRNA(16S rRNA)的基因,长度约为1 500 bp,在结构与功能上具有高度的保守性,是细菌分类学研究中最常用、最有用的“分子钟”,若16S rRNA基因相似性大于97%,可以断定其为同一个属,并且初步认为其为同一个菌种(Gerald,2005)[17]。经典的菌株分类鉴定方法的最大缺陷在于即使进行了完整的各种鉴定试验,也可能导致对所分离的菌株鉴定结果的不确定性。与之相比,16S rDNA全序列分析鉴定法具有简便、快速、灵敏和经济的优点,是目前应用最广的分子微生物学检测的靶基因,已被众多学者用来对细菌的快速鉴定[18]。2004年涂宏钢等人利用16S rRNA全长序列鉴定了植物乳杆菌;2005年付晓艳等人通过16S rDNA测序将结果与同属及非同属的乳酸菌进行同源性比较,鉴定了乳酸乳球菌;2009年张朝正等人[10]利用16S rDNA序列分析和Biolog快速鉴定方法鉴定产脂肪酶菌株;2011年詹銮峰等人[19]将16S rDNA检测法应用到临床细菌的检验中,其研究通过设计合成所有细菌的通用引物,实现了一个样品中同时检测多种细菌。本研究所用的双歧杆菌对照株序列同测定序列的16S rRNA基因进化分析表明,其在16S rDNA序列相似性基础上聚类为3个簇群:Bifidobacterium bifidum;Bifidobacterium animalis;Bifidobacterium longum.本研究中的16S rDNA系统发育分析结果可以显示出这种进化模式,可以看出所分析的10株细菌起源于同一祖先。
本研究结合了各双歧杆菌黏附实验的优化方案,采用体外细胞培养法,以实验室现有的10株双歧杆菌为对象,筛选具有较强黏附能力的菌株。黏附结果表明,双歧杆菌各种属间不同菌株在体外对HT-29细胞的黏附能力相差很大,其中WBBI01,WBBI02,WBIN03, WBBR05,WBBI06,WLABO9双歧杆菌均有较强的黏附力,WBIN03具有最高的黏附值(菌体数目/100 HT-29 cell):3.57×103。本研究筛选获得的高黏附性能的双歧杆菌菌株为开发益生菌制剂提供了材料[20]。
[1]尤萍,马玉龙.双歧杆菌对肠上皮细胞粘附作用的研究机应用展望.饲料工业,2004,25:42-6.
[2]刘国荣,潘伟好,畅晓渊等.双歧杆菌的粘附特性及其对肠道致病菌的体外拮抗作用.微生物学通报,2009,36:716-21.
[3]孟祥晨,霍责成,张建友等.双歧杆菌对肠上皮细胞粘附作用研究状况.中国乳品工业.2002,30:0003-04.
[4]魏银萍,王斌,魏泓.益生菌株对HT-29细胞的粘附及对致病菌的粘附抑制性能研究.药物研究,2006,15(8):0007-02.
[5]张毅强,师帅帅.人大肠癌细胞原代培养方法的改进.吉林医学,2010,31:442-4.
[6]林雪彦,牛钟相.动物消化道乳酸菌粘附机制及影响因素研究进展.家畜生态学报,2006,27:0109-04.
[7]LIU C,ZHANG Z Y,DONG K,et al.Adhesion and Immunomodulatory Effects of Bifidobacterium lactis HN019 on Intestinal Epithelial Cells INT-407[J].World J Gastroenterol,2010,16:2283-2290.
[8]CANDELA M,PERNA F,CARNEVALI P,et al.Interaction of Probiotic Lactobacillus and Bifidobacterium Strains with Human Intestinal EpithelialCells:AdhesionProperties,CompetitionagainstEnteropathogens and Modulation of IL-8 Production[J].International Journal of Food Microbiology,2008,125:286-292.
[9]刘长宝陈爱华,凌志强.HT-29肠癌细胞与血管内皮细胞黏附特性及作用机制研究.温州医学院学报,2007,37:0429-04.
[10]张朝正,郭兰珍.利用16S rDNA序列分析和Biolog快速鉴定方法鉴定产脂肪酶菌株.河北工业大学学报,2009,38(5):0052-04.
[11]PREISING J,MARITA G,HUA W,et al.Selection of Bifidobacteria Based on Adhesion and Anti-Inflammatory Capacity In Vitro for Amelioration of Murine Colitis[J].Applied and Enviromental Microbiology,2010,76:3048–3051.
[12]周佳青,周梁,金晓杰.细胞因子IFN-γ和IL-1β对人喉鳞癌细胞粘附和浸润能力的影响.中国耳鼻咽喉颅底外科杂志,2005,11(4): 0217-04.
[13]RIEDEL C U,FRANCIS F,DARLENE R G,et al.Interaction of Bifidobacteria with Caco-2 Cells adhesion and Impact on Expression Profiles[J].International Journal of Food Microbiology,2006,110:62-68.
[14]ELO S M.Attachment of Lactobacillus Casei Strain GG to Human Colon Carcinoma Cell Line Caco-2:Comparison with Other Dairy Strains[J].Letters in Applied Microbiology,1991,13:154-156.
[15]CANDELA M,SEIBOLD G,VITALI B,et al.Real-time PCR Quantification of Bacterial Adhesion to Caco-2cells:Competition between Bifidobacteria and Enteropathogens[J].Res Microbiol, 2005,156(8):887-895.
[16]CROCIANI J.Adhesion of Different Bifidobacteria Strains to Human Enterocyte-Like Caco-2 Cells and Comparison with in Vivo Syudy [J].Letters in Applied Microbiology 1995;21:146-148.
[17]GERALD W T.Probiotics and Prebiotics-Scientific Aspects[J],Caister Academic Press,2005,12-38.
[18]王宏梅,于洁,包秋华,等.利用16S rDNA序列及tuf-RFLP鉴定蒙古国发酵乳中的乳酸菌.中国乳品工业,2011,39(7):4-5.
[19]詹銮峰,高鹏.16SrDNA检测在临床细菌检验中的应用,2011,07: 1140-1143.
[20]陈曦.乳杆菌属的益生菌保健功能及研究进展.中国乳品工业, 2011,39(7):0040-04.
Screening and Identification of high adhesion Bifidobacteria to HT-29 Cell
WAN Cui-xiang1,2,ZHANG Zhao-lin1,WANG Bao-gui1,WEI Hua1,2,GAN Yan-yun3
(1.State Key Laboratory of Food Science and Technology,Nanchang University,Nanchang 330047,China;2.Jiangxi-OAI Joint Research Institute,Nanchang 330047,China;3.Jiangxi Xinyu Agricultural Bureau,Xinyu,338000,China)
The adhesion capacity of tenBifidobacteria strainsin vitro was investigated.Gram staining and plate counting method were used to evaluate their adhesion capacity to HT-29 cell,and 16S rDNA sequencing analysis was carried out to identify the strain..Based on the data in vitro,High attachment was observed inBifidobacteriaWBBI01,WBBI02,WBIN03,WBBI06,their adhesion index reached(bacterial cells/100 Caco-2 cells)1.97×103,2.17×103,3.57×103,1.88×103repectively,while low attachment was shown in other strains.Identification of the strain indicates that the homology ofBifidobacteriaWBBI01,WBIN03,WBBI06 with B.bifidumS17 were all above 99%,WBBI02 belongs toB.longum.The adhesion capacity varied considerably among different strains.B.bifidumWBIN03 was the most adhesive and the adhesion ability ofBifidobacteriaWBAN07 was the weakest among all the tested strains.
Bifidobacteria;16S rDNA sequencing;Identification;Adhesive activity
Q93-33
A
1001-2230(2012)05-0013-03
2011-12-26
国家自然科学基金项目(30900038),国家“863”计划专题(2008AA10Z337),国家自然科学基金项目(31000048),2009年江西省主要学科学术和技术带头人培养计划,江西省教育厅科研基金(GJJ10379)。
万翠香(1977-),女,副教授,主要从事益生菌的分子生物学研究。
章昭琳
book=33,ebook=163
——中国益生菌信息与技术交流平台

