北部湾金线鱼、深水金线鱼与日本金线鱼矢耳石形态识别的初步研究*
侯 刚,冯 波,颜云榕,卢伙胜**,吴仁协
(广东海洋大学1.水产学院;2.南海渔业资源监测与评估中心,广东湛江524025)
北部湾金线鱼、深水金线鱼与日本金线鱼矢耳石形态识别的初步研究*
侯 刚1,2,冯 波1,2,颜云榕1,2,卢伙胜1,2**,吴仁协1
(广东海洋大学1.水产学院;2.南海渔业资源监测与评估中心,广东湛江524025)
采用2010年1~9月采自北部湾及邻近海域流刺网渔获的54尾金线鱼(Nemipterus virgatus(Houttuyn,1782))、71尾深水金线鱼(Nemipterus bathybius Snyder,1911)和65尾日本金线鱼(Nemipterus japonicus(Bloch,1791))耳石样本,进行了椭圆傅立叶分析。耳石轮廓经图像处理后进行灰阶转换和二值化处理,消除噪点,然后解析为椭圆傅立叶标码(EFDs)。采用77个EFD系数进行主成分分析和判别分析来区分3种金线鱼的耳石。结果表明,日本金线鱼幼鱼和成鱼耳石在性成熟前后存在显著的体长效应(P<0.05),金线鱼和深水金线鱼则体长效应不显著(P>0.05)。因此在耳石椭圆傅立叶分析中,日本金线鱼采用性成熟个体样本,金线鱼和深水金线鱼采用全部样本。主成分分析中,第1、第2和第3主成分,分别解释了总变异的65.1%,15.3%和5.3%,可以将3种金线鱼耳石区分开来。EFD系数的逐步判别分析中,3种鱼的平均正判率达98.6%;交互验证结果显示,3种鱼的平均正判率达97.9%,这表明耳石椭圆傅立叶分析可以作为鱼种识别的有效工具。
深水金线鱼;金线鱼;日本金线鱼;椭圆傅立叶分析;种类识别
物种鉴定和种群识别在保护生物多样性、保护野生资源以及渔业管理中具有重要作用。在研究生物学特性如生长、死亡、繁殖习性、营养级、营寄生关系、生活史和古生物学事件时经常需要正确识别单个物种。物种鉴定与种群识别的传统方法主要依赖形态学和体节特征[1-3],但是这些方法会经常遇到可靠性问题[4-6]。近些年得到广泛使用的遗传学方法[7-8],由于费用昂贵而无法在大规模调查中使用,而传统的形态学分类技术得到了长足的发展和进步,如傅立叶分析技术通过鱼鳞识别种群[9-10],利用小波分析替代傅立叶分析来改善识别技术[11],以及基于地标数据的几何形态学测量方法(geometric morphometric methods,GMMS)[12]。这些方法在物种鉴定和物种识别中得到了互相补充和印证。
近年来,耳石因为具有种的区别,耳石形态学分析在鱼类物种及种群识别领域得到了广泛的应用,且效果良好[13-14],逐渐得到国内水产领域学者的广泛重视,如叶振江等对中日2种花鲈耳石形态的地理变异分析[15],以及对2种天竺鱼耳石形态识别的研究[16];郭弘艺等对中国4种鲚属鱼类的矢耳石形态特征的比较分析[17],张波等对黄海重要饵料鱼种的矢耳石形态描述[18],以上研究为鱼类耳石在鱼类系统分类学研究中的应用奠定了一定基础。
金线鱼属(Nemiptemy),隶属于鲈形目金线鱼科(Nemipteridae),是南海重要的经济鱼类,产量较高,具有重要经济价值。调查统计结果显示,金线鱼属在2009年南海渔业中产量为5.64万t,居南海总产第7位,其中仅金线鱼单种幼稚鱼损害渔获在2009年为858.535 t,居幼鱼损害第17位,幼鱼损害严重①南海渔业生产损害经济幼鱼状况调查报告(2009年度)。卢伙胜主编,p15-41,2010-05.。金线鱼Nemipterus virgatus(Houttuyn,1782)、深水金线鱼Nemipterus bathybius Snyder,1911和日本金线鱼Nemipterus japonicus(Bloch,1791)是北部湾金线鱼属重要的经济渔获种类,关于其耳石形态学的系统研究目前国内尚无报道。本文尝试使用耳石轮廓的傅立叶形态分析,鉴别北部湾金线鱼属种类,为我国金线鱼科系统分类和地理学研究提供更多的佐证和基础数据。
1 材料与方法
1.1 采样
实验用金线鱼与深水金线鱼来自流刺网按站点渔业资源调查取样(B),调查渔船为琼临高04016号,主机核定功率144.4 k W,渔船吨位为88 t。调查网具为三重流刺网,调查船配备网片524张,单个网片规格40 m×4.8 m;大网目目大40 cm,小网目目大5.3~5.4 cm;上纲浮子与底纲沉子配比为1∶7。由于B站点海域调查时没有采集到日本金线鱼,其样本采自同队流刺网船商业性生产捕捞(见图1A),基本情况见表1。该3种金线鱼种类的鉴定依据《福建鱼类志》[19]进行。样本在调查船靠岸后按照海洋调查规范(GB12763.3-91)[20]进行常规生物学测定后,摘取矢耳石经清洗、拭干后装入2 m L离心管备用。
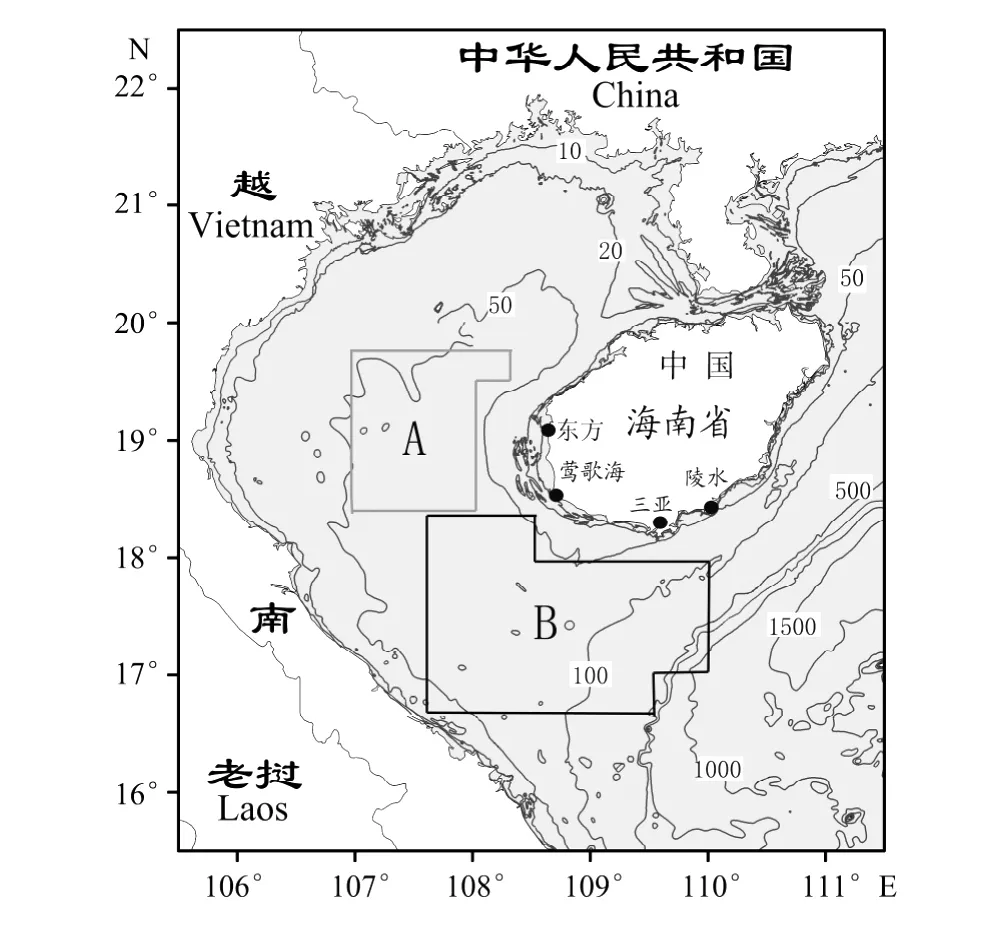
图1 金线鱼采样位置Fig.1 Locations of sampling Nemipterus species
1.2 方法
1.2.1 形态特征测定 本研究以左侧矢耳石作为材料。首先于人工气候箱50℃烘干48 h,用电子天平(SHIMADZU AUY220)称重(d=0.000 1 g),然后放入盛有体积分数50%酒精的离心管中保存。通过体视显微镜(型号:Nikon ZOOM645S)进行观察,利用测微尺在相同目镜物镜观测倍数下进行拍摄定标,置于耳石图像分析系统(ZOOM 645S CCD)进行拍摄矢耳石整体形态(见图2),利用Spot图像分析软件测量矢耳石的所需性状指标(见图3,d=0.000 1 mm)。拍摄时将耳石浸于水中,前区向右,反射光下对内侧面和外侧面均进行定倍拍照(8~10 X)。本研究中使用的耳石性状名称与量度指标参照叶振江[15]和郭弘艺[17]的研究。
1.2.2 分析方法
耳石形态描述 为确定鱼类性成熟和体长是否对所研究种类的耳石形态存在统计意义上的影响,本研究采用50%性成熟体长(l50)[21]为幼鱼和成鱼的判别标准,并采用成形系数、圆形趋近率[22]和矩形趋近率[16]进行耳石轮廓方面的变化分析。l50根据当年种类逐月采样判断的繁殖期中雌性Ⅳ期为性成熟标准进行估算,耳石轮廓的变化分析模型如下:
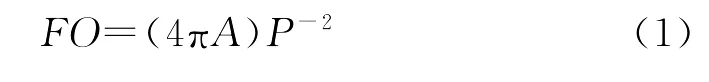

式中:A为耳石面积;P为耳石周长;Sr为耳石最小外切矩形面积;FO为成形系数;C为圆形趋近率;R为矩形趋近率。
椭圆傅立叶分析 闭合形态的傅立叶分析用于耳石二维像影的轮廓与形态分析。该方法将不规则的等值轮廓线解析成一系列直交系术语,即椭圆傅立叶标码(Elliptic Fourier descriptors,EFDs)或称为谐函数(谐波)。谐波是一系列正弦和余弦曲线,即是由1个物体的质心引出的半径矢量,当物体绕质心转动时,不同的相位角形成了不同的半径矢量,该数据可以表达成一系列正弦和余弦曲线。
Iwata和Ukai开发了SHAPE软件[23],以EFDs表达耳石的轮廓线数据,该软件经过图像的灰阶转换、二值化处理、噪音消除、编制码链、傅立叶转换,得到EFDs,使能够进行EFDs主成分分析和图形可视化。首先运用Chaincoder1.2a软件包从耳石数码图像上提取轮廓线,并把相关信息存储成码链。然后运用Chc2Nef软件包通过离散傅立叶变换将轮廓线码链标准化为EFD系数。所有谐次的EFD系数以第一谐次EFD系数标准化,转化成与大小、旋转、起点无关的不变量。最后在PrinComp1.2软件包下采用20个谐次描述轮廓线,对耳石轮廓信息进行分析与图形重建。在EFD系数标准化时,第一谐次中的前3个EFD系数被设为定值(a1=1,b1=c1=0),因此每个耳石轮廓信息实际由77个EFD系数表达。EFD系数在X轴上由aj和bj标示,在Y轴上由cj和dj标示[24]:

公式(4)~(7)中,N为分段的数目;L为耳石外部轮廓周长;
Δxi、Δyi:步骤i-1与i在X轴、Y轴上的置换值,
Δsi:步骤i-1与i之间线形线段的长度,Δsi=si:至步骤i时线段的累计长度。
主成分分析 对3种金线鱼种类完整耳石的数码图像利用EFD系数进行主成分分析(Principal component analysis,PCA),得到各主成分负荷值和贡献率,并根据各主成分的得分绘制主成分分布图。判别分析 对3种金线鱼种类完整耳石样本标准化的77个EFD系数进行逐步判别分析(Gradual discriminant analysis,GDA),得到各特征向量值,并根据各特征向量值绘制典型判别分析分布图。
以上所有数据使用Excel2003和SPSS16.0进行统计分析。

表1 3种金线鱼属鱼类的样本信息Table 1 Sampling informations of three Nemipterus species

图2 3种金线鱼右矢耳石内侧面与轮廓线提取Fig.2 The right sagitta convexity surface and extracted contour of three Nemipterus species
2 结果
2.1 矢耳石轮廓变化的性成熟体长效应分析
以l50为标准将3种金线鱼样本划分为幼鱼和成鱼2个体长组,对其进行了方差齐性检验和one-way ANOVA分析。分析结果表明,在P=0.05水平上,金线鱼和深水金线鱼的幼鱼和成鱼间矢耳石的成形系数、圆形趋近率和矩形趋近率均无显著性差异,即轮廓变化不存在显著性差异;日本金线鱼的幼鱼和成鱼间矢耳石的成形系数、圆形趋近率存在显著性差异,矩形趋近率不存在显著性差异,即轮廓变化存在一定的显著性差异(见表2)。因此,在傅立叶耳石轮廓分析中,金线鱼和深水金线鱼的耳石样本不存在明显的l50体长效应,可以采用所有耳石样本;日本金线鱼则存在较为明显的l50体长效应,需要采用性成熟后的耳石样本。
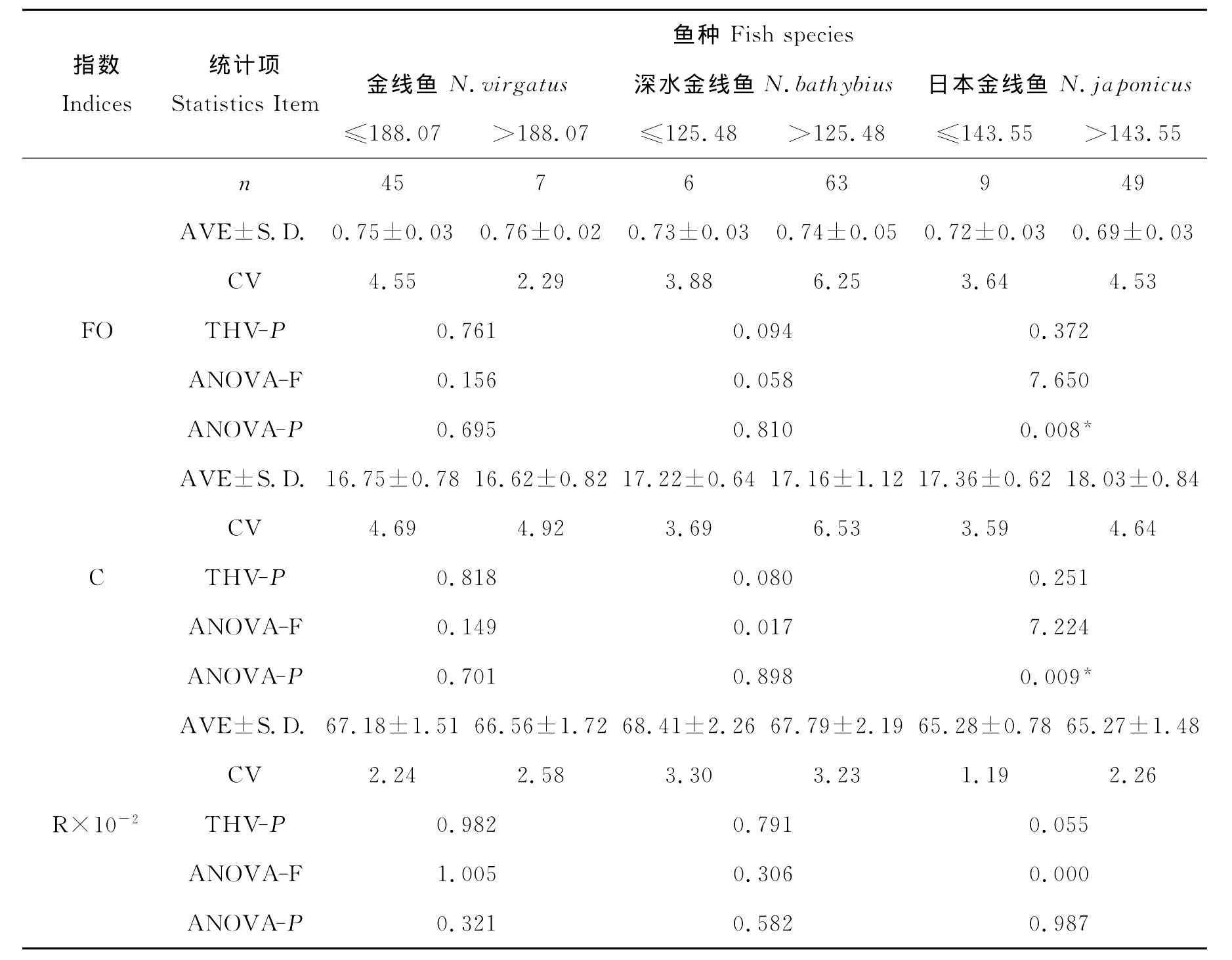
表2 矢耳石形态变化特性与方差分析Table 2 Morphology variation of sagitta and ANOVA analysis
2.2 傅立叶分析
利用傅立叶分析方法对3种金线鱼矢耳石的轮廓进行重建。耳石轮廓重建过程表明,低值的谐次在耳石整体轮廓构建中具有较大的贡献率,而随着谐次数的增加,其对整体轮廓的影响逐渐变小,而在局部轮廓层面起到较大的贡献作用(见图3)。为确定傅立叶谐次数与耳石轮廓构建的关系,对EFD系数在Y轴上的振幅进行分析。结果表明,3种金线鱼前10个谐次的振幅绝对值较大(0.001<am<0.023),基本表达了耳石的主要形态特征,从第10个谐次开始振幅幅度不明显(0.001<am<0.033),在耳石形态局部轮廓上具有一定的贡献(见图4)。以上表明依据耳石形态进行判别分析主要来自于前10个谐次,因而耳石形态学变化更依赖于整体轮廓变化而不是局部形态学性状。

图3 以金线鱼为例利用傅立叶谐次数对金线鱼属矢耳石的图形重建Fig.3 Reconstruction of Nemipterus sagitta shape from its Fouries variable taken N.virgatus as an example

图4 利用傅立叶谐次数对3种金线鱼矢耳石的图形重建Fig.4 Mean amplitudes of elliptical Fourier harmonics 2~20 derived from three species otoliths of the genus Nemipterus
2.3 主成分分析
3种金线鱼耳石轮廓EFDs主成分分析后的前7个主成分特征值与贡献率如表3所示。第1主成分的特征值5.571,解释了总变异的65.086%,与第2、3主成分一起的累计贡献率达到了85.652%(见表3)。耳石重建的轮廓变异可视化结果表明,3种金线鱼属耳石形态在耳石长轴方向、短轴方向和后区(PC1反映),耳石基叶和主间沟(PC2反映)以及翼叶(PC3反映)出现了较为明显的分化(见图5)。

表3 椭圆傅立叶分析前7个主成分的特征值与贡献率Table 3 Eigenvalues and contributions of the first seven principal components of elliptic Fourier descriptors

图5 利用有效主成分对金线鱼矢耳石的轮廓重建变异可视化Fig.5 Visualized variation in otolith shape that can be accounted for by each component

图6 3种金线鱼第1、2主成分散布图Fig.6 Scatterplots of scores on the 1st and 2nd components of three Nemipterus species
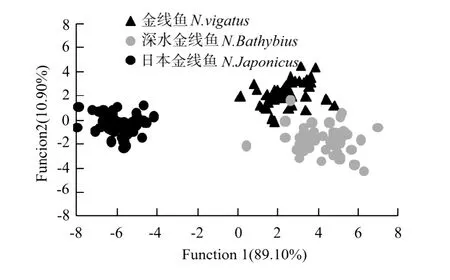
图7 3种金线鱼耳石典型判断分析散布图Fig.7 Scatterplots of canonical discriminat principle functions for the three Nemipterus species
2.4 判别分析
本文将耳石轮廓傅立叶分析的77个EFD系数建立Bayes判别函数,通过逐步判别分析和交互验证法判断进行判别分析。逐步判断分析结果显示,15个EFD系数纳入到分析中,判别方程系数见表4。金线鱼没有样本判入其它鱼种中,判断成功率为100%;深水金线鱼49尾样本中,错判入金线鱼2条,判断成功率为95.9%;日本金线鱼49尾成鱼样本中,没有样本判入其它鱼种中,判断成功率为100%(见表5)。
从判断分析的第1特征向量与第2特征向量所作的典型判断分析图可以看出(见图7),深水金线鱼耳石部分样本与金线鱼重叠,但日本金线鱼耳石与金线鱼、深水金线鱼出现了较为明显的分化。因此可以将其作为种类识别的重要特征之一。

表4 3种金线鱼耳石性状的典型判别方程系数Table 4 Fisher's linear discriminant functions coefficients of the sagitta shape variables for three Nemipterus species
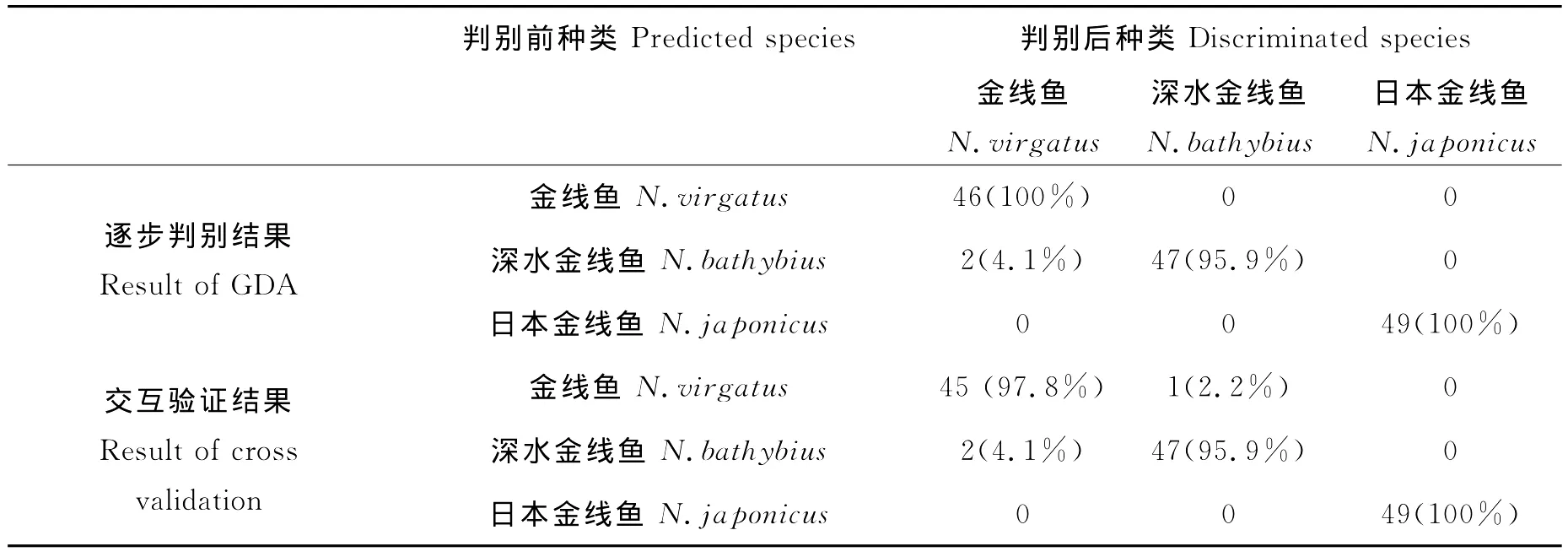
表5 3种金线鱼耳石判别结果Fig.5 Discrimination results of three Nemipterus species
3 讨论
3.1 性成熟对3种金线鱼耳石轮廓的影响
鱼类耳石终生生长,沉积后,不易被重新吸收或改变,不受短期因素(如饥饿)的影响,是耳石优于鱼体其它组织的特点[25-26],因而被作为具有种的属性而用于进行辅助鱼类鉴定工作之中[13-14]。但是有研究发现,耳石会随着鱼类的生长而发生形态发育变化,如Tuset在研究大西洋中部加那利群岛的3种鳍属鱼类耳石形态时发现黑尾鳍S.atricauda矢耳石的形态会随着体长的增长而变圆,纹首鳍S.scriba的耳石形态随着体长的增长而变椭圆,S.cabrilla耳石形态则介于二者之间[22]。头足类柔鱼不同的幼体和成体发育阶段也存在耳石形态变异[27-28]。那么这种耳石的形态发育是否对进行种类识别甚至群体判别产生影响,是需要进行判断的。
本文通过成型系数、圆形趋近率和矩形趋近率对金线鱼属3种金线鱼的矢耳石轮廓进行研究,结果表明3种金线鱼类矢耳石形态随着鱼类的生长和性成熟发生形态发育变化,其中金线鱼、深水金线鱼的幼鱼和成鱼不存在形态统计学上的差异,日本金线鱼则存在形态统计学意义上的差异(P<0.05)。Bouain和García-Díaz认为,所有建立的耳石性状变化解释了耳石的增长是在鱼体的生长周期内,并且大部分的生长变化发生在初次性成熟时[29-30]。在这个体长段期间,鱼的新陈代谢经历了重要的变化,造成了生长变化,这也影响了鱼的耳石形态变化[31]。因而,运用耳石形态进行种类识别或者耳石差异变化较细微的群体判别时,应该运用耳石形态较为稳定的性成熟后个体。
3.2 基于矢耳石轮廓形态的种类识别有效性分析
在3种金线鱼耳石形态重建中,前10个谐次的谐值基本上重建了矢耳石形态(见图4),仅在绘制轮廓边缘凹凸明显的地方存在不足,而第20个谐次的谐值基本将此弥补,但要重建到真实的耳石形态,则需要添加更多的谐次(见图3)。张国华在鲤鱼耳石重建中也得到了近似的重建结果[32]。Campana在大西洋鳕耳石傅立叶分析中认为,前20个谐次概括了99.9%以上的耳石形态变异,其中矢耳石前10个谐次解释了99.5%的形态变异,第10个后的谐次,相角变的较为随机,越往后的谐次越具有很少的有效形态变异[33]。因而,本文采用了前20个谐次的谐值纳入之后的统计分析中。
3种金线鱼耳石轮廓EFDs主成分分析中,反映耳石长轴方向、短轴方向和后区变异的第1主成分,与反映耳石基叶和主间沟的第2主成分以及反映翼叶的第3主成分(见图5),共同解释了总变异的85.652%(见表3),表明这3种金线鱼的耳石种间变化与形态差异,主要体现在以上形态特征方面,其性状可以作为进行种类区分的主要形态特征。3种金线鱼的耳石听沟也存在较为明显的形态差异(见图2),但是由于本研究采用耳石的外部轮廓形态进行椭圆傅立叶分析,未采用听沟的形态度量特征进行分析,有待于今后将听沟萃取出来,或者通过传统的形态学方法进行比较研究。
3种金线鱼耳石轮廓的傅立叶分析的77个EFD系数中,有15个纳入到逐步判断分析中(见表4),其中前5个谐次的谐值纳入了7个,占46.67%;第5~10个谐次的谐值纳入了4个,占26.67%;第11~20个谐次的谐值总共纳入4个,占26.67%,表明在金线鱼种类识别中,靠前的谐次对形态差异判别的贡献较大,起到了重要的作用,而靠后的谐次体现在形态细节上的差异,作用相对较小。Campana在大西洋鳕种群分析中认为,2~5组谐值在傅立叶分析中是最重要的,第8个谐次之后的谐值总解释率不到1%[33]。张国华认为第1~5组谐值主要是用来种类识别的,而描述耳石形态细节的第6~20组谐值在群体识别中发挥了主要的作用[32]。
在本研究中,逐步判断分析结果显示,3个金线鱼的矢耳石傅立叶分析判入成功率高达95.9%~100%,交互验证也出现近似结果(见表5)。典型的判别分析结果也出现在其它鱼类研究中[32-35],表明利用耳石傅立叶分析进行鱼类物种识别是1种较为有效的判别方法。另外,日本金线鱼由于其独特的耳石结构,错判率为0;而深水金线鱼错判入金线鱼的几率为4.1%,金线鱼错判入深水金线鱼的几率为2.2%,图7显示深水金线鱼与金线鱼关系较近,可能具有一定的近缘关系。L′Abée-Lund认为耳石形态主要是在遗传控制之下生长的[36],因而造成了种间的耳石形态学变化。早在1977年,Post和Hecht就发现不同鱼种的耳石存在不同,发现了与形态学、解剖学和细胞学特征相似的系统发育结论[37]。Lombarte等也发现南极鰧科群聚鱼类耳石与解剖学相似的系统发育特征[38]。因而,耳石形态特征可以被用来确立鱼种系统发育关系。本文通过对3种金线鱼耳石形态的典型判断分析表明,深水金线鱼与金线鱼关系较密切,而日本金线鱼则与其他二者较远(见图7)。这是否与遗传学亲缘关系有关,有待于以后与这3种鱼的遗传分子学研究结果进行相互比较。
致谢:琼临高04106号黄国翻船长在流刺网海上监测与定点取样方面给予大力支持;海渔1081班史亚峰、宋一平、李强、魏法俊等同学在野外采样与解剖实验中给予大力支持,在此谨表谢意!
[1] Casselan J M,Collins J J,Crossman E J,et al.Lake whitefish(Coregonus clupeaformis)stocks of the Ontario waters of Lake Huron[J].Canadian Journal of Fisheries and Aquatic Science,1981,38:1772-1789.
[2] Ihssen P E,Brooke H E,Casselan J M,et al.Stock identification:materials and methods[J].Canadian Journal of Fisheries and Aquatic Science,1981,38:1838-1855.
[3] Cadrin S X.Advances in morphometirc identification of fish stocks[J].Reviews in Fish Biology and Fisheries,2000,10:91-112.
[4] Jerry D R,Cairns S C.Morphological variation in the catadromous Australian bass,from seven geographically distinct riverine drainages[J].The Journal of Fish Biology,1998,52:829-843.
[5] Swain D P,Foote C J.Stocks and chameleons:the use of phenotypic variation in stock identification[J].Fisheries Research,1999,43:113-128.
[6] Murta A G.Morphological variation of horse mackerel(Trachurus trachurus)in the Iberian and North African Atlantic:implications for stock identification[J].ICES Journal of Marine Science,2000,57:1240-1248.
[7] Hutchinson W F,Carvalho G R,Rogers S I.Marked genetic structuring in localized spawning populations of cod(Gadus morhua)in the North Sea and adjoining waters,as revealed by microsatellites[J].Marine Ecology Progress Series,2001,223:251-260.
[8] Mariani S,Hutchinson W F,Hatfield E C,et al.North sea her-ring population structure revealed by microsatellite analysis[J].Marine Ecology Progress Series,2005,303:245-257.
[9] Richards R A,Esteves C.Use of scale morphology for discriminating wild stocks of Altantic striped bass[J].Transactions of the American Fisheries Society,1997,126:919-925.
[10] Poulet N,Reyjol Y,Collier H,et al.Does fish scale morphology allow the identification of populations at a local scale?A case study for rostrum dace Leucius leuciscus burdigalensis in River Viaur(SW France)[J].Aquatic Sciences,2005,67:122-127.
[11] Watkinson D A,Gillis D M.Stock identification of Lake Winnipeg walleye based on Fourier and wavelet description of scale outline signals[J].Fisheries Research,2005,72:193-203.
[12] Crews S C,Hedin M.Studies of morphological and molecular phylogenetic divergence in spieders(Araneae:Homalonychus)from the American southwest,including divergence along the Baja California Peninsula[J].Molecular Phylogenetics and Evolution,2006,38:470-487.
[13] Smith M K.Regional Differences in Otolith Morphology of the Deep Slope Red Snapper Etelis carbuncdus[J].Canadian Journal of Fisheries and Aquatic Science,1992,49:795-804.
[14] Groa P,Gavin A B,Gudrun M.Discrimination between Icelandic cod(Gadus morhua L.)populations from adjacent spawning areas based on otolith growth and shape[J].Fisheries Research,2006,80:182-189.
[15] 叶振江,孟晓梦,高天翔,等.中日两种花鲈(Lateolabrax sp.)耳石形态的地理变异[J].海洋与湖沼,2007,38(4):356-360.
[16] 王英俊,叶振江,刘群,等.细条天竺鱼与黑鳃天竺鱼耳石形态识别的初步研究[J].海洋与湖沼,2010,41(2):282-285.
[17] 郭弘艺,唐文乔,魏凯,等.中国鲚属鱼类的矢耳石形态特征[J].动物学杂志,2007,42(1):39-47.
[18] 张波,戴芳群,金显仕.黄海重要饵料鱼种矢耳石的形态特征[J].中国水产科学,2008,15(6):917-923.
[19] 《福建鱼类志》编写组.福建鱼类志,下卷[M].福州:福建科技出版社,1985:187-192.
[20] 国家技术监督局.海洋调查规范-海洋生物调查[S].北京:中国农业出版社,1991.
[21] 冯波,侯刚,卢伙胜,等.北部湾二长棘鲷开发保护策略研究[J].农业系统科学与综合研究,2009,25(1):110-119.
[22] Tuset V M,Lombarte A,Gonzalez J A,et al.Comparative morphology of the sagittal otolith in Serranus spp.[J].Journal of Fish Biology,2003,63:1491-1504.
[23] Iwata H Y,Ukai.A computer program package for quantitative evaluation of biological shapes based on elliptic Fourier descriptors[J].Journal of Heredity,2002,93:384-385.
[24] Kuhl F,Giardina C.Elliptic Fourier features of a closed contour[J].Computer Graphics and Image Processing,1982,18:236-258.
[25] Smith M K.Regional differences in otolith morphology of the deep slope red snapper(Etelis carbunculus)[J].Canadian Journal of Fishenes and Aquatic Science,1992,49:795-804.
[26] Friedland K D,and D G Reddin.Use of otolith morphology in stock discriminations of Atlantic salmon(Salmo salar)[J].Canadian Journal of Fisheries and Aquatic Science,1994,51:91-98.
[27] Clarke M R.The cephalopod statolith-an introduction to its form[J].Journal of the Marine Biological Association of the UK,1978,58:701-712.
[28] Arkhipkin A I,Bizikov V A.Statolith in accelerometers of squid and cuttlefish[J].Ruthenica,1998,8:81-84.
[29] Bouain A.Les serrans(téléostéens,serranidés)des cǒtes sud de la Tunisie[J].Taille de Première Maturité,Période de Reproduction,Cybium,1981,5:65-75.
[30] García-Díaz M M,Tuset V M,González J A &Socorro J.Sex and reproductive aspects in Serranus cabrilla(Osteichthyes:Serranidae):macroscopic and histological approaches[J].Marine Biology,1997,127:379-386.
[31] H rk nen T.Guide to the otoliths of the bony fishes of the Northeast Atlantic[M].Hellerup:Danbiu,(1986).
[32] 张国华.耳石形态和元素组成及其与鱼类群体识别的研究[D].中国科学院水生生物研究所,2000:1-208.
[33] Campana S E,Casselman J M.Stock discrimination using otolith shape analysis[J].Canadian Journal of Fisheries and Aquatic Science,1993,50(5):1062-1083.
[34] Garbriel J.Torres,Aotoni Lombarte and Beatriz Morales-Nin.Sagittal otolith size and shape variability to identify geographical intraspecific differences in three species of the genus Merluccius[J].Journal of the Marine Biological Association of the UK,2000,80:333-342.
[35] WANG Yingjun,YE Zhenjiang and LIU Qun.Use of Otolith Shape for the Identification of Trumpeter Sillago(Sillago maculata)and Silver Sillago(Sillago sihama)[J].Journal of Ocean U-niversity of China,2010,9(3):286-290.
[36] L'Ab e-Lund,J H,Jensen A J.Otoliths as natural tags in the systematics of salmonids[J].Environmental Biology of Fishes,1993,36:389-393.
[37] Post A,Hecht T.Results of the research cruises of the F.R.V."Walther Herwig"to South America XLIX[J].Mitteilungen aus dem Hamburgischen Zoologischen Museum und Institut,1977,74:165-170.
[38] Lombarte A,Rucabado J,Matallanas J,et al.Taxonomía numé rica de Nototheniidae en base a la forma de los otolitos[J].Science Marine,1991,55:413-418.
The Study on Using Otolith Morphology to Identify Three Nemipterus Fish Species:Nemipterus virgatus,N.bathybius and N.japonicus in Beibu Gulf
HOU Gang1,2,FENG Bo1,2,YAN Yun-Rong1,2,LU Huo-Sheng1,2,WU Ren-Xie1,2
(Guangdong Ocean University,1.College of Fisheries;2.Center of Fisheries Resources Monitoring and Assessment,South China Sea,Zhanjiang 524025,China)
The variability in sagittal otolith contour shape among three sympatric species of the genus Nemipterus:Golden threadfin bream N.virgatus(Houttuyn,1782)(n=54),Yellowbelly threadfin bream N.bathybius(Snyder,1911)(n=71)and Japanese threadfin bream N.japonicus(Bloch,1791)(n=65)from the Beibu Gulf were investigated,using the specimens collected from gillnet caught in Beibu Gulf central and open waters from January to September in 2010.Otolith contours were extracted and digitized by image processing,converted the gray scale image to a binary image,removed the noises,and described by elliptic Fourier descriptors(EFDs).The 77 EFD coefficients were then identified using principal component analysis(PCA)and gradual discrimination analysis(GDA)to differentiate the otoliths of three Nemipterus species.The result indicated that,length effects were significant between immature and mature individuals for N.japonicus(P<0.05)on otolith shape,while not significant for N.virgatus and N.bathybius(P>0.05).Thus only mature individuals of N.japonicus were used to analysis,while all individuals of N.virgatus and N.bathybius were used.The result showed that the 1st,2ndand 3rdcomponents accounted for 65.1%,15.3%and 5.3%of the total variation respectively.The GDA of EFD coefficients indicated that the average exactitude distinguish ratio of three species was 98.6%,and the cross validation also got the high ratio 97.9%.It indicates that the otolith elliptic Fourier shape analysis can be provided as a tool in distinguishing Nemipterus species.
N.virgatus;N.bathybius;N.japonicus;elliptic Fourier analysis;species identification
S931.5
A
1672-5174(2012)03-027-09
国家自然科学基金项目(30771653;41006084);广东省自然科学基金项目(10152408801000013);农业部北部湾专项调查项目(2010);
广东海洋大学引进人才科研启动费(1012380)资助
2011-03-25;
2011-05-17
侯 刚(1982-),男,讲师,硕士,主要从事渔业资源学与渔场学等方面的教学与研究工作。E-mail:houg@gdou.edu.cn
**通讯作者:E-mail:luhs@gdou.edu.cn
责任编辑 王 莉

