硫唑嘌呤在胰腺癌动物模型制作中的应用*
吴介恒,卢兴兵,李荣妍,吕智慧,黄莎圆子,刘梦娜,郭素红
(吉林医药学院检验学院,吉林吉林 132013)
胰腺癌是一种恶性程度很高且以早期转移为突出特征的肿瘤,其发病率在近年呈逐年上升趋势。临床上尚无经济、有效的早期发现方法[1-2]。 而造模是研究胰腺癌的基础,因此建立合适的人胰腺癌动物模型对胰腺癌的治疗研究起着十分重要的作用[3]。但目前仍没有一种完全可行的胰腺癌动物模型的制作方法。本文通过对SD雄性大鼠每天灌服硫唑嘌呤(AZA),皮下移植胰腺癌细胞的方法,来寻找最适合成瘤的AZA浓度,从而建立一种成瘤率高、操作简单方便的胰腺癌造模方法。
1 材料与方法
1.1材料 (1)实验动物及细胞株:清洁级,雄性SD大鼠40只,体质量 180~200 g,购自吉林大学动物实验中心;Mia PACAⅡ胰腺癌细胞株由吉林医药学院检验学院馈赠。(2)实验用品:DMEM低糖培养基、0.25%胰酶-EDTA购自Gibco公司;新生胎牛血清购自杭州四季青公司;大鼠CA24-2 ELISA 96T试剂盒购自美国R&D公司;一次性真空采血管(EDTA-K2抗凝)购自湖南浏阳三力集团;CO2培养箱、倒置显微镜、血细胞计数板、微量天平由吉林医药学院检验学院提供。(3)AZA:购自上海医药(集团)有限公司。
1.2方法
1.2.1细胞培养 将刚复苏的Mia PACAⅡ胰腺癌细胞接种在含10%胎牛血清、100 U/mL青霉素及0.1 mg/mL链霉素的DMEM低糖培养基中,培养于37 ℃、5%CO2培养箱中,平均每3~4 d传代1次处于对数生长期Mia PACAⅡ细胞见封2图1。
1.2.2动物实验分组 采用完全随机化设计的原则,按照AZA的浓度梯度对所购买的40只SD大鼠进行分组:空白对照组(A组)、2.6 mg/kg AZA组(B组)、2.2 mg/kg AZA组(C组)、1.8 mg/kg AZA组(D组)、1.4 mg/kg AZA组(E组),每组8只。A组每天灌服2 mL生理盐水,B、C、D、E组每天灌服相应浓度的AZA生理盐水液2 mL。
1.2.3移植实验 在大鼠灌胃30 d后 ,将处于对数生长期的Mia PACAⅡ细胞,用0.25%胰酶-EDTA消化,用非完全培养基制成细胞悬液,用血细胞计数板对细胞进行计数,制成细胞密度为3×105个/0.2 mL的细胞悬液,用乙醚麻醉大鼠后,于大鼠右侧腋窝处,皮下移植0.2 mL Mia PACAⅡ细胞悬液。
1.2.4指标检测 在移植后第15、 20、 25、30天采集大鼠血浆进行CA24-2检测,CA24-2检测采用由美国R&D公司生产的生物素-亲和素酶联免疫吸附试验(BSA-ELISA)中直接BA法进行检测,然后用DNM-9602型酶标仪,在450 nm波长处检测各孔光密度(OD)值,通过标准曲线进行换算。
1.2.5大鼠状态观察 移植细胞后,每天对SD大鼠饮食和活动状态进行观察。
1.2.6病理检查 在移植后的第30天断颈处死大鼠,取出其胰腺组织和腋窝下淋巴结,置于4%多聚甲醛中固定,然后用HE染色并制成石蜡切片,在显微镜下观察。
2 结 果
2.1大鼠一般状况观察 在移植Mia PACAⅡ细胞细胞悬液后,各组大鼠的活动减少、进食减少,质量减轻;在移植细胞后的第15天,大鼠质量、进食、活动进一步下降,在给药的第30天,B、C、D、E组各有2只SD大鼠死亡。
2.2CA24-2检测 通过对各组大鼠体内CA24-2检测发现,B、C、D、E组均为阳性结果,在移植后的第15、20、25、30天B组大鼠体内CA24-2水平分别为(51.56±2.14)、(51.61±1.21)、(54.66±1.02)、(56.00±0.38)U/mL,与C、D、E组相对应的移植时间比较,差异有统计学意义(P<0.05);B、C、D、E组在移植后第15、20、25、30天大鼠体内CA24-2的含量与A组(3.35±0.38)U/mL比较,差异有统计学意义(P<0.05);随着移植时间的增加,B、C、D组大鼠体内CA24-2水平差异有统计学意义(P<0.05);E组在移植后第15、20、25、30天时,大鼠体内CA24-2的水平差异无统计学意义(P>0.05),见表1。
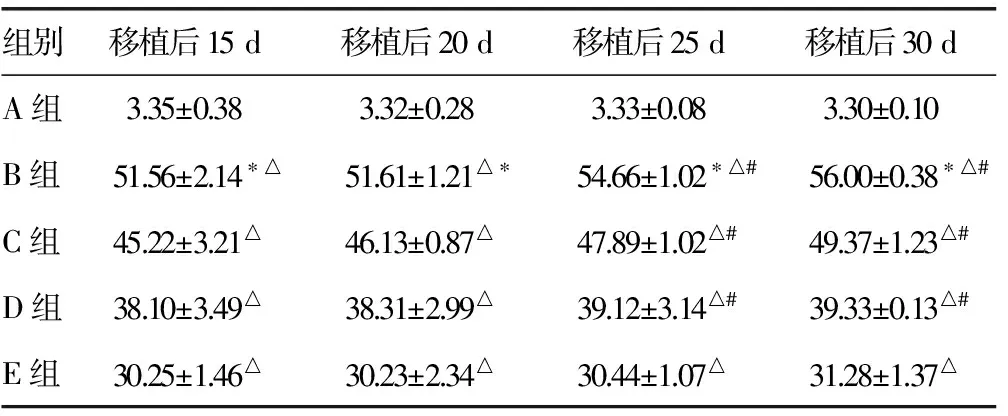
表1 各组大鼠血浆中CA24-2水平比较(U/mL)
2.3病理学检查 在高倍视野下观察发现,胰腺组织的正常结构消失,被纤维组织替代,肿瘤细胞呈弥漫状分布,肿瘤细胞排列均匀。在油镜下观察发现,细胞形态大小不等且畸形,细胞核大,核深染,可见1~2个核仁及双核(封2图2~6)。其中,B组有5只、C组有3只、D组有2只、E组有1只大鼠有上述改变,A组无任何异常变化,见封2图7。
2.4各组大鼠成瘤率比较 B组成瘤率为83.3%(5/6), 3只出现腋窝下单个淋巴结和胰腺周围淋巴结转移;C组成瘤率为50.0%(3/6);D组成瘤率为33.3%(2/6); E组成瘤率为16.7%(1/6)。
3 讨 论
肿瘤动物模型是研究肿瘤的前提,理想的肿瘤动物模型应该包含以下内容:(1)致癌的方法简单易行;(2)经济快速;(3)指标客观明确;(4)对癌变器官的特异性高;(5)重复性好;(6)诱发肿瘤的病理类型、生物学行为、电镜下表现及组织化学改变与人体肿瘤相似[4]。从 20世纪 70年代用化学方法诱导制作出胰腺癌动物模型以来,经过数十年的发展,各国学者又设计出了多种制作胰腺癌动物模型的方法,包括手术方法、同位移植、异位移植和基因工程等方法[5]。但目前这些造模方法都存在一定的缺点,手术造模的方法,大鼠成瘤周期长、成瘤率低,且在手术操作和麻醉中均会造成大鼠不必要的死亡。Clapper等[6]利用叙利亚仓鼠腹腔内注入致癌剂,但同时伴发了胃癌和肝癌。因此,化学物质诱导的方法造出的胰腺癌模型,其特异性不高。此外,目前移植造模大多采用裸鼠,但由于裸鼠饲养条件要求高,同时造模实验成本较高,故难以得到普遍利用[6]。由于皮下移植瘤模型具有操作简单,成瘤时间短,肿瘤生长速度快等特点[7],同时,AZA为免疫抑制剂,能抑制体内T淋巴细胞和B淋巴细胞的生物学功能,对大鼠成瘤有一定的促进作用[8]。因此,本实验采用对大鼠每天灌服AZA和皮下移植胰腺癌细胞的方法进行大鼠胰腺癌模型的制作。
目前,临床上常用于诊断胰腺癌的肿瘤标记物指标有:CA24-2、CA19-9,但随着CA19-9检测的广泛开展,发现其特异性正在下降,一些非胰腺癌性疾病也存在CA19-9显著升高,常致临床诊断的误导[9]。CA24-2是一种糖类抗原[10],在胃肠及胰腺广泛存在,它可补充CA19-9的不足[9],CA24-2在胰腺癌预后判断中比CA19-9可能更具价值[11]。此外,病理切片是诊断疾病的主要手段之一[12]。因此,本实验采用对大鼠体内CA24-2水平检测和胰腺组织病理切片的观察来判断SD大鼠是否成瘤。通过计算各组SD大鼠胰腺癌成瘤率,成功筛选出最适合大鼠成瘤的AZA浓度。当AZA浓度为2.6 mg/kg时,成瘤率最高,为83.3%。
另外,实验中可能会出现一些干扰因素,而影响SD大鼠成瘤,本研究认为:(1)应尽量选用雄性大鼠, 因为雌鼠体内存在雌激素,雌激素具有免疫增强的作用[13]。(2)Mia PACAⅡ细胞在传代过程中,用胰蛋白酶消化的时间不宜过长,否则将影响移植的成功率。(3)应该选择状态好,处于对数生长期的细胞用于移植[14],同时,在培养中应避免污染的发生[15]。(4)移植的部位最好选择在前肢皮下,这样可以避免其他大鼠碰触移植部位。
综上所述,本实验采用灌服免疫抑制剂和皮下接种细胞悬液的方法构建大鼠胰腺癌动物模型。该种方法具有操作简便、成瘤时间短、成瘤率高、实验成本低等优点,
是较为理想和实用的胰腺癌动物模型,该造模方法为后续进行胰腺癌发病机制及治疗研究等实验提供了良好的平台。
[1]卫金歧,边壮,叶丽华,等.胰腺癌高危评分模型在胰腺癌诊断方面的临床应用价值[J].中国综合临床,2010,26(4):366-368.
[2]石卫东.人胰腺癌 SW1990细胞高肝转移细胞系的建立及中药干预研究[D].上海:复旦大学,2007.
[3]吴介恒,刘梦娜,黄莎圆子,等.胰腺癌动物模型制作方法的研究进展[J].吉林医药学院学报,2011,32(2):115-117.
[4]吴细丕,钱林法.实验动物与肿瘤研究[M].北京:中国医药出版社,2000:190-199.
[5]吴深保,周国雄,黄介飞.实验性胰腺癌动物模型研究进展[J].胰腺病学,2005,5(3):187-189.
[6]Clapper ML,Wood M,Leahy K,et al.Chemopreventive activity of oltipraz against N-nitrosob is(2-oxopropy l) amine(BOP)-induced ductal pancreatic carcinoma development and effects on survival of Syrian golden hamsters[J].Carcinogenesis,1995,16(9):2159-2165.
[7]Hashitani S,Urade M,Zushi Y,et al.Establishment of nude mouse transplantable model of a human adenoid cystic carcinoma of the oral floor showing metastasis to the lymph node and lung[J].Oncol Rep,2007,17(1):67-72.
[8]张朝阳,张曙光,于振海,等.大鼠胰腺癌模型制备的实验研究[J].中国现代普通外科进展,2005,8(2):102-103.
[9]王平,李玉明.血清CA19-9、CA24-2、CEA联合检测在胰癌诊断中的价值[J].南通医学院学报,1997,17(4):488-489.
[10]夏吉荣,黄天禄,马志如,等.血清CA242测定的临床应用评价[J].中国肿瘤临床,1997,24(1):40-42.
[11]蒋晓婷.血清肿瘤标志物联合检测在胰腺癌诊治中的意义[J].中国实验诊断学,2002,6(5):342-344.
[12]张中海.病理切片制作过程中常见问题及原因探析[J].吉林医学,2011,32(27):5761.
[13]袁文丹,刘巍,崔勇,等.17β-雌二醇对大鼠腹腔巨噬细胞免疫活性影响[J].大众科学:济宁医学院学报,2007,30(4):296-298.
[14]谭玉珍.实用细胞培养技术[M].北京:高等教育出版社,2010:39.
[15]吴介恒,刘梦娜,黄莎圆子,等.细胞培养中霉菌感染应对措施[J].吉林医药学院学报,2011,32(1):30.

