肺表面活性物质相关蛋白D研究进展
何 建 综述,戴晓天审校
(第三军医大学西南医院呼吸科,重庆 400038)
肺表面活性物质(pulmonary surfactant,PS)是由肺泡Ⅱ型上皮细胞和克拉拉(clara)细胞合成、分泌的脂质和蛋白质的复合物,其中大约90%是磷脂,10%是与脂质结合的蛋白质,即肺表面活性物质相关蛋白(pulmonary surfactant-associated protein,SP)。目前已发现的SP有4 种,根据发现的顺序命名为SP-A、SP-B、SP-C和SP-D;根据生物化学特性分为小分子疏水性蛋白(SP-B和SP-C) 和大分子亲水性蛋白(SP-A和SP-D)。SP-B和SP-C主要发挥维持PS的结构和降低肺泡表面张力的功能。SP-A和SP-D一起共同发挥免疫防御和免疫调节功能,它们的结构和功能相似,但也存在一定差异。SP-D是近年来的研究热点,特别是SP-D与某些疾病的联系。本文主要对SP-D的结构、功能、与疾病联系的研究进展进行综述。
1 SP-D的分子结构
SP-D和SP-A都属于C型凝素家族成员,基因都位于10q22~23,它们具有高度的进化保守性,在不同种类的脊椎动物中有交叉反应性。SP-D和SP-A的分子结构相似,一级结构(图1)分为4部分,从N端到C端依次为:氨基端区(N端区)、胶原样区(CLR区)、颈区和糖识别域(CRD)[1]。N端区含半胱氨酸,连接亚单位中各肽链;CLR区缠绕形成三联螺旋体结构;颈区参与蛋白质的折叠;CRD上有钙离子依赖识别位点,在钙离子参与下识别结合病原体表面的碳水化合物的羟基。SP-D的三级结构(图1A)是由3条相同肽链组成的三聚体,四级结构(图1B)一般由4个三聚体构成十二聚体,排列成“十字”形[1]。SP-A四级结构一般由6个三聚体构成十八聚体,排列成花瓣样。SP-D和SP-A都是通过C-型CRD和病原微生物表面的碳水化合物的羟基相结合,由于SP-A和SP-D的C-型CRD空间距离不同,扩大了PS对病原体的识别范围。
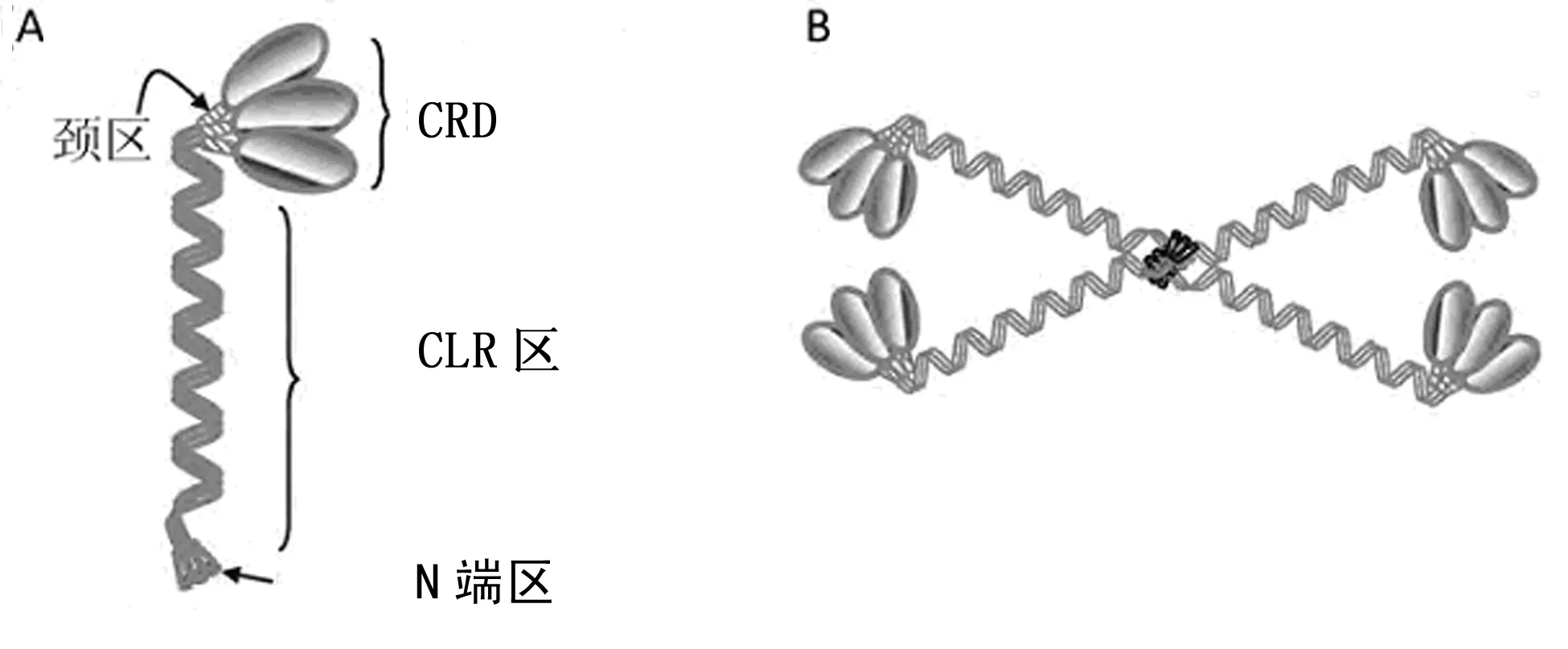
A:SP-D的三级结构;B:SP-D的四级结构。
2 SP-D的双重免疫功能
SP-D和SP-A都具有双重免疫调节功能,既可以促进炎症反应,有助于病原体等的清除,也可以抑制炎症反应,以维持肺泡内环境的稳定,这与它们的分子结构密不可分。Gardai等[2]首先提出 SP-D和SP-A的双重免疫功能的调控主要是靠头端与信号抑制肽(signal inhibitory regulatory protein-α,SIRP-α)结合,或尾端与钙网质蛋白/CD91 结合,而决定最终是否走促进或抑制炎症反应的路径。在正常状况下,SP-D以十二聚体形式存在,胶原尾隐藏在寡聚体的核心,SP-D的CRD和免疫细胞表面上的 SIRP-α结合,进而活化磷酸酶-1、 磷酸酶-2等,抑制与P38和NF-κB相关的信号转导,阻止炎症反应的发生[3-4]。相反,在感染等炎症状态下,SP-D的CRD和病原体结合;SP-D尾端的半胱氨酸残基在氧化损伤的作用下被亚硝基化;SP-D解聚,以三聚体形式存在;胶原尾暴露,和吞噬细胞表面的钙网质蛋白/CD91复合体结合,活化P38和NF-κB信号分子;从而促进炎症反应[5-6]。
2.1清除病原体 SP-D通过CRD可以结合多种病原体表面的糖基,如绿脓杆菌[7]、肺炎克雷伯菌[8]、流感嗜血杆菌、新型隐球菌、卡氏肺孢子虫、烟曲霉等,然后通过CLR区和吞噬细胞表面的受体(钙网质蛋白/CD91复合体)结合,调理吞噬作用。SP-D的这种结合作用与SP-D的寡聚化程度和CLR区的结构也是有关的。CD14和TOLL样受体(TLR)是吞噬细胞表面重要的模式识别分子,SP-D的CRD区还可以和CD14、TLR-2、TLR-4结合,促进吞噬细胞清除病原体,但这种结合机制有别于和糖基的结合[9]。另外,SP-D还可以通过调节模式识别受体的表达、刺激炎症因子的产生、诱导趋化、影响细胞信号转导等途径,促进病原体的清除。SP-D和SP-A的糖结合专一性不相同,例如,脂多糖由脂质A、核心多糖、O特异性链三部分组成,SP-D主要结合核心多糖,而SP-A主要结合脂质A。SP-D和SP-A都能结合烟曲霉的糖基,SP-D的结合被麦芽糖抑制,而SP-A的结合被甘露糖抑制[10]。
2.2结合变应原、抑制过敏反应 除了真菌,SP-D的CRD可以结合其他多种过敏原,如花粉、尘螨等,促进过敏原的清除。 Malherbe等[11]研究发现SP-D可以抑制IgE和花粉结合,抑制肥大细胞脱颗粒、释放组胺。Liu等[12]研究也发现SP-D可以有效抑制过敏原致敏小鼠的嗜酸细胞炎症,减少特异性IgE的产生。
2.3清除凋亡细胞 SP-D可以和细胞碎片、裂解细胞以及凋亡细胞的核酸结合,然后和吞噬细胞表面的受体(CD91/钙网质蛋白)结合,促进它们的清除。但不确定的是SP-D的什么部位和核酸相结合,Palaniyar等[13]认为是通过CLR区,但也有研究者认为是通过CRD或其他区域。Litvack等[14]研究发现,SP-D和IgM一起在迟发性凋亡细胞的清除上发挥重要作用。
2.4调节免疫细胞的功能 SP-D对非特异性和特异性免疫细胞的功能都有调节作用。和正常小鼠比,SP-D-/-小鼠,非特异性和特异性免疫细胞的形态都会发生改变,同时会释放更多的细胞因子、趋化因子和氧化剂,发生过度的炎症反应,但防御病原体的能力减弱[15]。(1)SP-D对单核-吞噬细胞的作用:SP-D是单核-吞噬细胞的趋化因子。SP-D还调节单核-吞噬细胞释放某些细胞因子和氧自由基。Takeda等[16]的体外研究发现,SP-D促进肺泡巨噬细胞(卵清蛋白致敏的C57BL/6 小鼠)产生细胞因子IL-10、IL-12和IFN-γ,抑制Th2型细胞因子的产生。Haczku[17]体外研究也发现,SP-D可以直接抑制烟曲霉致敏的脾单核细胞释放Th2型细胞因子。Liu等[18]体外研究发现,SP-D可以抑制过敏原或脂多糖刺激后的肺泡巨噬细胞释放NO。(2) SP-D 对树突状细胞的作用:树突状细胞是机体功能最强的专职抗原提呈细胞。Hortobagyi等[19]研究发现,SP-D-/-小鼠骨髓树突状细胞为髓系表型,分泌促炎细胞因子,表达TNF-α,而在骨髓树突状细胞培养基中加入SP-D则可抑制其活化和TNF-α的表达,这表明SP-D可以抑制前炎症树突状细胞的成熟和活化。SP-D可以增强树突状细胞的抗原提呈功能。另外,SP-D与树突状细胞的迁移相关。在病原体入侵的情况下,树突状细胞活化迁移到区域淋巴结,发挥抗原提呈功能,以减轻肺部炎症反应,有研究发现,在SP-D-/-小鼠,树突状细胞不能迁移到区域淋巴结,而是在气道黏膜下异常聚集[20]。(3)SP-D对T淋巴细胞的作用:和外周血淋巴细胞相比,肺淋巴细胞对许多过敏原刺激反应低下,这可能是因为SP-D可以抑制T淋巴细胞的增生和活化[21]。Fisher等[22]研究发现,在SP-D-/-小鼠肺泡灌洗液中CD4和CD8阳性的T细胞均增加,同时活化标记CD69和CD25的表达增加。
3 SP-D与疾病的联系
由于SP-D在清除病原体和免疫调节方面发挥重要作用,因此不难理解,如果SP-D缺乏或减少,机体就很容易受到病原体的感染、产生更严重的炎症反应。Kongchanagul 等[23]研究发现SP-D减少可能是H5N1禽流感感染致死的一个重要因素。(1)SP-D与慢性阻塞性肺疾病的发病相关。有研究表明,SP-D缺乏,容易导致肺气肿的发生。在吸烟人群中,SP-D的水平是下降的,在慢性阻塞性肺疾病患者中,SP-D的水平和肺功能具有正相关性[24]。(2)SP-D和SP-A都具有双重免疫功能。但研究发现,在基础状况下,SP-A-/-小鼠未出现明显异常,而SP-D-/-小鼠出现明显的免疫系统活化,这提示在维持免疫平衡方面,SP-D比SP-A更重要,SP-D可能和某些免疫疾病相关。(3)SP-D减少可能是类风湿关节炎的一个发病因素。Christensen等[25]研究发现,早期未治疗的类风湿关节炎患者血浆SP-D较健康人明显减少,并且血浆SP-D水平和类风湿关节炎的严重程度具有负相关性。该研究还发现,类风湿关节炎关节液中SP-D只以三聚体的形式存在。(4)SP-D升高可能是特发性肺间质纤维化患者预后的一个独立危险因素。Barlo等[26]通过测量72例特发性肺间质纤维化患者和305例健康志愿者的血浆SP-D值,发现患者的血浆SP-D值较健康志愿者明显升高,并且患者血浆SP-D值的水平和预后具有明显相关性,大于460 ng/mL的中位生存期为13个月,而小于460 ng/mL的中位生存期为67个月。(5)SP-D可以作为心血管疾病的观测指标。Hill等[27]研究发现,SP-D的高低,与心血管疾病的发病率和病死率相关。
综上所述,SP-D具有双重免疫功能,一方面通过调理吞噬,促进吞噬细胞清除病原微生物;另一方面通过抑制细胞因子、氧化自由基等炎性介质的释放,抑制淋巴细胞增生和树突状细胞的成熟、活化,避免过度炎症反应,维持机体的免疫平衡。由于SP-D具有双重免疫功能,因此和其他药物相比,它在治疗感染性疾病或免疫疾病中具有天然的优势。SP-D还可以作为类风湿关节炎、特发性肺间质纤维化等免疫疾病,以及心力衰竭等心血管疾病的观察指标。SP-D的双重免疫功能是如何调节的,SP-D和免疫疾病发病机制的联系,以及SP-D对感染性疾病和免疫疾病的潜在治疗作用有待更广泛的研究。
[1]Orgeig S,Hiemstra PS,Veldhuizen EJ,et al.Recent advances in alveolar biology:evolution and function of alveolar proteins[J].Respir Physiol Neurobiol,2010,173 Suppl:S43-54.
[2]Gardai SJ,Xiao YQ,Dickinson M,et al.By binding SIRPalpha or calreticulin/CD91,lung collectins act as dual function surveillance molecules to suppress or enhance inflammation[J].Cell,2003,115(1):13-23.
[3]Matozaki T,Murata Y,Okazawa H,et al.Functions and molecular mechanisms of the CD47-SIRPalpha signalling pathway[J].Trends Cell Biol,2009,19(2):72-80.
[4]Janssen WJ,McPhillips KA,Dickinson MG,et al.Surfactant proteins A and D suppress alveolar macrophage phagocytosis via interaction with SIRP alpha[J].Am J Respir Crit Care Med,2008,178(2):158-167.
[5]Guo CJ,Atochina-Vasserman EN,Abramova E,et al.S-nitrosylation of surfactant protein-D controls inflammatory function[J].PLoS boil,2008,6(11):e266.
[6]Matalon S,Shrestha K,Kirk M,et al.Modification of surfactant protein D by reactive oxygen-nitrogen intermediates is accompanied by loss of aggregating activity,in vitro and in vivo[J].Faseb J,2009,23(5):1415-1430.
[7]Restrepo CI,Dong Q,Savov J,et al.Surfactant protein D stimulates phagocytosis of Pseudomonas aeruginosa by alveolar macrophages[J].Am J Respir Cell Mol Biol,1999,21(5):576-585.
[8]Sahly H,Ofek I,Podschun R,et al.Surfactant protein D binds selectively to Klebsiella pneumoniae lipopolysaccharides containing mannose-rich O-antigens[J].J Immunol,2002,169(6):3267-3274.
[9]Ohya M,Nishitani C,Sano H,et al.Human pulmonary surfactant protein D binds the extracellular domains of toll-like receptors 2 and 4 through the carbohydrate recognition domain by a mechanism different from its binding to phosphatidylinositol and lipopolysaccharide[J].Biochem,2006,45(28):8657-8664.
[10]Madan T,Eggleton P,Kishore U,et al.Binding of pulmonary surfactant proteins A and D to Aspergillus fumigatus conidia enhances phagocytosis and killing by human neutrophils and alveolar macrophages[J].Infect Immun,1997,65(8):3171-3179.
[11]Malherbe DC,Erpenbeck VJ,Abraham SN,et al.Surfactant protein D decreases pollen-induced IgE-dependent mast cell degranulation[J].Am J Physiol Lung Cell Mol Physiol,2005,289(5):L856-866.
[12]Liu CF,Chen YL,Shieh CC,et al.Therapeutic effect of surfactant protein D in allergic inflammation of mite-sensitized mice[J].Clin Exp Allergy,2005,35(4):515-521.
[13]Palaniyar N,Clark H,Nadesalingam J,et al.Surfactant protein D binds genomic DNA and apoptotic cells,and enhances their clearance,in vivo[J].Ann NY Acad Sci,2003(1010):471-475.
[14]Litvack ML,Djiadeu P,Renganathan SD,et al.Natural IgM and innate immune collectin SP-D bind to late apoptotic cells and enhance their clearance by alveolar macrophages in vivo[J].Mol Immunol,2010,48(1/3):37-47.
[15]Atochina EN,Gow AJ,Beck JM,et al.Delayed clearance of pneumocystis carinii infection,increased inflammation,and altered nitric oxide metabolism in lungs of surfactant protein-D knockout mice[J].J Infect Dis,2004,189(8):1528-1539.
[16]Takeda K,Miyahara N,Rha YH,et al.Surfactant protein D regulates airway function and allergic inflammation through modulation of macrophage function[J].Am J Respir Crit Care Med,2003,168(7):783-789.
[17]Haczku A.Role and regulation of lung collectins in allergic airway sensitization[J].Pharmacol Ther,2006,110(1):14-34.
[18]Liu CF,Chen YL,Shieh CC,et al.Therapeutic effect of surfactant protein D in allergic inflammation of mite-sensitized mice[J].Clin Exp Allergy,2005,35(4):515-521.
[19]Hortobagyi L,Kierstein S,Krytska K,et al.Surfactant protein D inhibits TNF-alpha production by macrophages and dendritic cells in mice[J].J Allergy Clin Immunol,2008,122(3):521-528.
[20]Haczku A,Cao Y,Vass G,et al.IL-4 and IL-13 form a negative feedback circuit with surfactant protein-D in the allergic airway response[J].Allergy Clin Immunol,2006,176(6):3557-3565.
[21]Haczku A.Protective role of the lung collectins surfactant protein A and surfactant protein D in airway inflammation[J].Allergy Clin Immunol,2008,122(5):861-879.
[22]Fisher JH,Larson J,Cool C,et al.Lymphocyte activation in the lungs of SP-D null mice[J].Am J Respir Cell Mol Biol,2002,27(1):24-33.
[23]Kongchanagul A,Suptawiwat O,Boonarkart C,et al.Decreased Expression of Surfactant Protein D mRNA in Human Lungs in Fatal Cases of H5N1 Avian Influenza[J].J Med Virol,2011,83(8):1410-1417.
[24]Moré JM,Voelker DR,Silveira LJ,et al.Smoking reduces surfactant protein D and phospholipids in patients with and without chronic obstructive pulmonary disease[J].Pulm Med,2010(10):53-60.
[25]Christensen AF,Sørensen GL,Hørslev-Petersen K,et al.Circulating surfactant protein-D is low and correlates negatively with systemic inflammation in early,untreated rheumatoid arthritis[J].Arthritis Res Ther,2010,12(2):R39.
[26]Barlo NP,van Moorsel CH,Ruven HJ,et al.Surfactant protein-D predicts survival in patients with idiopathic pulmonary fibrosis[J].Sarcoidosis Vasc Diffuse Lung Dis,2009,26(2):155-161.
[27]Hill J,Heslop C,Man SF,et al.Circulating surfactant protein-D and the risk of cardiovascular morbidity and mortality[J].Eur Heart J,2011,32(15):1918-1925.

