弥散性血管内凝血新生儿凝血与纤溶的改变及临床意义
甘 明,刘剑荣,廖永强,覃广萍(江西省萍乡市人民医院:.检验科;.新生儿科 337055)
弥散性血管内凝血(disseminated intravas-cular coagulation,DIC)是在某些致病因素的作用下,全身小血管内广泛的微血栓形成以及继发性纤溶受抑的一种以凝血-抗凝血和纤溶-抗纤溶失衡为病理特征的临床血栓-出血综合征[1];通常是指已出现出血和(或)多个器官功能障碍的继发性纤溶期[2],也是危重新生儿危重急症之一,它具有病情重、变化迅速、预后凶险、病死率高等特征。因此,简单、快速和准确的实验诊断方法对于DIC新生儿患者早期治疗、阻止病情进展、提高治愈率、降低病死率至关重要。本文对DIC新生儿患者血浆D-二聚体(D-D)、纤维蛋白(原)降解产物(FDP)以及凝血酶原时间(PT)、活化部分凝血活酶时间(APTT)、凝血酶时间(TT)、纤维蛋白原(FIB)的检测在发病过程中变化进行分析,并探讨其在DIC新生儿实验诊断方面的临床价值。
1 资料与方法
1.1 一般资料 选取本院2008年5月至2011年8月新生儿科患者20例为DIC组,25例患者为DIC可疑组,其中本院妇产科转入的新生儿科患者34例,新入院或其他医院转入的患者11例,年龄为0~28 d,平均年龄16.4 d。所有病例均符合第七届全国血栓与止血会议制定的诊断标准[3]。选取本院妇产科同期出生的足月健康新生儿20例为健康对照组,出生后一般情况佳,无各系统疾病。
1.2 主要试剂和仪器 (1)试剂:PT、APTT、TT、FIB的试剂均购于武汉中太生物技术有限公司;血浆D-D试剂盒购于上海长岛生物技术有限公司;FDP试剂盒购自Diagnostic STAGO公司。(2)仪器:法国Diagnostic Stago STA Compact全自动血凝仪。
1.3 方法 (1)标本采集:以枸橼酸钠(109mmol/L)与静脉血1∶9抗凝,3 000 r/min离心10min,取上层血浆待测。于2 h内全部测定完毕。(2)检测方法:用凝固法检测PT、APTT、TT,用凝血酶法(Glauss法)检测FIB;乳胶增强免疫透射比浊法检测血浆D-D;乳胶凝集半定量实验检测FDP;血小板(PLT)计数按常规方法。所有实验步骤严格按试剂盒和仪器说明书操作。
2 结 果
DIC组与早期可疑DIC组和健康对照组比较差异均有统计学意义(P<0.05),各指标检查结果及阳性率见表1、2。
表1 各组凝血及纤溶指标含量比较()

表1 各组凝血及纤溶指标含量比较()
注:与健康对照组比较或早期可疑DIC组比较,a P<0.05;与健康对照组比较,b P<0.05。
组别 n APTT(s) PT(s) TT(s) FIB(g/L) D-D(mg/L) FDP(mg/L)DIC组 20 60.3±17.8a 19.2±8.9a 25.2±8.3a 1.07±0.87a 3.53±0.42a 25.6±5.2a早期可疑DIC组 25 46.2±11.6b 15.7±2.8b 23.4±5.3b 1.52±0.93b 1.25±0.83b 17.2±11.2b健康对照组 20 35.5±5.5 12.5±3.5 17.8±3.5 2.54±1.46 0.38±0.24 6.3±1.6
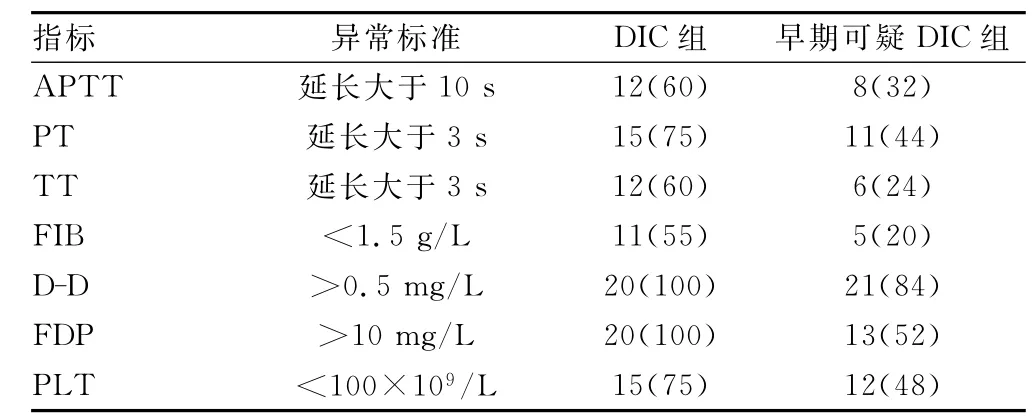
表2 各组凝血及纤溶指标阳性率比较[n(%)]
3 讨 论
DIC的主要特征是在某些致病因素作用下,血液凝固机制被激活,毛细血管或小动、静脉内形成广泛的微血栓。由于凝血过程加速,消耗了大量的凝血因子和血小板,并激活纤维蛋白溶解系统,引起继发性纤维蛋白溶解亢进,从而导致广泛性出血、循环障碍、栓塞和溶血等一系列临床表现。
新生儿DIC绝大多数为急性、全身性,且多为严重型。一般可分为3期,(1)高凝期:大量凝血因子依次激活,血管内可反复有微血栓形成。此期持续时间短暂,无出血表现,不易发现,也可因血液呈高凝状态而抽血时血液易凝固或拔针后不出血而发现。(2)低凝期:血中凝血因子不断消耗,又缺乏合成和补充,以致血液转入低凝状态,血液不易凝固而致消化道等器官出血或穿刺注射部位出血不止。(3)继发纤溶亢进期:体内凝血与抗凝血间的平衡严重紊乱,FIB大量消耗,纤溶活性增强,微血栓重新溶解,在坏死组织基础上发生广泛、严重、持续地出血。临床上这三期经常交叉存在,不易截然分开。有时临床医生在患儿出现广泛的出血倾向时才考虑DIC,而此时已是低凝期。事实上,在抢救新生儿时如出现采血困难或一采血就凝固,就应该注意有无DIC的可能。新生儿因生理性纤溶活性不足,能典型进入继发纤溶亢进期相对不多,多在低凝期死亡。轻症有时诊断困难,重症可于1~2 d死亡。因此实验室检查是确诊新生儿DIC的重要依据,根据本实验结果显示PT、APTT、TT等在DIC新生儿患者中出现较高的阳性率,阳性率分别为75%、60%、60%。并且随着病情的好转而接近或恢复正常,但在早期或可疑DIC时其敏感性不高,阳性率分别只有44%、32%、24%。而FIB和PLT的阳性率分别为55%和75%,在早期或可疑DIC新生儿患者中只有20%和48%,但由于诸多因素影响FIB及PLT的降低,因此动态观察PLT的变化,对于早发现和及时诊断重症患者并发DIC具有较大的价值[4]。
通过本组数据观察在新生儿DIC的患者中阳性率均高达100%,在早期新生儿DIC的患者中阳性率分别为84%和52%。D-D的形成机制是在血液凝固过程中,纤维蛋白单体或中间聚合体在ⅩⅢ的作用下,形成交联蛋白,后者进一步受纤溶酶作用下发生降解,形成D-D[5]。故D-D与血液凝固、纤溶均有内在联系,是DIC早期特异性分子标志物,为凝血功能早期灵敏指标[6]。于1994年被列入我国DIC的诊断标准之一[7]。有研究者对临床疑诊DIC患者进行PLT、FIB、FDP和D-D测定,其中D-D最能正确反映体内凝血酶和纤溶酶活性,并指出当血浆D-D水平大于1.5 mg/L时,对DIC有较高的诊断价值。这方面的文献报道较多,如有研究者在列举DIC实验诊断中,将血浆D-D测定排在首位。在凝血和纤溶系统诸多实验中,当发生DIC时血浆D-D含量均表现增高;D-D实验敏感率为94%,特异性为80%,阳性预测率为100%;且其测定对DIC的病情观察、判断疗效及预后有一定的价值[8]。有研究者指出,当单项实验指标明显异常或诊断有疑难时可加做定量实验,如血浆D-D定量测定。本实验通过血浆D-D测定DIC新生儿组与健康对照组差异有统计学意义(P<0.05),其结果与大量文献报道一致。因此血浆D-D测定可以作为体内血栓形成的无创伤性检测指标之一。
FDP是反映血循环中纤维蛋白(原)在纤溶酶作用下所生成的 X(x)、Y(y)、D(d)、E(e)碎片的含量,它反映的是纤溶系统激活和FDP生成。DIC时FDP随着纤维蛋白溶解(继发纤溶)在血中浓度增加,所以测定FDP即可知道血栓的存在。FDP经过中间产物X组分、Y组分,最后降解生成D组分、E组分,而D组分和E组分也可因不同分解过程出现不同产物,也有来源于第Ⅷ因子架桥形成的稳定型纤维蛋白等分子结构的不同物质,一起测定这些组分,就能了解DIC时凝固系统和纤溶系统的活性状态[9]。FDP测定虽较敏感,但FDP作为纤维蛋白及纤维蛋白降解产物,对原发性及继发性纤溶无鉴别意义。与FDP相比,血浆D-D升高,反映了体内过多的血栓形成,排除了FIB降解产物的干扰,且随病情的加重升高而更加明显,因而突出了血浆D-D在早期确诊DIC时的临床意义。FDP由于操作繁杂,人为因素影响大,假阳性高,有研究表明虽敏感性高,但特异性低。反之,D-D虽敏感性低,但特异性高,并且D-D增高亦非DIC的特异性实验,在成人深静脉血栓、心肌梗死、肺栓塞及外科手术后等均可增高。此时可以联合PT、APTT、PLT、FDP等异常及基础疾病进行鉴别。FDP与D-D两者配合,可提高DIC诊断的特异度和敏感度[10]。
由于新生儿各种凝血因子生理性减低、纤溶作用生理性增强等特点,加上取血困难,新生儿DIC诊断有其特殊性[11]。由于新生儿纤溶活性的特点,通常不宜以一次的D-D检测结果作为依据。有报道危重新生儿死亡组血浆D-D较治愈组血浆D-D明显增强[12]。由于D-D阳性的结果常随新生儿日龄和病情变化而发生增减,需连续监测其变化,以免误诊或在紧急处理时矫正过旺,造成过度治疗。
国内学者研究结果提示,有宫内缺血、缺氧的高危新生儿,出生后更应严密监护血压、心功能和筛查DIC,这对及早发现心血管功能障碍并发DIC,防止微血栓栓塞器官组织至关重要。在对窒息足月新生儿、早产儿的止血状态进行比较时,研究发现,窒息早产儿的PLT、FIB均明显下降,血浆D-D有所升高。提示窒息早产儿更容易发生DIC,且倾向于DIC的低凝期。
综上所述,对DIC新生儿使用D-D等敏感性和特异性高的分子标志物以及APTT、PT、TT、FIB、PLT和FDP的检测对及早诊断新生儿DIC有其特殊的临床意义,并对其存在的止血状态进行早期干预,有望减轻DIC新生儿器官损伤,改善预后条件,提高DIC新生儿的治愈率,降低病死率。
[1]王岩,苏萍.新生儿弥散性血管内的早期诊断及治疗进展[J].中国新生儿科杂志,2009,24(4):247.
[2]Taylor FB,Toh CH,Hoots WK,et al.Towards definition,clinical and laboratory criteria,and a scoring system for disseminated intravascular coagulation[J].Thromb Haemost,2001,86(5):1327-1330.
[3]中华医学会血液分会血栓与止血组,第七届全国血栓与止血学术会议制定的四项诊断参考标准[J].中华血液学杂志,2000,21(3):165-168.
[4]Acka S,HajiMichael P,de Medonca A,et al.Time course of platelet counts in critically ill patients[J].Crit Care Med,2002,30(4):753-756.
[5]林列坤,关广雄,李惠芳,等.D-二聚体定量检测及在DIC诊断中的作用[J].实用医技杂志,2005,12(3):548-549.
[6]盛明华.危重新生儿血清D-二聚体的测定及超小剂量肝素的临床应用[J].小儿急救医学,2002,9(4):221.
[7]许秀华.产妇DIC中凝血与纤溶系统水平临床分析[J].中国临床实用医学,2010,4(4):14-15.
[8]毕道濯,赵建刚.窒息新生儿血浆D-二聚体变化的研究[J].天津医科大学学报,2006,12(1):49.
[9]贺石林.DIC的发病机制与诊治研究的进展[J].湖南医学,2000,17(5):349.
[10]胡波,王珂.血浆D-二聚体及FDP检测在DIC诊断中的意义[J].重庆医学,2004,33(11):1666-1668.
[11]邝文英,王豫黔,朱小瑜,等.早产儿D-二聚体和纤溶酶原的动态变化研究[J].中国新生儿科杂志,2006,21(3):136.
[12]叶中绿,王优,徐军发,等.窒息新生儿抗凝和纤溶的改变及临床意义[J].小儿急救医学,2004,11(3):156-158.