针对livin的siRNA表达载体的构建
刘敏丽,魏晓丽,张生军,崔轶霞,杜雨柔,韩振奎
(1.延安大学医学院病理学教研室;2.延安大学附属医院,陕西 延安 71600)
近年来对RNA干扰的研究表明,小干扰RNA(siRNA)能高效、特异的抑制特定基因的表达[1],人们利用其生物学机制可以快速便捷的抑制细胞中某些基因,从而分析该基因在细胞中的功能,成为基因功能研究的一种新方法[2]。基于以上理论,我们选取凋亡抑制蛋白家族的的新抑制因子livin基因[3],构建针对livin的表达载体,降低或沉默livin基因表达后是否有效地抑制胃癌细胞增殖,为胃癌的基因治疗提供新的实验依据。
1 材料与方法
1.1 材料与试剂
高效感受态DH5α细菌购自博大泰克公司。siRNA表达载体试剂盒pSilencerhygroTM购自Ambion公司,限制性内切酶、T4 DNA连接酶、DNA Marker等购于大连TaKaRa公司。QIAprep@Spin Miniprep Kit购自Promega公司。
1.2 siRNAs序列的设计与合成
依据Ambion公司推荐的设计导向,按照 gen-Bank报道的 livin mRNA序列(Livin’α为 BC 014475,Livin’β为 AF311388)用 Ambion公司的siRNA在线软件设计,输入livin基因的开放阅读框,得到19个粗筛位点。并根据siRNA设计原则挑选2条发卡状结构的siRNA序列模板,经BLAST检索确认与livin以外的人类已知基因序列无同源性。DNA寡核苷酸由siRNA19个核苷酸正义链连接9个核苷酸(TTCAAGAGA),及siRNA的反义链构成。将2条siRNA设计为相应的DNA单链,两端分别加上BamHⅠ和hindⅢ酶切位点,北京奥克公司合成。

图1 退火后发夹状siRNAFig.1 Annealed hairpin siRNA template insert
1.3 退火
根据SilencerTMExpress Kit说明书,将所合成的2对DNA单链用缓冲液溶解。0.4μl正义DNA链(1 μg/μl)0.4 μl反义 DNA 链(1 ug/μl),9.2 μl退火 Buffer 46μl。三者混匀,90℃30 min。37℃孵育10 min。其结构如图1所示:其中N为所筛选出的由19个核苷酸组成的靶序列或者其反义链。再缓慢降至30℃,维持30 min,缓降至4℃后,-20℃保存。
1.4 酶切、连接
对载体 pSilenceTM3.1 hygro进行 BamHⅠ 和hindⅢ双酶切,然后对酶切产物进行纯化回收。体系为DNA溶液中加入3 M的NaAc 1/9体积,充分混匀。加入两倍体积的冰乙醇,冰浴30 min;0℃以13000 r/min转速离心10 min,弃上清;沉淀DNA,加入1 ml 70%乙醇,再次同样条件离心2 min;吸上清,所剩固体为DNA,测定浓度。将退火后的siRNA片段与线性化的pSilencerTM3.1质粒表达载体连接。体系为1μl稀释退火片段Livin与1μl线性化质粒载体溶解在1μl 10×T4连接缓冲液中,加入1μl T4 DNA连接酶,6μl的无核酶三蒸水,4℃过夜。
1.5 转化、摇菌
用重组载体分别转化 E.coli DH5α感受态细胞。步骤为连接反应产物及载体试剂盒所提供的阴性对照质粒各2μl,混匀后置冰上30 min,42℃热休克30 s,立即置冰上2 min。加入450μl LB培养基,225 rpm 37℃振摇1 h,置于冰上;在含氨苄抗生素的LB培养板上涂布均匀,分别标为siRNA1,siRNA2,避光放置待菌液吸干后,倒置培养皿于37℃培养箱中培养12~16 h。挑取阳性克隆进行序列测定。
1.6 提取质粒
将正确插入siRNA的克隆大量扩增后,提取质粒。于无菌试管中加入2 ml LB培养基,分别吸取2 μl plivin-siRNA 阴性对照、plivin-siRNA1、plivin-siRNA2菌液加入对应的LB培养基中,37℃振荡培养过夜;将菌液转入1.5 ml Ep管中,标记;4000 r/min离心3 min,弃上清。Ep管倒置于吸水纸上,吸掉多余液体;用250μl Buffer P1溶液重悬细菌细胞。加入250μl Buffer P2溶液轻轻颠倒4~6次,加入350 μl Buffer N3溶液,立即颠倒4~6次;10000 g离心20 min,取上清液于另一新Ep管中。取出QIAprep Spin柱,将上清液加入 QIAprep Spin柱中;离心1 min,加500μl Buffer PB溶液洗QIAprep Spin柱,离心1 min。加750μl Buffer PE溶液洗柱,离心1 min,丢掉流出液体;取出QIAprep Spin柱,置于无菌1.5 ml Ep管中,加50μl Buffer EB到柱中央,静置1 min,离心1 min;收集所得质粒plivin-siRNA阴性对照、plivin-siRNA 1、plivin-siRNA 2,-20℃保存。
2 结果
2.1 根据siRNA设计原则所获得的两条siRNA
siRNAlivin1:正义链:5’-GAT CCG TCT GGC CTC CTT CTA TGA ttc aag aga CAT TCT CCA CAG TCA GACTttt ttt GGA AA-3’,反义链:3’-GCGAGA CCG GAG GAA GAT ACT aag ttc tct GTA AGA GGT GTC AGT CTG A aaa aaa CCT TTT CGA-5’。siRNAlivin2:正义链:5’-GAT CCG GAA GAG ACT TTG TCC ACA tta aag aga GAT CTT ACA TCT CTGAGT C ttt ttt GGA AA-3’,反义链:3’-GGC TGA GTC TGA AAC AGG TGT aag ttc tct CTA GAA TGT AGA GAC TCA G aaa aaa CCT TTT CGA-5’。
2.2 质粒酶切鉴定
Plivin-siRNA1和 plivin-siRNA2质粒经 hindⅢ和BamHⅠ双酶切,1%琼脂糖电泳,在预期分子量大小216 bp和278 bp的区域出现特异性阳性条带,图2所示。酶切结果表明,设计两条siRNA均为阳性重组载体,并将每个质粒挑选一个克隆送北京奥克公司鉴定,结果证实合成的序列准确的克隆到pSilenceTM3.1 hygro载体,重组载体合成正确。
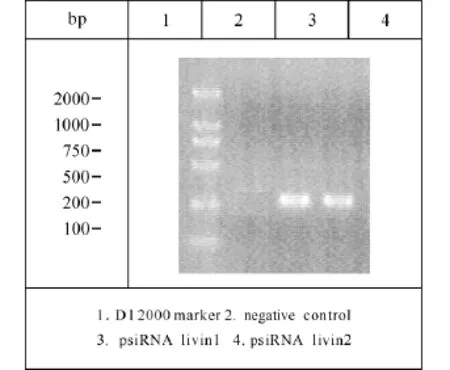
图2 重组质粒酶切电泳图Fig2 Restriction enzyme anal ysis of recombinant plasmid
3 讨论
近年来对RNA干扰的研究表明,将与mRNA对应的正义RNA和反义RNA组成的双链RNA(dsRNA)导入细胞,可以使mRNA发生特异性的降解,导致其相应的基因沉默[4]。这种转录后基因沉默机制(post-transcriptional gene silencing,PTGS)被称为RNA干扰(RNAi)。siRNA即小干扰RNA,能干扰人体本身的RNA信使功能,导致相应蛋白质无法合成,从而能起到“关闭”特定基因的作用。人工体外合成的小片段RNA,由约20个碱基对组成,包括5个磷酸盐,2个核苷和3个悬臂。通过转染进入细胞内,此siRNA含有2~3nt的3’突出端,被输送到RISC(RNA-in-duced silencing protein complex),siRNA作为引导序列引导RISC与同源性的mRNA结合,解旋酶催化 mRNA与siRNA的正义RNA链相互交换,siRNA的反义链与同源mRNA结合后,核酸酶在mRNA与siRNA反义链所形成的双链区的5’起始端下游7~10个核苷酸处(也就是双链区的靠近中间位置)切断mRNA,降解的mRNA被释放后,siRNA双链重新形成,可以继续降解同源的 mRNA[5]。
目前关于siRNA的设计软件很多,但基本上都根据Tuschl的实验[6],例如从目标序列的开放阅读框起始密码下游75至100碱基位置开始,寻找AA二连序列后的19个碱基序列。避开5’和3’端的非编码区,原因是这些地方有丰富的调控蛋白结合区域,而这些非编码区结合蛋白或者翻译起始复合物可能会影响核酸内切酶复合物结合mRNA,从而影响siRNA的效果。把GC比在40-55%直接的靶基因序列作为优选,比较潜在的序列和相应的基因组数据库,排除和其他编码去序列/EST同源的序列。同时应设立阴性对照,阴性对照的siRNA通常是将选中的siRNA的序列打乱,但要保证它和其他基因没有同源性。BLAST对比结果中,Score得分值越高说明同源性越好,Expect期望值越小比对结果越好,说明因某些原因引起的误差越小[7]。
胃癌是世界上最常见的恶性肿瘤之一,按其发病率排在第4位。在中国、日本胃癌的发病率最高,大约占全球胃癌发病例数的50%[8]。因此能够正确的预防和治疗胃癌,具有重要的现实意义。研究发现,凋亡抑制蛋白livin在胃癌等多种肿瘤组织中高表达,如果只靶向杀伤胃癌细胞而对正常细胞的伤害极小,这样才能有效的治疗胃癌,这也是治疗癌症的重要方向。因此,针对某些受体、基因或关键物质的靶向治疗也成为肿瘤研究的热点。我们针对人Livin mRNA,选择特异性siRNA靶序列,构建了靶向Livin基因siRNA载体,为进一步转染该载体的人胃癌细胞株SGC7901的后续实验做准备,酶切和测序结果表明成功构建了针对Livin基因的siRNA载体,这为以后的实验打下了良好的基础。
[1]Gaëlle Breton,Bader Yassine-Diab,Lillian Cohn et al,siRNA Knockdown of PD-L1 and PD-L2 in Monocyte-Derived Dendritic Cells only Modestly Improves Proliferative Responses to Gag by CD8+TCells from HIV-1-Infected Individuals[J].Journal of Clinical Immunology,2009,29(5):637-645.
[2]Jeff Kiefer,Hongwei H Yin,Qiang Q.Que.High-Throughput siRNA screening as a method of perturbation of biological systems and Identification of targeted pathways coupled with compound screening[J].Methods in Molecular Biology,2009,563(3):275-287.
[3]Grzybowska-Izydorczyk O,Smolewski P.The role of the inhibitor of apoptosis protein(IAP)family in hematological malignancies[J].Postepy Hig Med Dosw,2008,14;62(2):55-63.
[4]Chunsoo Kim,Yuhan Lee,Soo Hyeon Lee,et al.Selfcrosslinked polyethylenimine nanogels for enhanced intracellular delivery of siRNA[J].Macromolecular Research,2011,19(2):166-171.
[5]Zhen-Yu Ding,Ze-Gui Li,Yi-Zhan Xing,et al.The construction of siRNA plasmid targeting mouse HIF-1αand in vitro study of its inhibition effect[J].Neuroscience Bulletin,2010,25(3):122-130.
[6]Bérangère Langlet-Bertin,Christian Leborgne,Daniel Scherman,et al.Design and Evaluation of Histidine-Rich Amphipathic Peptides for siRNA Delivery[J].Pharmaceutical Research,2010,27(7):1426-1436.
[7]Chunsoo Kim,Yuhan Lee,Soo Hyeon Lee.Self-Crosslinked polyethylenimine nanogels for enhanced intracellular delivery of siRNA[J].Macromolecular Research,2011,19(2):166-171.
[8]Toshimasa Tsujinaka,Kazumasa Fujitani,Motohira Hirao·Yukimori Kurokawa.Current status of chemoradiotherapy for gastric cancer in Japan[J].Int J Clin Oncol,2008,13:117-120.

