IGF-1和MGF在过度训练抑制大鼠腹膜巨噬细胞吞噬功能中的作用研究
肖卫华,陈佩杰
IGF-1和MGF在过度训练抑制大鼠腹膜巨噬细胞吞噬功能中的作用研究
肖卫华1,2,陈佩杰1
目的:观察过度训练对大鼠腹膜巨噬细胞吞噬功能的影响及胰岛素样生长因子1(IGF-1)和机械生长因子(MGF)在其中所起的作用。方法:8周龄健康雄性Wistar大鼠16只,随机分为安静对照组(control)和过度训练组(overtraining)。过度训练组进行11周递增负荷跑台训练。最后1次训练后36h,记录体重变化并测定血液中血红蛋白和睾酮含量。断头处死大鼠并分离纯化腹膜巨噬细胞,中性红法测定巨噬细胞吞噬功能,荧光定量PCR技术测定IGF-1和MGF基因表达。离体状态下用不同浓度的IGF-1或MGF与巨噬细胞孵育2h,观察IGF-1和MGF对巨噬细胞吞噬功能的影响。结果:与安静对照组相比,过度训练组大鼠体重、血红蛋白和睾酮含量均显著降低,分别下降了约19.3%(P<0.01)、13.5%(P<0.01)、55.3%(P<0.01)。过度训练组巨噬细胞摄取中性红能力显著低于安静对照组,下降约27%(P<0.05);过度训练组巨噬细胞IGF-1mRNA水平约为安静对照组的21倍(P<0.01),MGF mRNA水平约为安静对照组的92倍(P<0.01);IGF-1对巨噬细胞吞噬功能无显著影响,各浓度组与未加药组相比均无显著性差异(P>0.05);MGF呈浓度依赖性的抑制巨噬细胞吞噬功能,与未加药组相比,10ng/ml、50ng/ml组有显著性差异(P<0.05),100ng/ml、200ng/ml组有极显著性差异(P<0.01),各浓度组间比较无显著性差异(P>0.05)。结论:过度训练抑制巨噬细胞吞噬功能;过度训练诱导产生的MGF可能在过度训练抑制巨噬细胞吞噬功能中发挥关键作用。
过度训练;巨噬细胞;吞噬功能;胰岛素样生长因子1;机械生长因子;鼠;动物实验
规律性的身体活动可以提高免疫机能,降低感染风险;而长时间、大强度运动则使感染几率增加[16,22]。巨噬细胞在控制感染过程中发挥重要作用,是机体抵御病菌入侵的第一道防线。巨噬细胞广泛分布于肺、肝、肾、腹腔、肌肉、血液等组织器官,具有吞噬、杀菌、抑制肿瘤、抗原递呈、分泌炎性因子等多种功能[17]。吞噬作用是巨噬细胞最为重要的功能之一,可吞噬入侵的病菌及清除凋亡的机体细胞。有关运动与巨噬细胞吞噬功能的研究表明,长期中低强度运动或短期剧烈运动均能提高巨噬细胞吞噬功能[8,9,23],但过度训练如何影响巨噬细胞吞噬功能未见相关研究。此外,运动影响巨噬细胞吞噬功能的相关机制鲜见报道。
研究表明,IGF-1能促进巨噬细胞分泌TNF-α[21]和IL-1β[24]等炎性因子,促进巨噬细胞摄取和降解低密度脂蛋白[13],诱导巨噬细胞向炎症部位迁移参与炎症反应[10],调控巨噬细胞的分化和存活[19]等多种功能。但IGF-1是否参与巨噬细胞吞噬功能的调控,未见相关报道。此外,IGF-1前体选择性剪接能产生多种异构体,如IGF-1Ea、IGF-1Eb等,IGF-1Ea即为研究者常称的IGF-1,IGF-1Eb在啮齿类动物中又被称为“机械生长因子”(mechano growth factor,MGF)[25]。MGF功能有别于IGF-1,具有增加肌肉体积和肌肉力量等多种功能,且MGF促进肌肉体积增大的效应远大于IGF-1[7]。此外,MGF可不通过IGF-1受体途径发挥作用[26]。因此,MGF已经成为了体育界的研究热点[2,5,6]。安静状态下肌肉中IGF-1和MGF呈低丰度表达,大强度运动可诱导其急剧增加[12]。报道显示,巨噬细胞能表达IGF-1[10],但能否表达MGF及是否受大强度运动诱导,未见相关报道。此外,MGF是否参与巨噬细胞功能调控,尚未见相关资料。
据此,本文提出如下假设:过度训练可能通过抑制巨噬细胞吞噬功能从而降低免疫细胞功能,增加感染几率;巨噬细胞中IGF-1和MGF表达可能与肌肉中相似,即在大强度运动诱导下表达量急剧增加,通过自分泌或旁分泌形式参与巨噬细胞吞噬功能的调控。为验证这一假设,本文通过建立过度训练模型,以腹膜巨噬细胞为对象并结合离体实验展开相关研究。
1 材料与方法
1.1 材料
Wistar大鼠[中国科学院上海实验动物中心/上海斯莱克实验动物有限公司,SCXK(沪)2007-0005];RPMI1640,胎牛血清(GIBCO,美国);青霉素-链霉素溶液(碧云天生物技术研究所);中性红(Amersco,美国);睾酮ELISA试剂盒(R&D Systems,美国);Trizol(invitrogen,美国);cDNA合成试剂盒,荧光定量PCR试剂盒(Fermentas,立陶宛);重组IGF-1(Sigma Aldrich,美国);MGF多肽(上海吉尔生化有限公司);细胞培养板(Corning,美国);其他试剂均为国产分析纯。大鼠跑台(DSPT-202跑台,杭州段氏制作公司);血细胞分析仪(Sysmex,日本);梯度PCR仪(Eppendorf,德国);Rotor-Gene 3000荧光定量PCR仪(Corbett,澳大利亚);酶标仪(Bio-Rad,美国)。
1.2 方法
1.2.1 实验动物及分组
8周龄健康雄性Wistar大鼠16只,体重180±10g。动物饲养环境温度为22℃±2℃,相对湿度50%~70%,每天光照时间为12h,自由饮食。将大鼠随机分为安静对照组(control)和过度训练组(overtraining),每组8只。
1.2.2 过度训练方案
动物适应性饲养1周后,过度训练组开始进行递增负荷的跑台训练,每周6次,周日休息,共训练11周。过度训练方案参考文献方法进行[14](表1)。
1.2.3 过度训练模型验证
观察大鼠精神状况及运动能力的变化,且在最后1次训练后36h,记录各组体重,并眼眶取血收集血液样本。血细胞分析仪测定血红蛋白含量。竞争法ELISA测定血清睾酮含量,操作流程按产品说明书。
1.2.4 腹膜巨噬细胞分离与纯化
采用文献方法[4,20]进行并略作修改。眼眶取血后断头处死大鼠,腹腔注射12ml RPMI1640培养液,腹部按摩2 min后静置5min,在腹部做约2cm长开口并小心吸取腹腔灌洗液入离心管。离心去上清,PBS洗2遍后用含10%胎牛血清的RPMI1640培养液重悬细胞并移入6孔板,于37℃、含5%CO2的培养箱中贴壁培养2h,倾去不贴壁细胞,贴壁细胞即为巨噬细胞,PBS(pH 7.4)轻柔洗涤2次后加入PBS小心吹打细胞入离心管,离心去上清后用RP-MI1640重悬细胞,用细胞计数板计数,调浓度至2×106个/ml。
1.2.5 吞噬功能的测定
中性红法测定巨噬细胞吞噬功能[15]。取100μl上述细胞悬液至96孔板,37℃、5%CO2的培养箱中孵育2h后,弃上清,加入200μl含0.1%中性红溶液孵育30min,PBS洗3次后,加入无水乙醇和冰醋酸混合液(1∶1)200 μl并混匀,10min后于酶标仪上测定550nm吸光度。吸光度即代表巨噬细胞吞噬功能。

表1 本研究过度运动方案一览表Table 1 Overtraining Protocol
1.2.6 RNA抽提与cDNA合成
离心收集剩余的细胞。使用异硫氢酸胍-氯仿经典法抽提总RNA。反转录反应条件为:65℃,5min;4℃,2 min;25℃,5min;42℃,60min;70℃,5min。反应总体积20μl,合成的cDNA储存在-20℃备用[3]。
1.2.7 荧光定量PCR
根据Genbank数据库中公开发表的基因序列,设计目的基因IGF-1和MGF及内参基因β-actin的荧光定量引物(表2),引物由上海生工生物工程技术服务有限公司合成。双标曲法相对定量PCR,定量PCR反应液包括:MaximaTMSYBR Green/ROX qPCR Master Mix(2×),12.5μl;上、下游引物各0.75μl(10μM);模板cDNA,1μl;DEPC水,10μl;总计25μl体积。反应条件采用两步法:50℃,2 min;95℃,10min;95℃(15s),60℃(60s),40个循环。IGF-1和MGF基因在1~105units范围内,检测阈值(CT)与拷贝数对数呈线性关系,两者相关系数r>0.99。熔解曲线分析显示二者均呈单一产物峰。
1.2.8 离体实验
取180g左右Wistar大鼠12只,按1.2.4所示分离纯化腹膜巨噬细胞。所有纯化的巨噬细胞混合重悬于无血清的RPMI1640中(含1%青霉素-链霉素溶液),调细胞浓度至2×106个/ml。取100μl至96孔板,无血清培养12 h后(排除血清干扰)[26],加入不同浓度的IGF-1或MGF溶液(终浓度0、1、10、50、100、200ng/ml),于37℃、5% CO2的培养箱中孵育2h后,按1.2.5所示测定巨噬细胞吞噬功能。每浓度3复孔,用不同的培养板重复3次。
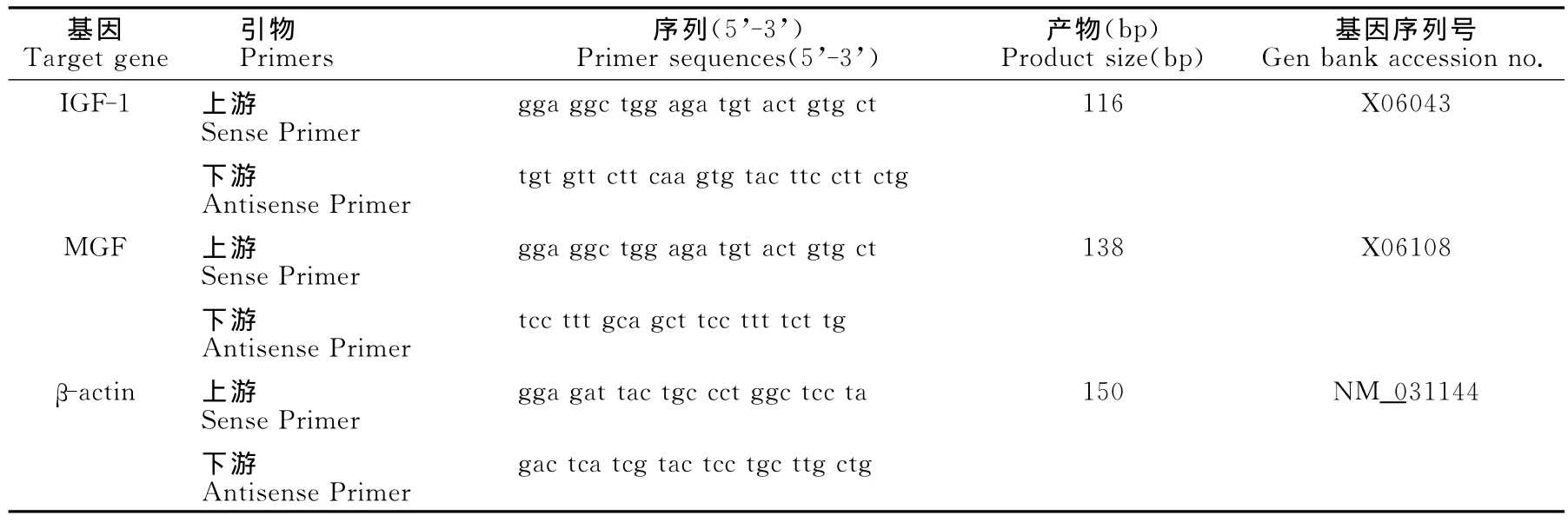
表2 本研究荧光定量PCR引物一览表Table 2 Primers Used for qRT-PCR
1.2.9 统计分析
实验数据用SPSS 17.0统计软件处理,独立样本t检验和单因素方差分析,统计学显著性水平定为0.05。
2 结果
2.1 过度训练模型验证
2.1.1 一般观察
前8周运动组大鼠状态变化不明显,不需过多外力协助即能较好的完成训练。随着每天训练频次的增加,即从第9周开始至第11周,运动组大鼠精神状态明显下降,表现为毛发脱落、毛色晦暗、目光呆滞、易受惊吓。同时,运动能力下降,跟不上既定速度,需多次用手驱赶,协助其完成规定时间的运动,运动后精疲力竭、喘息不止、趴地不起,且每天训练频次越多,这一现象越明显。
2.1.2 过度训练降低大鼠体重、血红蛋白和睾酮含量
从表3可知,与安静对照组相比,过度训练组大鼠体重、血红蛋白和睾酮含量均显著降低,分别下降了约19.3%(P<0.01)、13.5%(P<0.01)和55.3%(P<0.01)。
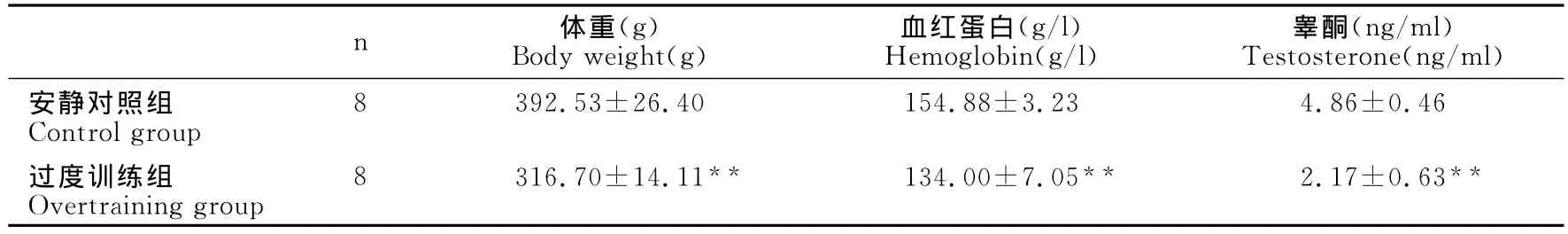
表3 本研究大鼠体重、血红蛋白和睾酮含量变化一览表Table 3 Body Weight,Hemoglobin,and Testosterone of Rats
2.2 过度训练抑制巨噬细胞吞噬功能
过度训练组大鼠巨噬细胞摄取中性红能力(0.27± 0.04)显著低于安静对照组(0.37±0.07),下降约27%,具有统计学意义(P<0.05)。
2.3 过度训练增加巨噬细胞IGF-1和MGF基因表达
荧光定量PCR分析显示,过度训练组大鼠巨噬细胞IGF-1mRNA水平约为安静对照组的21倍(P<0.01);MGF mRNA水平约为安静对照组的92倍(P<0.01)(图1)。

图1 过度训练对巨噬细胞IGF-1和MGF基因表达的影响示意图Figure 1. Effect of Overtraining on IGF-1and MGF mRNA Level of Peritoneal Macrophages
2.4 MGF抑制巨噬细胞吞噬功能
纯化的巨噬细胞经12h无血清培养后,巨噬细胞与不同浓度IGF-1孵育2h,结果表明,IGF-1对巨噬细胞吞噬功能没有显著影响,各浓度组与未加药组相比均无显著性差异(P>0.05)。而巨噬细胞与不同浓度的MGF孵育2 h,巨噬细胞摄取中性红的能力显著降低,且呈浓度依赖性,10ng/ml、50ng/ml组与未加药组相比有显著性差异(P<0.05),100ng/ml、200ng/ml组与未加药组相比有极显著性差异(P<0.01),各浓度组间比较无显著性差异(P>0.05)(图2)。
3 讨论
竞技体育追求大强度的运动训练,运动员常处在过度训练的边缘或已经过度训练,这会对运动员运动成绩的提高及身体健康造成严重影响,感染疾病的风险也随之增加[22]。本研究通过长时间、大强度运动模拟过度训练,观察大鼠精神状况及运动能力的变化,并监测了反映过度训练的几种常用指标[1]。结果表明,在训练的后期,大鼠精神状态及运动能力均降低。11周大强度运动使大鼠体重、血红蛋白和睾酮含量均显著降低(P<0.01),与安静对照组相比分别下降了约19.3%、13.5%和55.3%,表明11周大强度运动诱导机体出现失衡状态,过度训练模型得以建立。本研究发现,过度训练时,巨噬细胞吞噬功能显著低于安静对照组大鼠,下降了约27%(P<0.05)。吞噬功能作为巨噬细胞最为重要的功能之一,过度训练引起吞噬功能降低势必抑制其清除病菌的能力,这可能是过度训练增加感染风险的机制之一。

图2 IGF-1和MGF对巨噬细胞吞噬功能的影响曲线图Figure 2. Effect of IGF-1and MGF on the Phagocytosis of Peritoneal Macrophages
巨噬细胞能表达IGF-1,笔者推测,巨噬细胞也能表达IGF-1的异构体MGF并受大强度运动诱导。研究结果表明,11周大强度运动可诱导巨噬细胞中IGF-1和MGF基因表达急剧增加(分别增加约21倍和92倍)。巨噬细胞中MGF表达对运动应激更敏感,这与肌肉中MGF表达对运动应激更敏感的报道一致[12]。因 MGF具有不同于IGF-1的多种功能,其表达的差异可能具有重要生理意义。为探究过度训练状态下巨噬细胞大量表达IGF-1和MGF的潜在意义,本研究采用离体方法观察了不同浓度IGF-1或MGF对巨噬细胞吞噬功能的影响。结果发现,各个浓度的IGF-1对巨噬细胞吞噬功能均无显著影响,而MGF则呈浓度依赖性的抑制巨噬细胞吞噬功能。这提示,巨噬细胞中MGF可通过自分泌或旁分泌形式对巨噬细胞功能进行调控。肌肉中MGF表达增加普遍被认为是有益的,它可激活肌卫星细胞,参与运动性肌肉肥大、损伤肌肉修复和防止肌肉萎缩[11,18]。但本研究中MGF可呈浓度依赖性的抑制巨噬细胞吞噬功能,表明MGF是巨噬细胞功能的负向调控因子。这些结果提示,过度训练时巨噬细胞中MGF呈高丰度表达具有重要生理意义,即MGF可能在抑制巨噬细胞吞噬功能中发挥关键作用。
本研究证明巨噬细胞可表达MGF且受大强度运动诱导,且MGF参与了对巨噬细胞吞噬功能的调控,这可能是过度训练抑制免疫功能的新机制,但MGF抑制巨噬细胞吞噬功能的具体信号途径仍有待深入研究。
4 结论
过度训练抑制巨噬细胞吞噬功能;过度训练诱导产生的MGF可能在过度训练抑制巨噬细胞吞噬功能中发挥关键作用。
[1]曲绵域,于长隆.实用运动医学[M].北京:北京大学医学出版社,2003:344-346.
[2]史仍飞,卞玉华,危小焰.振动训练对大鼠骨骼肌质量和肌细胞机械生长因子mRNA表达的影响[J].中国运动医学杂志,2008,27(4):508-510.
[3]肖卫华,陈佩杰.补充谷氨酰胺对过度训练大鼠腹膜巨噬细胞IGF-1和MGF基因表达的影响[J].中国运动医学杂志,2011,30(7):634-638.
[4]肖卫华,陈佩杰,王茹,等.过度训练及补充二联甲苯或谷氨酰胺对大鼠腹膜巨噬细胞活性氧和诱导型一氧化氮合酶的影响[J].体育科学,2011,31(2):49-54.
[5]肖卫华,陆耀飞.骨骼肌损伤后修复过程中机械生长因子作用研究[J].体育科学,2008,28(6):34-38.
[6]肖卫华,陆耀飞.机械生长因子实时荧光定量RT-PCR检测方法研究[J].上海体育学院学报,2010,34(6):43-45.
[7]BARTON-DAVIES E R,SHORTUMA D I,MUSARO A,et al.Viral mediated expression of insulin-like growth factor I blocks the aging-related loss of skeletal muscle function[J].Proc Natl Acad Sci USA,1998,95(26):15603-15607.
[8]FERRANDEZ M D,DE LA FUENTE M.Effects of age,sex and physical exercise on the phagocytic process of murine peritoneal macrophages[J].Acta Physiol Scand,1999,166(1):47-53.
[9]FERREIRA CKO,PRESTES J,DONATTO F F,et al.Acute effects of short-duration exercise on the phagocytic capacity of peritoneal macrophages in sedentary rats[J].Rev.bras.Fisiot-er,2007,11(3):191-197.
[10]FURUNDZIJA V,FRITZSCHE J,KAUFMANN J,et al.IGF-1increases macrophage motility via PKC/p38-dependentαvβ3-integrin inside-out signaling[J].Biochem Biophys Res Commun,2010,394(3):786-791.
[11]GOLDSPINK G.Impairment of IGF-I gene splicing and MGF expression associated with muscle wasting[J].Biochem Biol,2006,38(3):481-489.
[12]HAMEED M,ORRELL R W,COBBOLD M,et al.Expression of IGF-I splice variants in young and old human skeletal muscle after high resistance exercise[J].J Physiol,2003,547(1):247-254.
[13]HOCHBERG Z,HERTZ P,MAOR G,et al.Growth hormone and insulin-like growth factor I increase macrophage uptake and degradation of low-density lipoprotein[J].Endocrinology,1992,131(1):430-435.
[14]HOHL R,FERRARESSO R L,DE OLIVEIRA R B,et al.Development and Characterization of an Overtraining Animal Model[J].Med Sci Sports Exe,2009,41(5):1155-1163.
[15]LONG F,WANG Y X,LIU L,et al.Rapid nongenomic inhibitory effects of glucocorticoids on phagocytosis and superoxide anion production by macrophages[J].Steroids,2005,70(1):55-61.
[16]MEYER T,GABRIEL H H,RATZ M,et al.Anaerobic exercise induces moderate acute phase response[J].Med Sci Sports Exe,2001,33(4):549-555.
[17]MURPHY E A,DAVIS J M,BROWN A S,et al.Role of lung macrophages on susceptibility to respiratory infection following short-term moderate exercise training[J].Am J Physiol Regul Integr Comp Physiol,2004,287(6):R1354-R1358.
[18]MUSARO A,MCCULLAGH K,PAUL A,et al.Localized IGF-I transgene expression sustains hypertrophy and regeneration in senescent skeletal musle[J].Nature Genet,2001,27(2),195-200.
[19]OBERLIN D,FELLBAUM C,EPPLER E.Insulin-like growth factor I messenger RNA and protein are expressed in the human lymph node and distinctly confined to subtypes of macrophages,antigen-presenting cells,lymphocytes and endothelial cells[J].Immunology,2009,128(3):342-350.
[20]PAULOVICOVA E,KOVACOVA E,BYSTRICKY S.Vibrio cholerae O1Ogawa detoxified lipopolysaccharide structures as inducers of cytokines and oxidative species in macrophages[J].J Med Microbiol,2010,59(pt2):158-164.
[21]RENIER G,CLEMENT I,DESFAITS A C,et al.Direct stimulatory effect of insulin-like growth factor-I on monocyte and macrophage tumor necrosis factor-alpha production[J].Endocrinology,1996,137(11):4611-4618.
[22]ROBSON P J,BLANNIN A K,WALSH N P,et al.Effects of exercise intensity,duration and recovery on in vitro neutrophil function in male athletes[J].Int J Sports Med,1999,20(2):128-135.
[23]SUGIURA H,SUGIURA H,NISHIDA H,et al.Effects of different durations of exercise on macrophage function in mice[J].J Appl Physiol,2001,90(3):789-794.
[24]UELAND T,FOUGNER S L,GODANG K,et al.Associations between Body Composition,Circulating Interleukin-1Receptor Antagonist,Osteocalcin,and Insulin Metabolism in Active Acromegaly[J].J Clin Endocrinol Metab,2010,95(1):361-368.
[25]YANG S Y,ALNAQEEB M,SIMPSON H,et al.Cloning and characterization of an IGF-I isoform expressed in skeletal muscle subjected to stretch[J].Muscle Res Cell Motil,1996,17(4):487-495.
[26]YANG S Y,GOLDSPINK G.Diffrent roles of the IGF-I Ec peptide(MGF)and mature IGF-I in myoblast proliferation and differentiation[J].FEBS Letters,2002,522(1):156-160.
Overtraining Inhibiting Phagocytosis of Rat Peritoneal Macrophages:Role of IGF-1and MGF
XIAO Wei-hua1,2,CHEN Pei-jie1
Objective:To investigate the effects of overtraining on the phagocytosis of peritoneal macrophages and the roles of IGF-1and MGF in this process.Methods:16male wistar rats were randomized to 2groups:sedentary group(n=8)and overtraining group(n=8).Overtraining group was training in standard treadmill with an increasing load for 11weeks.36hafter the last session of exercise,record the body weight,blood was sampled at the retro-orbital sinus to determine the contents of hemoglobin and testosterone.Rats were sacrificed by decapitation,and then peritoneal macrophages were isolated and purified.The phagocytosis and mRNA levels of IGF-1and MGF were measured by the uptake of neutral red and real-time PCR respectively.In addition,we evaluate the effects of IGF-1and MGF peptide on phagocytosis of peritoneal macrophages in vitro(MФs were exposed to different concentrations of IGF-1or MGF peptide for 2h).Results:There was a decline of body weight(by 19.3%),hemoglobin(by 13.5%)and testosterone(by 55.3%)in overtraining group when compared with control group(P<0.01).Overtraining significantly inhibited phagocytosis of MФs(declined by 27%,P<0.05).When compared with the control group,IGF-1and MGF mRNA level in MФs from overtraining group increased 21-fold and 92fold,respectively(P<0.01).In vitro experiments showed that IGF-1had no significant effects on phagocytosis of MФs,there were no significant difference in each concentration when compared with untreated cells(P>0.05).Unlike IGF-1,MGF peptide impaired the phagocytosis of MФs in dose-independent manner.There were signifcant differences in 10ng/ml(P<0.05),50ng/ml(P<0.05),100ng/ml(P<0.01),200ng/ml(P<0.01),when compared with the untreated cells.There were no significant difference between different concentrations of MGF(P>0.05).Conclusion:These results suggest that overtraining inhibits the phagocytosis of peritoneal macrophages,and MGF produced by macrophages may play a key role in this process.
overtraining;macrophages;phagocytosis;insulin-likegrowthfactor-1;mecha-nogrowthfactor;rat;animalexperiment
G804.7
A
2011-07-06;
2011-09-11
国家自然科学基金资助项目(30971422);上海市重点学科建设资助项目(S30802);上海体育学院研究生创新基金(yjscx201004)。
肖卫华(1981-),男,湖南安化人,讲师,在读博士研究生,研究方向为运动与健康促进,Tel:(021)51253242,E-mail:xiaoweihua1115@163.com;陈佩杰(1962-),男,浙江舟山人,教授,博士,博士研究生导师,研究方向为运动免疫学与青少年体质研究,Tel:(021)51253626,E-mail:chengpjk@online.sh.cn。
1.上海体育学院运动科学学院,上海200438;2.湘南学院体育系,湖南郴州423000
1.College of Exercise and Sport Science,Shanghai University of Sport,Shanghai 200438,China;2.Department of Physical Education,Xiangnan University,Chenzhou 423000,China.
1000-677X(2011)10-0067-05

