一株高产灵菌红素粘质沙雷氏菌的筛选与鉴定*
韦 凤, 蒋冬花, 蔡琪敏, 宋迤明
(浙江师范大学化学与生命科学学院,浙江金华 321004)
灵菌红素是一类天然红色素家族的总称,是由多种放线菌和细菌产生的一类次级代谢产物.1929年Amako等在研究沙雷氏菌(Serratia)生长时发现,并由Harashima等在1960年首次分离得到此类物质[1-2].随后,对该类物质的性质及生物活性的研究一直倍受相关研究者的关注.随着研究的不断深入,它的许多生物学活性被人们所认识,包括抗细菌、抗疟疾、抗真菌和抗原生动物的活性[3-5].但人们最感兴趣的是此物质所具有的免疫抑制活性和引起肿瘤细胞凋亡的作用[6-8].
目前国内相关研究集中于灵菌红素生产工艺的研究,着重于高产菌种的获得和生产工艺的优化方面,以提高该天然色素的产量,降低生产成本[9-11].
本研究通过筛选自然生境中产色素菌株,从淡水鱼体中分离得到一株高产红色色素的粘质沙雷氏菌(Serratia marcescens),编号为 Sm-128菌株.通过紫外吸收光谱及薄层色谱实验,结合前人的研究结果,证实其所产色素为灵菌红素.用甘油培养基培养Sm-128菌株,灵菌红素粗品产量可达475 mg/L.Sm-128菌株生长快、周期短,生长条件粗放,生产色素能力强,性状稳定,可为工业化生产灵菌红素提供优质的菌种资源.
1 材料与方法
1.1 菌株来源
高产灵菌红素沙雷氏菌株分离自浙江金华水库淡水鱼体,编号为Sm-128,由本实验室保藏.
1.2 培养基
1)PDA培养基:马铃薯200 g/L,葡萄糖20 g/L,琼脂20 g/L,自然 pH.
2)LB培养基:胰化蛋白胨10 g/L,酵母提取物5 g/L,NaCl 10 g/L,琼脂 20 g/L,pH 7.0 ~7.2.
3)液体培养基(甘油蛋白胨培养基):蛋白胨5 g/L,甘油10 mL/L,自然 pH.
1.3 主要仪器与设备
紫外可见光分光光度计;旋转蒸发仪(上海亚荣生化仪器厂);循环水式多用真空泵;精密pH计;电子分析天平;电热恒温水浴锅;显微镜(Leica,德国)等.
1.4 菌种分离纯化和筛选
选取不同生境的材料,以PDA培养基和LB培养基作为筛选培养基.从鱼体等生境中筛选产生色素的菌株,方法(以鱼体为例)如下:取浙江金华地区水库淡水鱼,取其内脏切碎,以无菌水浸泡2 h,采用浓度梯度稀释法,选择合适浓度(10-2,10-3)的样液,取 200 μL 涂布于 PDA 培养基上,28℃恒温培养,得红色菌落.挑取红色菌落,用连续划线法纯化,获纯菌株[12]128-130.
1.5 色素分析
1.5.1 紫外吸收光谱分析
通过测定色素分子对紫外/可见光的吸收,可以鉴定和定量分析大量的无机化合物和有机化合物.用药匙从平板上刮取红色菌苔,以无水乙醇作为浸提液,在研钵中充分研磨提取,收集融入色素的无水乙醇溶液,反复提取直到无水乙醇液不变色.将收集的无水乙醇溶液进一步离心,得上清液,在紫外分光光度计下测定并绘制上清液的吸收光谱图[13].
1.5.2 薄层色谱分析
薄层色析法(TLC)是高效的色谱分离和高灵敏度的检出少量物质的一种实验技术,也是判断样品纯度的有效、简单、快捷的方法.灵菌红素提取常用的溶剂有甲醇、乙醇、丙酮、氯仿、乙酸乙酯及石油醚等,这些溶剂各具优缺点.结合文献[14],最终选定展开剂为:V(石油醚)∶V(乙酸乙酯)=1∶1.根据色素在色谱板上的分离效果及Rf值,再结合文献,判断色素的性质.
1.5.3 产量分析
从活化的LB培养基上挑取约2环菌种接入培养液中,28℃,150 r/min培养12 h,再以3%的接种量接入发酵培养液中,在28℃,150 r/min培养24 h,可得含灵菌红素的菌体,并有少量目的产物在培养液中.
发酵液以10 000 r/min离心15 min,并重复洗涤3次后得菌体和培养液.菌体直接用无水乙醇作为浸提液,辅以超声波破碎进行色素浸提,离心得上清液,反复多次直至菌体无颜色.收集上清液,经旋转蒸发仪浓缩,得色素粗品,称量,计算产量.
1.6 菌种鉴定
1.6.1 形态观察
纯化后的菌株分别接种于PDA培养基、LB培养基中,28℃培养2 d,取菌体先用简单染色法和革兰氏染色法染色,再用显微镜观察拍照.
1.6.2 生理生化特征分析
菌株用LB培养基28℃培养连续观察5 d,进行糖发酵、氧化酶、触酶、尿素酶和H2S、甲基红等实验[12]220-225.
1.6.3 16S rDNA 基因序列分析
菌株基因组DNA的提取参照文献[15]的方法.利用细菌的16S rDNA通用正反向引物5'-AGAGTTTGATCCTGGCTCAG-3',5'-GGTTACCTTGTTACGACTT-3',以基因组 DNA为模板进行聚合酶链式反应(PCR)扩增.PCR程序为:98℃5 min,95 ℃ 35 s,55 ℃ 35 s,72 ℃ 1 min 30 s,35个循环,延伸8 min.PCR扩增用Taq酶,产物连入克隆载体pUCm-T后,由上海生物工程技术公司完成测序.
1.6.4 同源性分析及系统发育树的构建
利用BLAST程序寻找与目的基因序列同源性最高的已知分类地位的菌种,然后从GenBank基因序列数据库中提取近缘菌株的16S rDNA基因序列,与测定的序列共同用Clustal X程序校准排齐进行多序列比较后,用MEGA4软件以邻接法(Neighbor-Joining法)构建系统发育树.
2 结果与分析
2.1 产色素菌株的分离、纯化和初筛
从自然界不同生境中筛选产色素的菌株,经分离、纯化,共获得16株产不同色素的菌株.其中:产红色色素的菌株9株(见图1(a),(c)和(f));产黄色色素的菌株4株(见图1(b)和(e));产粉色色素的菌株2株(见图1(d));产紫色色素的菌株1株.根据传统分类方法观察菌落、菌体特征,16株菌株中包括8株细菌、3株放线菌和5株真菌.部分菌株的菌落如图1所示.
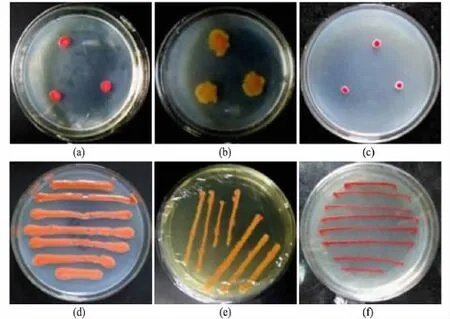
图1 部分产色素菌株的菌落
2.2 产灵菌红素菌株的复筛
灵菌红素为一类红色天然色素.从初筛结果可以看出,筛选出的16株产色素菌株中有9株产红色色素,故对这9株菌株进行复筛.灵菌红素紫外光谱吸收峰在535 nm处[14],采用紫外吸收光谱法对9株菌株所产色素进行扫描检测,最终获得1株符合灵菌红素吸收光谱(见图2(a))的菌株.该菌株分离筛选自浙江金华淡水鱼体,编号为Sm-128.
2.3 Sm-128菌株产色素的分析
2.3.1 紫外吸收光谱分析
Sm-128菌株产色素的紫外可见光吸收光谱见图2(a).以无水乙醇作为浸提液所得色素在535 nm处有明显的吸收峰,说明该色素的分子结构具有很大的共轭体系,可能有很多共轭双键、苯环或类似苯环的共轭结构,或含杂原子的杂环.从相关资料已知灵菌红素的最大吸收波长为535 nm,其分子结构中含有3个吡咯环[13].Sm-128菌株所产色素的紫外可见光吸收光谱图与文献报道的灵菌红素的紫外吸收谱图一致.
2.3.2 薄层色谱分析
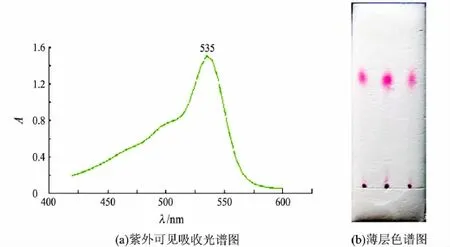
图2 Sm-128菌株产色素(无水乙醇浸提)的分析
实验结果表明,所选展开系统(V(石油醚)∶V(乙酸乙酯)=1∶1)对Sm-128菌株所产色素有较好的分离效果.在此展开系统下得到一红色清晰斑点,其比移值Rf=0.60(见图2(b)),与文献报道灵菌红素的结果一致.紫外吸收光谱及薄层色谱分析结果均与已有文献[14]的结果一致,故可判断该菌株所产色素即为灵菌红素.
2.3.3 色素产量测定
Sm-128菌株生长迅速,生长条件粗放,在甘油培养基上经过种子扩大培养发酵3 d后,培养液色泽鲜艳,菌体粘稠.采用上述分离提取方法测得菌体生物量为3 g/L,色素产量达475 mg/L.
2.4 Sm-128菌株的鉴定
2.4.1 形态特征
Sm-128菌株在LB培养基上呈红色,随培养时间的延长颜色逐渐加深,生长迅速,12 h后菌落为圆型,表面隆起,光滑粘稠,易挑取(见图3(a)),有轻微异味.在不同的培养基上,其生长状态、颜色有所差异.
Sm-128菌株在显微镜下观察为球形或短杆状,长度1.0 ~1.2μm,宽度0.9 ~1.0 μm,革兰氏染色阴性,无芽孢,无运动(见图3(b)).
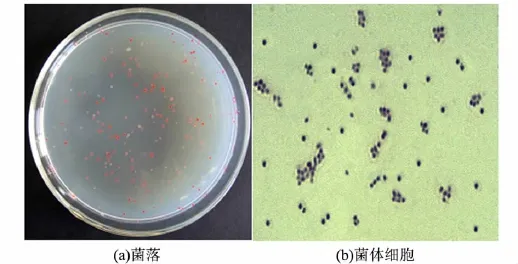
图3 Sm-128菌株的形态特征
2.4.2 生理生化特征
Sm-128菌株革兰氏染色呈阴性,兼性好氧;二乙酰试验(V-P试验)和过氧化氢酶反应阳性,甲基红(MR)试验、氧化酶和苯丙氨酸反应阴性;能利用蔗糖、葡萄糖、木糖、甘露醇和阿拉伯糖产酸,不能利用乳糖产酸;能还原硝酸盐;利用柠檬酸盐可使明胶水解;不能在三糖铁(TSI)琼脂实验中产生H2S.
2.4.3 分子生物学鉴定及其系统发育树
Sm-128菌株基因组DNA提取结果见图4.采用细菌的16S rDNA通用引物进行PCR扩增,获得长度为1 503 bp的基因,序列测定委托上海生物工程技术公司完成.该基因序列已在GenBank注册(HQ834310).
将Sm-128菌株的16S rDNA基因序列用BLAST进行相似性比较后发现,其与沙雷氏菌属内种的同源性最高.然后,将Sm-128菌株的16S rDNA基因序列与GenBank数据库中已知的沙雷氏菌属内近缘菌株进行多序列比较后,用MEGA4以Neighbor-Joining法绘制系统发育树(见图5),与粘质沙雷氏菌(Serratia marcescens)菌株的同源性达99.2%.结合形态特征和生理生化特征最终鉴定该Sm-128菌株属于沙雷氏菌属(Serratia)的粘质沙雷氏菌(Serratia marcescens).
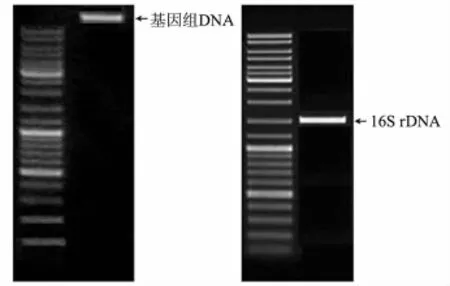
图4 Sm-128菌株基因组DNA和16S rDNA电泳分析图
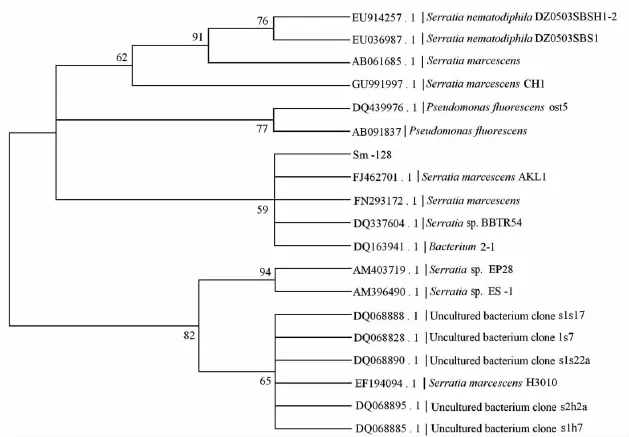
图5 基于16S rDNA基因序列建立的沙雷氏菌属系统发育树
3 结论与讨论
在从自然界不同生境中筛选产色素菌株的过程中获得了16株颜色各异、具有代表性的微生物菌株,其中包含1株在淡水鱼体内分离得到的产红色色素、生长迅速、条件粗放的Sm-128菌株.
本实验对Sm-128菌株首先通过常规的菌落外观特征、显微镜下特征和生理生化实验[16]进行了初步鉴定,进一步通过16S rDNA序列分析得到其与粘质沙雷氏菌(Serratia marcescens)同源性为99.2%,最终鉴定该菌为粘质沙雷氏菌.该菌株的16S rDNA基因序列已在GenBank注册(HQ834310).
粘质沙雷氏菌是生产灵菌红素的主要菌株,本实验所述Sm-128菌株所产色素表观可见为红色色素,紫外吸收光谱和薄层色谱分析所得结论均与已有文献结论相一致,故判断Sm-128菌株所产色素即为灵菌红素.该菌株在甘油培养基上培养的生物量可达3 g/L,色素粗品产量达475 mg/L.此产量为未经过条件优化的结果,且提取工艺尚待进一步优化.
灵菌红素是一大类红色色素的总称,该实验中目前所得结果尚未精确到色素的具体组分,将通过后续实验分析其不同的组分与结构.
[1]Shieh W Y,Chen Yiwen,Chaw S M,et al.A red,facultatively anaerobic,marine bacterium isolated from sea water[J].Int J Syst Evol Microbiol,2003,53(2):479-484.
[2]Pandey R,Chander R,Sainis K B.A novel prodigiosin-like immunosuppressant from an alkalophilic Micrococcus sp.[J].Int Immunopharmacology,2003,3(2):159-167.
[3]Giri A V,Anandkumar N,Muthukumaran G,et al.A novel medium for the enhanced cell growth and production of prodigiosin from Serratia marcescens isolated from soil[J].Bio MedCentral Microbiol,2004,4(1):11-21.
[4]Nakashima T,Kato Y,Yamaguchi K,et al.Evaluation of the anti-trichophyton activity of a prodigiosin analogue produced by γ-proteobacterium,using stratum corneum epidermis of the Yucatan micropig[J].J Infection Chemotherapy,2005,11(3):123-128.
[5]Song Cang,Sanada M,Johdo O,et al.High production of prodigiosin by Serratia marcescens grown on ethanol[J].Biotech Lett,2000,22(22):1761-1765.
[6]Montaner B,Perez T R.The cytotoxic prodigiosin induces phosphorylation of p38-MAPK but not of SAPK/JNK[J].Toxicol Lett,2002,129(11):93-98.
[7]Songia S,Mortellaro A,Tavema S,et al.Characterization of the new immunosuppressive drug undecylprodigiosin in human lymphocytes:retinoblastoma protein,cyclin-dependent kinase-2,and cyclin-dependent kinase-4 as molecular targets[J].J Immunol,1997,158(8):3987-3995.
[8]Yamamoto D,Uemura Y,Tanaka K,et al.Cycloprodigiosin hydrochloride H+/Cl-symporter induces apoptosis and differentiation in HL-60 cells[J].Int J Cancer,2000,88(1):121-128.
[9]王学东.灵菌红素发酵与分离过程优化及其诱导癌细胞凋亡作用的研究[D].上海:华东理工大学,2004.
[10]Tao Jinli,Wang Xuedong,Shen Yaling,et al.Strategy for the improvement of prodigiosin production by a Serratia marcescens mutant through fed-batch fermentation[J].World J Microbiol Biotechnol,2005,21(6/7):969-972.
[11]Wei Yuhong,Yu Wanju,Chen Weichuan.Enhanced undecylprodigiosin production from Serratia marcescens SS-1 by medium formulation and amino-acid supplementation[J].J Biosci Bioeng,2005,100(4):466-471.
[12]周德庆.微生物学实验教程[M].2版.北京:高等教育出版社,2009.
[13]Lewis S M,Corpe W A.Prodigiosin producing bacteria from marine sources[J].App Micro biol,1963,12(1):13-17.
[14]李厚金,蔡创华,周毅频,等.大亚湾海洋细菌Pseudomonas sp.中的红色素[J].中山大学学报:自然科学版,2003,42(3):102-104.
[15]曹亚.实用分子生物学操作指南[M].北京:人民卫生出版社,2003:39-40.
[16]布坎南 R E,吉本斯 N E.伯杰细菌鉴定手册[M].8版.中国科学院微生物研究所,译.北京:科学出版社,1984.

