佛手炭疽病病原菌的生物学特性研究*
路 梅, 杨佳妮, 周端顼, 李永强
(浙江师范大学化学与生命科学学院,浙江金华 321004)
佛手(Citrus medica L.var.sarcodactylis)又名五指橘,为芸香科常绿灌木或小乔木,果实张开如手指状,故名佛手.主产于闽粤、川、江浙等省,其中以浙江金华佛手最为著名,被誉为“果中之仙品,世上之奇卉”,雅称“金佛手”,具有很高的观赏和药用价值.
佛手的主要病害有溃疡病、煤烟病和炭疽病.炭疽菌属(Colletotrichum)是一类重要的植物病原真菌,能引起叶斑、果腐、嫩梢或枝条回枯等症状,严重危害多种经济农作物等,造成较大的经济损失.2009年,浙江师范大学分子生物学实验室从金华市锦林佛手有限公司佛手炭疽病病样中分离得到一株病原真菌,经常规形态学和分子rDNAITS(内转录间隔区)鉴定,确定为胶孢炭疽菌(Colletotrichum gloeosporioide).本文主要对该病原菌的生物学特性进行了研究.
1 材料与方法
1.1 实验材料
从金华市锦林佛手公司基地采集佛手炭疽病病样,在浙江师范大学分子生物学实验室,采用单孢分离法进行病原菌分离纯化,PDA培养基培养,4℃保存.
1.2 培养基
马铃薯葡萄糖琼脂(PDA)培养基;胡萝卜培养基(CA);燕麦培养基(OA);玉米粉培养基(CMA);查氏(Czapek)培养基(CZ).配方见文献[1].
1.3 实验方法
接种菌种于PDA培养基中,于25℃生化培养箱中培养3 d,用灭菌打孔器打取菌落边缘,打取直径5 mm的菌饼,用于以下实验.
1.3.1 培养基对菌丝生长的影响
分别接种菌饼于 PDA,CA,OA,CMA,CZ 和水琼脂平板中央,且菌丝面朝下放置,25℃生化培养箱中培养(下同).每天用十字交叉法测量菌落直径,每处理 5 次重复[2](下同).
1.3.2 温度对菌丝生长和孢子萌发的影响
接种菌饼至PDA培养基中央,分别在5,10,20,25,28,35 和 40 ℃的恒温条件下培养 5 d,观察菌丝生长情况,每天测量菌落直径.将PDA平板上培养7 d产生的分生孢子用无菌水洗下,配制成低倍镜下每视野20~30个孢子的悬浮液(下同).将孢子悬浮液滴于凹玻片上,分别置于5~40℃的 7种温度下保湿培养[3],并于 6,14和24 h后取出,观察孢子萌发情况,计算孢子萌发率.
1.3.3 pH对菌丝生长和孢子萌发的影响
用1 mol/L NaOH溶液和1 mol/L HCl溶液调节灭菌后未凝固PDA培养基的pH,制成pH值分别为3,4,5,6,7,8,9,10 和 11 共 9 种培养基,制平板后,接种菌饼至平板中央,28℃恒温培养.连续5 d测量菌落直径,求其平均菌落直径.
用1 mol/L NaOH溶液和1 mol/L HCl溶液配制 pH 值分别为 3,4,5,6,7,8,9,10 和 11 的9种缓冲溶液,用于配制孢子悬浮液,滴于凹玻片上,28℃黑暗条件下保湿培养6,14和24 h后,镜检并统计孢子萌发率.
1.3.4 光照对菌丝生长的影响
设置连续光照、12 h明暗交替和完全黑暗3种光照条件,菌饼接种于PDA培养基上,28℃培养5 d后,测量菌落直径.
1.3.5 致死温度的测定
取在PDA平板上已活化培养5 d的病原菌,先加入少量无菌水至培养基上,用灭菌三角玻璃棒刮取菌丝体,然后用灭菌双层纱布过滤菌液,滤液为菌丝和分生孢子混合悬浮液.取灭菌具塞玻璃试管,分别置于 40,45,50,55,60 和 65 ℃ 恒温水浴锅中,当试管内温度达到设定温度时,加入2 mL病原菌悬浮液,水浴10 min,一支试管在室温中放置作为对照.各取0.2 mL经过处理的病原菌悬浮液,涂在PDA培养基上,28℃培养,48 h后观察有无菌落出现.
1.3.6 葡萄糖对孢子萌发的影响
刮取PDA培养基上病原菌分生孢子,分别放入有 0.1%,0.5%,1%,2%,3%,4% 和 5% 葡萄糖溶液的凹玻片上,轻轻搅动,形成孢子悬浮液.将凹玻片放入垫有湿润滤纸的培养皿中,置于黑暗条件下28℃的恒温培养箱中培养.在显微镜下观察和统计不同时间孢子的萌发率.
1.4 数据分析
采用DPS V7.05数据分析软件进行Duncan氏新复极差法检验;EXCEL 2003进行数据处理和图表制作.
2 结果与分析
2.1 培养基对菌丝生长的影响
从表1可知,除水琼脂培养基外,佛手炭疽病病原菌在其余5种培养基上都能生长.在PDA培养基上生长最好,气生菌丝丰富,产孢较多;在CA,OA和CMA培养基上次之;在CZ培养基上生长较差,菌落生长速度慢,气生菌丝较少.说明该病原菌适宜在半合成培养基上生长.水琼脂培养基只含有微量的营养和矿物质,不能满足病原真菌的生长需求.
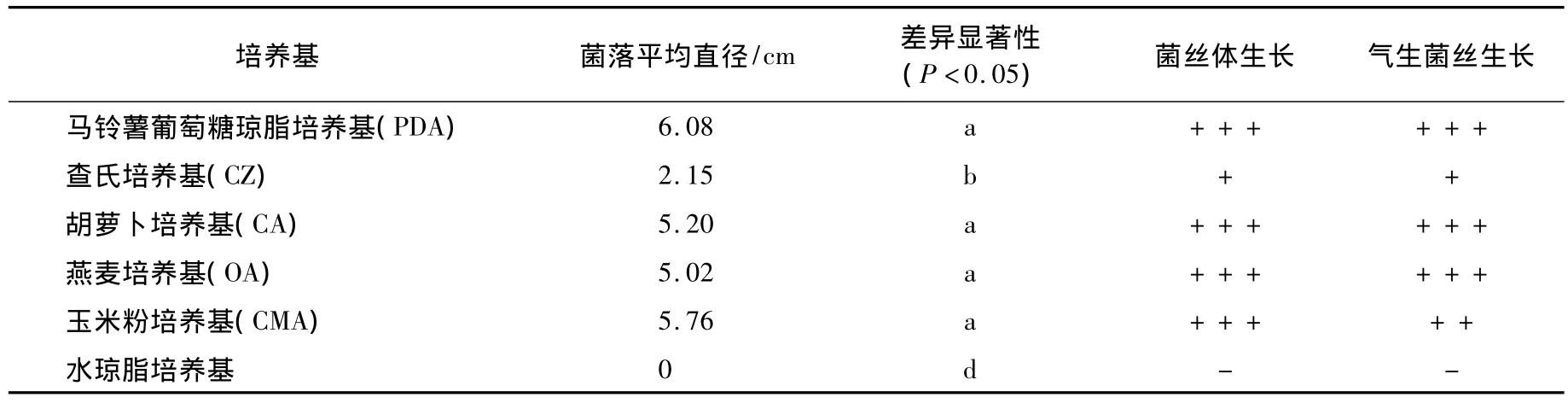
表1 培养基对佛手炭疽病病原菌菌丝生长的影响
2.2 温度对菌丝生长和孢子萌发的影响
温度对佛手炭疽病病原真菌菌丝生长的影响较大(见表2).培养温度在5~40℃时,菌丝均可生长;在5~28℃时,菌丝的生长速率随着温度的升高而加快,至28℃时菌丝生长速度最快,培养5 d平均菌落直径达5.95 cm;28℃以上,菌丝生长速率逐渐降低.在5和40℃下培养5 d,菌落直径分别为1.03和1.29 cm,有少量菌丝萌发,菌丝生长势很差.因此,该病原菌菌丝生长的最佳温度范围为25~28℃,最适温度为28℃.
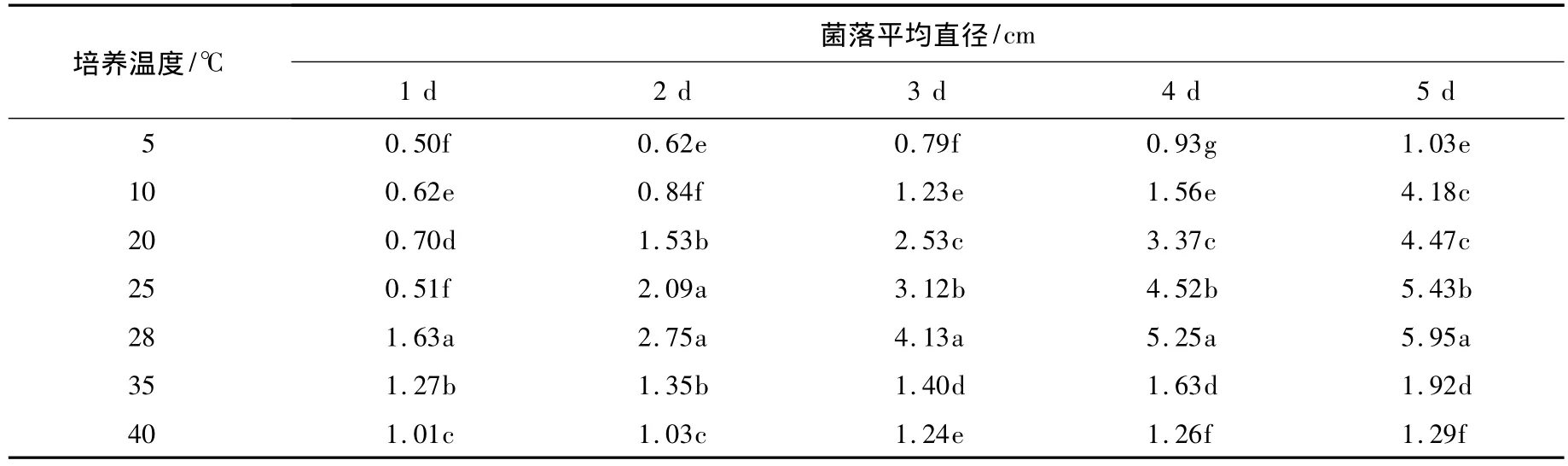
表2 温度对佛手炭疽病病原菌菌丝生长的影响
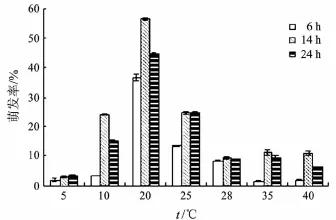
图1 温度对佛手炭疽病病原菌孢子萌发的影响
图1 显示了不同培养温度对佛手炭疽病病原菌孢子萌发的影响.在5~40℃,其孢子均可萌发,且随着培养时间的延长,萌发率升高.但是,与温度对菌丝生长的影响不同,孢子萌发的最适温度为20℃.在20℃下,孢子培养14 h的萌发率远远高于培养6 h和24 h的萌发率.
2.3 pH对菌丝生长和孢子萌发的影响
不同酸碱度的PDA培养基对佛手炭疽病病原菌菌丝生长的影响见图2.病原真菌在pH 3~11的培养基上均能生长,在pH 4~9生长较好,最适生长pH值为7,培养5 d平均生长速率为6.40 cm/d.
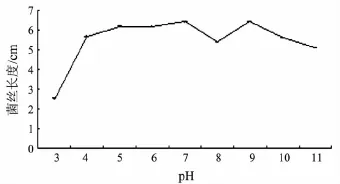
图2 pH对佛手炭疽病病原菌菌丝生长的影响
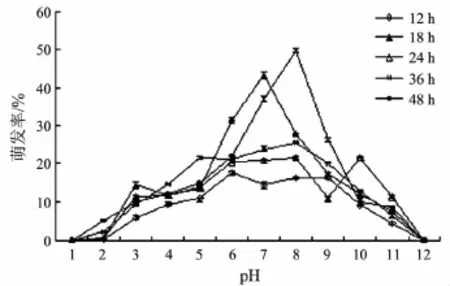
图3 pH对佛手炭疽病病原菌孢子萌发率的影响
图3 显示培养基pH对佛手炭疽病病原菌孢子萌发率的影响显著.由图3可知:分生孢子在pH 2~11培养12~48 h都能产孢;而且在一定的酸碱度条件下,随着培养时间的延长,孢子萌发率升高.但是,孢子萌发率随pH的变化而变化.在pH 6~9时,孢子萌发率较高;在 pH 8时培养48 h,孢子萌发率最高,为52.7%;当 pH值为1和12时,孢子均不能萌发.
2.4 光照对菌丝生长的影响
佛手炭疽病病原菌在不同的光照条件下生长速率不同.在培养5 d后,菌落生长速率大小为黑暗条件>持续光照>半光半暗(见图4),生长速率最快为 1.29 cm/d.
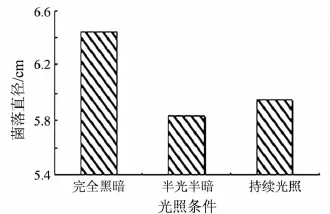
图4 光照对佛手炭疽病病原菌菌丝生长的影响
2.5 致死温度的测定
佛手炭疽病病原菌悬浮液经40~60℃水浴处理10 min后,部分菌丝仍能正常生长;65℃以上温度处理后,菌丝完全停止生长,说明病原菌的致死温度为65℃.
2.6 葡萄糖对孢子萌发率的影响
不同含量的葡萄糖溶液中佛手炭疽病病原菌孢子萌发实验显示(见图5):在相同的培养时间内,孢子萌发率基本随着葡萄糖含量的加大而降低;在相同含量的葡萄糖溶液中,孢子萌发率则随着培养时间的延长而加大.不同含量的葡萄糖处理对孢子萌发率的影响差异显著.培养36 h后,孢子萌发率在葡萄糖含量较低与较高之间的差异趋于减小.实验结果说明葡萄糖能够促进其分生孢子的萌发.在葡萄糖质量分数为0.1%,培养48 h时,孢子的萌发率最高.
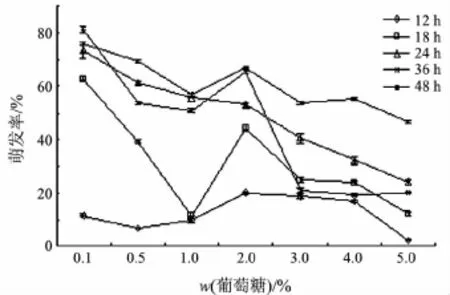
图5 葡萄糖含量对佛手炭疽病病原菌孢子萌发的影响
3 讨论
佛手是金华地区的一种传统经济植物,已有700多年的栽培历史.据金华市相关部门统计,2006年佛手最高亩产纯利润可达20余万元.近年,国内外对佛手的研究多集中于佛手的栽培[4]、化学成分的提取和分析[5]、转基因研究[6-9]等方面,对佛手病原菌的研究甚少.本文对佛手炭疽病病原菌的生物学特性进行了首次研究报道.
微生物的生长需要一定的营养条件.不同的培养基对菌丝生长影响的研究发现,佛手炭疽病病原真菌在半合成培养基(PDA)上生长速率最快,在合成培养基(CZ)上则生长势较差.这与谢丙炎等[10]对辣椒炭疽病菌(C.capsici)的研究结果一致.贺春萍等[11]对红毛丹炭疽病菌(C.gloeosporioides)的研究却认为,病原菌无论是在PDA还是CZ培养基上生长势都较好.Estrada等[12]报道芒果炭疽病菌(C.gloeosporioides)的最适生长温度为28℃,致死温度为65℃ 10 min,与本文的研究结果一致.佛手炭疽病病原真菌在pH 3~11均可生长,中性偏酸条件下菌丝生长较快,pH值为7时生长最好,符合真菌对酸度的适应范围广并偏好略带酸性环境的特性[1].真菌孢子的萌发受内在因子和环境条件的影响.佛手炭疽病菌的孢子萌发最适温度为20℃,孢子萌发最适pH值为6~9,与其他关于胶胞炭疽菌的相关报道[10-12]不同.
炭疽菌属是一类十分重要的植物病原真菌,在热带、亚热带地区危害严重,给农业生产带来巨大的损失.本文研究结果表明,佛手炭疽病病原真菌和其他不同来源的炭疽病病原真菌的生物学特性存在一定的差异,这可能与菌株的变异有关,需要进一步的研究证实.此外,该病原真菌对酸碱和高温的适应性很强,在逆境中具有较高的生存能力,加大了防治难度.今后的研究应在病原菌侵染机理和病害防治等方面展开.
[1]方中达.植病研究方法[M].3版.北京:中国农业出版社,1998:119-153.
[2]何凡,范鸿雁,罗霓,等.番木瓜炭疽病病原菌鉴定及生物学特性研究[J].西南农业学报,2010,23(3):752-755.
[3]蔡吉苗,李超萍,时涛,等.木薯炭疽病病原菌鉴定及其生物学特性研究[J].安徽农业科学,2010,38(10):5435-5438;5467.
[4]石健泉,蒋运宁.佛手特征及栽培技术[J].广西园艺,2006,17(1):20-22.
[5]赵磊,籍保平,周峰,等.十二种金华佛手挥发油成分的比较研究[J].食品科学,2006,27(6):179-184.
[6]周春丽,郭卫东,王德解,等.利用GUS基因瞬时表达探索佛手叶盘基因枪转化参数[J].西北植物学报,2005,25(11):2145-2150.
[7]郭卫东,路梅,周春丽,等.佛手137CS-γ射线辐射效应研究[J].浙江农业科学,2006(1):31-33.
[8]马伯军,陈镖,陈文静,等.佛手RAPD扩增系统的建立[J].浙江师范大学学报:自然科学版,2004,27(2):158-161.
[9]郭卫东,周春丽,路梅,等.Gus基因在佛手叶片中的瞬间表达[J].浙江师范大学学报:自然科学版,2005,28(4):425-428.
[10]谢丙炎,欧阳本友,欧阳丰.辣椒炭疽病菌生物学特性的研究[J].微生物学报,1992,19(6):321-324.
[11]贺春萍,吴伟怀,余贤美.红毛丹炭疽病菌生物学特性研究[J].热带作物学报,2010,31(2):253-258.
[12]Estrada A B,Dodd J C,Jeffries P.Effect of humidity and temperature on conidial germination and apperssorium development of two philippine isolates of the mango anthracnose pathogen Colletotrichum gloeosporioides[J].Plant Pathology,2000,49:608-618.

