抑癌基因DPC4和TGF-β1在膀胱尿路上皮癌中的表达和意义
陕 光 唐 甜
抑癌基因DPC4和TGF-β1在膀胱尿路上皮癌中的表达和意义
陕 光 唐 甜1*
(武汉大学人民医院泌尿Ⅱ科;1武汉大学人民医院肿瘤Ⅱ科 湖北430060)
目的 探讨膀胱尿路上皮癌中TGF-β1和DPC4的表达及其意义。方法 收集武汉大学人民医院病理科2000-2006年有完整临床和病理资料的膀胱尿路上皮癌存档蜡块50例和5例癌旁组织,采用免疫组织化学S-P法检测50例膀胱尿路上皮癌和5例癌旁组织中DPC4和TGF-β1的表达水平。采用HPIAS-1000高清晰度彩色病理图文报告管理系统,对DPC4和TGF-β1的表达进行定量分析,并用SPSS13.0软件对各组免疫组织化学反应阳性颗粒的平均光密度、阳性面积率做单因素方差分析和SNK(q)检验。结果 (1)TGF-β1在膀胱尿路上皮癌中呈高表达,癌旁组织中呈低表达。膀胱尿路上皮癌与癌旁组织相比,差异有显著性 (P<0.05);(2)DPC4在膀胱尿路上皮癌中呈低表达,癌旁组织中呈高表达。膀胱尿路上皮癌与癌旁组织相比,差异有显著性 (P<0.05)。结论 TGF-β1高表达和DPC4低表达可能促进肿瘤细胞发生免疫逃逸。在膀胱尿路上皮癌的发生和发展中发挥了重要作用。
膀胱尿路上皮癌;DPC4;TGF-β1;免疫组织化学
膀胱癌在男性恶性肿瘤中位居第4位,女性恶性肿瘤中位居第8位[1]。膀胱癌发病率及死亡率近年来均呈现上升趋势,可能与吸烟、职业、大气污染及饮食结构的改变等有关,但确切病因还有待进一步探索。
转化生长因子β(Transforming growth factorβ,TGF-β)超家族成员是在发育和组织内环境稳定中起中枢作用的多功能生长因子[2],具有调节细胞生长、死亡或凋亡、细胞分化和细胞外基质合成等不同的生物学功能。TGF-β被认为是病理状态下细胞外基质积聚导致组织纤维化的关键调节因子[3]。
TGF-β最显著的生物学效应是对上皮细胞的生长抑制,此外还包括对分化与凋亡的诱导及对遗传物质稳定性的维持。当肿瘤细胞丧失对TGF-β生长抑制的敏感性,过多产生的TGF-β可能作用于肿瘤细胞和基质细胞,产生侵润和转移,诱导血管的生成,抑制抗肿瘤免疫反应[4]。DPC4基因在TGF-β信号通路中编码一个关键的细胞内信使,可以假设:DPC4基因的缺失在肿瘤的发展中解除了TGF-β信号途径的生长抑制效应。
DPC4基因的主要功能是作为序列保守的SMADs蛋白家族中的一员,参与转化生长因子TGF-β超家族在细胞内的信号传导,在TGF-β超家族的信号传导途径中处于中枢地位。研究表明,DPC4以缺失与失活和某些肿瘤的发生与发展具有密切的联系[5]。
我们通过免疫组织化学方法试图探讨二者与膀胱移行细胞癌的关系,以期能进一步阐明膀胱癌发生发展的分子生物学机理,寻找早期预测膀胱癌发生发展的分子生物学标记物,为膀胱癌的发生和复发的预测提供一定的参考依据。
材料和方法
1.材料
收集武汉大学人民医院病理科2004-2006年膀胱尿路上皮癌存档蜡块50例(均经病理学证实为膀胱尿路上皮癌),其中男性38例,女性12例,平均年龄50.3岁,另5例癌旁组织距瘤缘3-5cm。标本均经HE染色,光镜观察诊断,按WHO尿路肿瘤组织学分类(2004),浸润性尿路上皮癌30例,非浸润性乳头状尿路上皮癌;高级别15例,低级别5例;按UICC临床分期,T1 31 例,T2 11 例,T3-4 8例。其中未经化疗的初发肿瘤28例,化疗后复发肿瘤22例。
2.方法
HE染色 常规取材、固定、脱水、透明、包埋、切片、HE染色及封片
3.主要试剂
3.1 即用型兔抗人TGF-β1多克隆抗体;(北京中杉生物技术有限公司);
3.2 即用型兔抗人DPC4多克隆抗体;(北京中杉生物技术有限公司);
3.3 超敏即用型SP通用型免疫组织化学试剂盒;(北京中杉生物技术有限公司);
3.4 DAB显色试盒及多聚赖氨酸(北京中杉生物技术有限公司)
4免疫组织化学SP法检测TGF-β1和DPC4相关抗原
具体步骤:5μm组织切片常规脱蜡至水后,0.01MPBS(pH 7.4)漂洗3×3min;抗原修复,室温自然冷却后,0.01MPBS(pH 7.4)漂洗5×3 min;滴加3%过氧化氢,37℃湿盒孵育10min以抑制内源性过氧化物酶活性,0.01MPBS(pH 7.4)漂洗3×3min;正常羊血清37℃湿盒孵育10min以减少非特异性背景;甩去多余血清,分别滴加一抗,4℃孵育过夜,0.01MPBS(pH 7.4)漂洗3×5min;滴加生物素标记的二抗37℃湿盒孵育10min,0.01M PBS(pH 7.4)漂洗3×3min;滴加链霉素抗生物素蛋白-过氧化物复合物37℃湿盒孵育10min,0.01M PBS(pH 7.4)漂洗3×3min;滴加新鲜配置的DAB显色液显色,光镜下控制反应时间(约3-5min),自来水冲洗终止反应;苏木素复染,流水冲洗,1%盐酸酒精分色数秒,流水冲洗,0.1%氨水返蓝;梯度酒精脱水,二甲苯透明,中性树胶封片并镜检;用PBS代替一抗作为阴性对照组,购买的阳性片作为TGF-β1和DPC4的阳性对照组。
5.免疫组织化学结果判断
5.1 TGF-β1和DPC4以细胞核或胞质出现棕黄色颗粒为阳性反应,阴性对照组除细胞核染成蓝色外,应无棕黄色反应物。
5.2 采用HPIAS-1000高清晰度彩色病理图文报告管理系统(同济千屏影像公司)对TGF-β1和DPC4的表达进行定量分析,每张切片随机选取5个完整而不重叠的高倍镜视野(×400),测定每个视野下阳性反应的平均光密度、阳性反应面积和所有细胞总面积,计算阳性面积率。以每例5个视野的平均光密度、阳性面积率的平均值作为该例的测量值。(阳性面积率=单位面积中阳性反应的总面积/单位面积中细胞的总面积×100%)
6.统计学处理
对各组免疫组织化学反应阳性颗粒的平均光密度、阳性面积率作单因素方差分析和q检验,检验水准α为0.05。
结 果
1.TGF-β1的表达
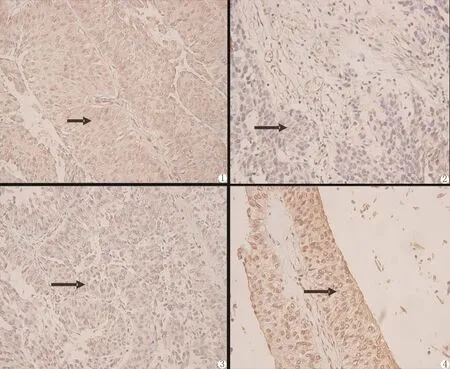
膀胱尿路上皮癌细胞内可见较多棕黄色颗粒,TGF-β1呈阳性表达(图1);癌旁组织胞核内可见少量的棕黄色颗粒,TGF-β1表达弱,呈阴性表达(图2)。图像分析结果见表1。经q检验,膀胱尿路上皮癌与癌旁组织之间,TGF-β1的平均光密度及阳性面积率有显著性差异(P<0.05),(表1)。
2.DPC4的表达
膀胱尿路上皮癌细胞中可见少量的棕黄色颗粒,DPC4表达弱(图3);癌旁组织中可见密集分布的棕黄色颗粒,DPC4呈阳性表达(图4)。图像分析结果见表2。经q检验,膀胱尿路上皮癌与癌旁组织之间,DPC4的平均光密度及阳性面积率有显著性差异(P<0.05)(表2)。

表1 膀胱尿路上皮癌和癌旁组织TGF-β1表达的平均光密度和阳性面积率(¯x±s)Table 1 The average optical density and the rate of positive area of TGF-β1in SBladder Urothelial Cancer and cancer side tissue(¯x±s)
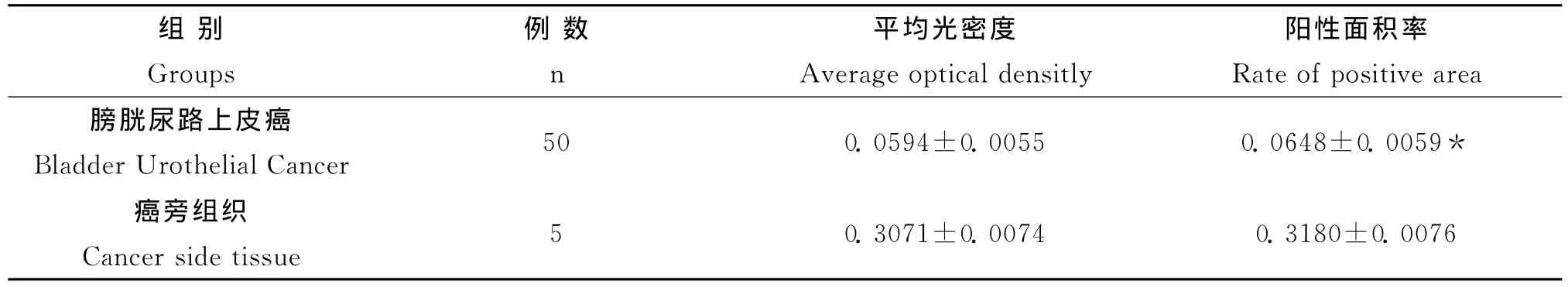
表2 膀胱尿路上皮癌和癌旁组织DPC4表达的平均光密度和阳性面积率(¯x±s)Table 2 The average optical density and the rate of positive area of DPC4in bladder urothelial cancer and cancer side tissue(¯x±s)
讨 论
膀胱癌是泌尿系统最常见的恶性肿瘤,目前发病率呈上升趋势,且复发率高,易产生获得性耐药。膀胱癌是泌尿系统最常见的肿瘤,初发时80%为浅表性,其中70%术后复发,复发者30%向高级高期发展,15%-30%的患者初发时即具有侵袭性,即使经过治疗,也较早转移[6]。因此,研究与膀胱癌发生发展的分子生物学机理,寻找早期预测膀胱癌发生发展的分子生物学标记物,为膀胱癌的发生和复发的预测提供一定的参考依据具有重要的临床意义。
转化生长因子β(TGF-β)是一簇属结构相关的异二聚体多肽,他能够调节细胞增殖、分化、形态形成、凋亡等病理过程及刺激细胞外基质分泌,抑制免疫反应等[7-9],TGF-β信号转导通路的异常与肿瘤关系密切 .该通路的异常常见于一些来源于上皮细胞肿瘤发展的晚期,并且常与肿瘤的侵袭及转移有关.其中TGF-β1是这一家族的主要成员 .TGF-β信号可抑制B细胞Ig的合成,TGF-β1在肿瘤细胞中过表达能够破坏宿主T细胞介导的细胞毒性作用,并引起CTL(cytolyic T cell)反应,纵容了肿瘤的进一步发展[10-12]。
目前认为,TGF-β1在肿瘤的发展中扮演了双重角色,早期当细胞对TGF-β1的抗增殖效应仍有反应时,TGF-β1起着肿瘤抑制作用;而在恶性演进期,当细胞获得了对TGF-β1生长抑制作用的耐受性时,肿瘤细胞可自分泌大量的TGF-β1,通过改变肿瘤组织的微环境,如诱导肿瘤血管生成,提高肿瘤细胞的运动能力,免疫抑制及胞外基质的合成等来促进肿瘤的发展及转移[13-15]。
TGF-β信号转导途径是机体内抑制细胞生长、增殖和分化的有效途径,但在许多研究中发现肿瘤细胞对TGF-β失去反应而逃避TGF-β信号转导途径的生长抑制作用,这种反应的丢失不仅与TβR-Ⅱ,Smad 2等信号分子的失活有关,而且与DPC4的变异密切相关[16-17]。
抑癌基因DPC4是一种肿瘤抑制基因。其所编码的Smad4蛋白是转导TGF-β1信号的重要胞质内信号级联分子,调节 TGF-β1应答基因的转录.Smad4功能失活或表达低下影响TGF-β1的信号转导并参与肿瘤的形成[12]。相关报道研究发现Smad4在多种肿瘤如胆囊癌、口腔鳞癌、膀胱癌等表达下调,并可调控T G F-β细胞信号传导通路,抑制肿瘤细胞生长[18-20]。
我们采用免疫组织化学的方法,对膀胱尿路上皮癌组织中TGF-β1和DPC4的表达进行检测,旨在探讨他们与膀胱尿路上皮癌发生发展的关系。结果表明:TGF-β1在膀胱尿路上皮癌中呈高表达,癌旁组织中呈低表达。而DPC4在膀胱尿路上皮癌中呈低表达,癌旁组织中呈高表达。提示:DPC4基因的缺失或突变阻断了TGF-β1抑制肿瘤生长的转导通路,而这种阻断作用又可能通过负反馈作用使肿瘤细胞自分泌TGF-β1增加,二者可能共同调节恶性肿瘤的发生发展及生物学行为。
TGF-β1和DPC4是TGF-β转导通路中起重要作用的关键因子,TGF-β1高表达和DPC4低表达可作为膀胱尿路上皮癌预后不良的指标。同时DPC4在TGF-β1信号转导中具有关键作用,其缺失或突变可使细胞对TGF-β1的生长抑制产生耐受,促进肿瘤的发展。
DPC4在膀胱尿路上皮癌中的低表达也说明TGF-β1抑制肿瘤生长的转导通路被阻断,这种阻断作用在转录过程中以及显现。这种阻断作用可能同时还是TGF-β1在肿瘤中高表达的原因。由于膀胱尿路上皮癌组织细胞失去了对TGF-β1的敏感性,导致TGF-β1的反馈性表达升高,而升高的TGF-β1表达失去抑制肿瘤生长的作用,却没有丧失对NK,LAK等免疫细胞的抑制作用,因此TGF-β1高表达和DPC4低表达可能促进肿瘤细胞发生免疫逃逸。其确切机制有待进一步探讨。
[1]Yakasai A,Allam M,Thompson AJ,et al.Incidence of bladder cancer in a one-stop clinic.Ann Afr Med.2011,10(2):112-114
[2]Cheng J,Grande J P.Transforming growth factor-beta signal transduction and progressive renal disease.Exp Biol Med(Maywood),2002,227(11):943-956
[3]Choi ME.Mechanism of transforming growth factor-betal signaling.Kidney Int,Supp1.2000,77:S53-58
[4]Langenskiold M,Holmdahl L,Falk P,et al.Increased TGF-beta 1protein expression in patients with advanced colorectal cancer.J Surg Oncol 2008,97:409-415
[5]Schwarte-Waldhoff I,Volpert OV,Bouck NP,et al.Smad4/DPC4-mediated tumor suppression through suppression of angiogenesis.Proc Natl Acad Sci U S A 2000,97:9624-9629
[6]Vlahou A.Back to the future in bladder cancer research.Expert Rev Proteomics.2011Jun,8(3):295-297
[7]Zhu Y,Shen J,Hu YY,et al.Transforming growth factor-β1regulates renalα3andβ1integrin expressions in diabetic rats:a new insight into the renoprotective effect of irbesartan.Nan Fang Yi Ke Da Xue Xue Bao.2011,20;31(6):1059-1062
[8]Wang J,Chen J,Zhang K,et al.TGF-β1regulates the invasive and metastatic potential of mucoepidermoid carcinoma cells.J Oral Pathol Med.2011,21.doi:10.1111/j.1600-0714.
[9]Toffoli B,Pickering RJ,Tsorotes D,et al.Osteoprotegerin promotes vascular fibrosis via a TGF-β1autocrine loop.Atherosclerosis.2011,May 27
[10]Shi M,Zhu J,Wang R,Chen X,et al.Latent TGF-β structure and activation.Nature.2011,474(7351):343-349
[11]Walshe TE,Leach LL,D'Amore PA,et al.TGF-βsignaling is required for maintenance of retinal ganglion cell differentiation and survival.Neuroscience.2011,May 27
[12]Hartmann MC,Dwyer RM,Costello M,et al.Relationship between CCL5and transforming growth factorβ1(TGFβ1)in breast cancer.Eur J Cancer.2011,Jun 7
[13]Ritz MF,Graumann U,Gutierrez B,et al.Traumatic spinal cord injury alters angiogenic factors and TGF-beta1that may affect vascular recovery.Curr Neurovasc Res.2010,7(4):301-310
[14]Abarbanell AM,Coffey AC,Fehrenbacher JW,et al.Proinflammatory cytokine effects on mesenchymal stem cell therapy for the ischemic heart.Ann Thorac Surg.2009,88(3):1036-1043
[15]Kim HJ,Park JB,Won HY,Chang H,et al.Serum Levels of TGF-beta1,TIMP-1and TIMP-2in Patients with Lumbar Spinal Stenosis and Disc Herniation.Asian Spine J.2007,1(1):8-11
[16]Ghosh J,Murphy MO,Turner N,et al.The role of transforming growth factor beta1in the vascular system.Cardiovasc Pathol.2005,14(1):28-36
[17]BÖttner M,Krieglstein K,Unsicker K,et al.The transforming growth factor-betas:structure,signaling,and roles in nervous system development and functions.J Neurochem.2000,75(6):2227-2240
[18]Liffers ST,Maghnouj A,Munding JB,et al.Keratin 23,a novel DPC4/Smad4target gene which binds 14-3-3ε.BMC Cancer.2011,14;11:137
[19]Hao J,Zhang S,Zhou Y,et al.MicroRNA 421suppresses DPC4/Smad4in pancreatic cancer.Biochem Biophys Res Commun.2011,25;406(4):552-557
[20]Nikolic A,Kojic S,Knezevic S,et al.Structural and functional analysis of SMAD4gene promoter in malignant pancreatic and colorectal tissues:Detection of two novel polymorphic nucleotide repeats.Cancer Epidemiol.2011,35(3):265-271
图 版 说 明
图1 TGF-β1的表达:膀胱尿路上皮癌组 细胞核和胞浆内可见较多棕黄色颗粒,TGF-β1呈阳性表达(➨)。SP×200
图2 TGF-β1的表达:癌旁组织 细胞核和胞浆内可见少量的棕黄色颗粒,TGF-β1呈阴性表达(➨)。SP×200
图3 DPC4的表达:膀胱尿路上皮癌组 细胞核和胞浆内可见少量的棕黄色颗粒,DPC4呈阴性表达(➨)。SP×200
图4 DPC4的表达:癌旁组织 细胞核和胞浆内可见较多棕黄色颗粒,DPC4呈阳性表达(➨)。SP×200
EXPLANATION OF FIGURES
Fig.1 The expression of TGF-β1bladder urothelial cancer group:There were plenty of brown particles in the nucleus or cytoplasm,which showed TGF-β1expressed positive.S-P×200
Fig.2 The expression of TGF-β1:cancer side tissue.There were few brown particles in the nucleus or cytoplasm,which showed TGF-β1expressed negative.S-P×200
Fig.3 The expression of DPC4:bladder urothelial cancer group:There were few brown particles in the nucleus or cytoplasm,which showed DPC4expressed negative.S-P×200
Fig.4 The expression of DPC4:cancer side tissue:There were plenty of brown particles in the nucleus or cytoplasm,which showed DPC4expressed positive.S-P×200
Expression and significance of DPC4and TGF-β1in Bladder Urothelial Cancer
Shan Guang,Tang Tian1*
(Department of Urology,Renmin Hospital of Wuhan University;1Department of Oncology,Renmin Hospital of Wuhan University,Hubei 430060,China)
ObjectiveTo investigate the expression and significance of DPC4and TGF-β1in bladder urothelial cancer tissues.MethodsFifly cases of bladder urothelial cancer,parafflin-embeded specimen and 5cases of normal tissues near the bladder urothelial cancer,which were all filed in full pathological and clinical data,were collected from the pathology department of the People Hospital of Wuhan University between 2000and 2006.The expression of DPC4and TGF-β1were detected by immunohistochemical S-P method.Quantitative analysis of the DPC4and TGF-β1were measured by high definition pathological graphics context report system (HPIAS-1000).One-way analysis of variance and SNK(q)tests were used to analyse the mean density and the positive area rate of the immunohistochemical results.All data are processed by SPSS13.0.Results(1)The expression of TGF-β1in bladder urothelial cancer was significantly higher than that in cancer side tissue(P<0.05).(2)The expression of DPC4in cancer side tissue was significantly higher than that in bladder urothelial cancer(P<0.05).ConclusionThe high expression of TGF-β1and the low expression of DPC4may promote the immuneescape of tumor cells.and the high expression of TGF-β1and the low expression of DPC4played an important role in bladder urothelial cancer development.
Bladder Urothelial Cancer;TGF-β1;DPC4;Immunohistochemistry
R735.2
A
10.3870/zgzzhx.2011.05.014
2011-06-10
2011-08-01
陕光,男(1980年),汉族,博士,主治医师。
*通讯作者(To whom correspondence should be addressed)

