金银花根围AM真菌分布与土壤碳氮关系
张翔鹤,贺学礼 ,王雷
(河北大学 生命科学学院,河北 保定 071002)
金银花根围AM真菌分布与土壤碳氮关系
张翔鹤,贺学礼 ,王雷
(河北大学 生命科学学院,河北 保定 071002)
为充分利用AM真菌资源促进中药材生长,2010年7-12月,连续从河北省安国市药材种植基地采集金银花(Lonicerajaponica)根围土壤样品,系统研究了AM真菌时空分布及其与土壤碳氮含量的相关性.结果表明,金银花能与AM真菌形成良好共生关系;AM真菌最大孢子密度为59.02g-1,最高定殖率为97%;孢子密度随时间呈升-降趋势,随土层加深而递减;总定殖率随时间呈升-降趋势,随土层变化不显著.总球囊霉素与孢子密度极显著正相关;易提取球囊霉素与孢子密度、菌丝定殖率和总定殖率极显著正相关,与泡囊定殖率极显著负相关.球囊霉素与土壤有机C和全N极显著正相关.结果说明,球囊霉素是土壤碳氮的重要来源,球囊霉素的积累效应对土壤质量提升有积极作用.
AM真菌;球囊霉素;时空分布;土壤碳氮含量;金银花
AM(arbuscular mycorrhiza)真菌广泛分布于陆地生态系统中,能与绝大多数植物形成共生关系,根外菌丝在土壤中形成庞大菌丝网络系统,有利于宿主植物根系吸收更多养分和水分,改善植物矿质营养和水分代谢,提高植物抗旱性和成活率,促进植株生长[1-4].球囊霉素(glomalin)是AM真菌分泌的一类含有金属离子的糖蛋白,其生物学特性和理化性质特殊,在土壤生态系统中具有重要生态学功能[5].研究表明,土壤有机C与球囊霉素有显著正相关性[6-7].随着对球囊霉素的深入研究可进一步明确AM真菌在生态系统中的功能和地位[7-11].
金银花(Lonicerajaponica)为忍冬科忍冬属半常绿缠绕藤本,兼药用、观赏和园林绿化等功能为一身.其茎叶、花蕾及果实均可入药,人们熟知的“银翘解毒丸”、“银黄口服液”,就是以金银花为主要原料制成.金银花根系发达,枝条多,叶面密度大,具有良好的水土保持功能.有关金银花的研究主要集中在化学成分、药理药效等方面,而与其共生的AM真菌分布和活动未见报道.
本实验通过对金银花根围土壤样品的采集和分析,研究了AM真菌和球囊霉素时空分布及其与土壤有机C和全N的关系,以便为充分利用AM真菌资源促进中药材生长,深入研究土壤碳固持问题提供依据.
1 材料与方法
1.1 研究区域概况
安国市位于河北省中部太行山山麓平原,东经115°20′,北纬38°24′,属于半湿润季风气候,年均气温12.2℃,≥10℃的积温4 349℃,年均降水量570mm,年无霜期约210d,适合野生和人工栽培中药材植物生长.
1.2 样品采集
2010年7-12月,每月下旬在样地内随机选取金银花4株,在距植株0~30cm处挖土壤剖面,按0~10cm,11~20cm和21~30cm 3个土层采集土样,每份土样约1kg,编号装袋密封,在实验室过2mm筛后,土样用于土壤理化性质和AM真菌孢子测定,根样用于AM真菌定殖率测定.
1.3 测定方法
AM真菌定殖率按Philips和Hayman方法[12]测定,即定殖率=(AM真菌感染根段数/检查总根段数)×100%.从每份土样中称取20g风干土,用湿筛倾析-蔗糖离心法[13]分离AM真菌孢子,在体视显微镜下记录孢子数量,将每g风干土中含孢量计为孢子密度.
土壤全N用半微量凯式定氮法测定[14],土壤有机C用马弗炉法测定[15],土壤pH值用电位法测定.
球囊霉素按 Wright等[16]方法测定.易提取球囊霉素(EEG):取1g风干土于试管中,加入8mL、20mmol/L(pH 7.0)柠檬酸钠浸提剂,在103kPa,121℃条件下连续提取30min后,在10 000g下离心15min,收集上清液;总球囊霉素(TG):取1g风干土于试管中,加入8mL,50mmol/L(pH 8.0)柠檬酸钠浸提剂,在103kPa,121℃条件下连续提取60min,再重复提取2次,10 000g下离心15min,收集上清液.分别吸取上清液0.5mL加入5mL考马斯亮蓝G-250染色剂,在595nm波长下比色.用牛血清蛋白标液,考马斯亮蓝法显色,绘制标准曲线,求出球囊霉素含量.
采用Excel 2003和SPSS 17.0统计软件对实验结果进行分析.
2 结果与分析
2.1 菌根结构类型
实验结果发现,金银花根系能与AM真菌形成良好共生关系,菌根结构为疆南星型(Arum-type,A-型).菌丝在宿主根皮层细胞间延伸生长,形成大量胞间菌丝,并侧向分支进入细胞内发育成典型丛枝结构,在细胞内和细胞间隙发育有泡囊(图1).
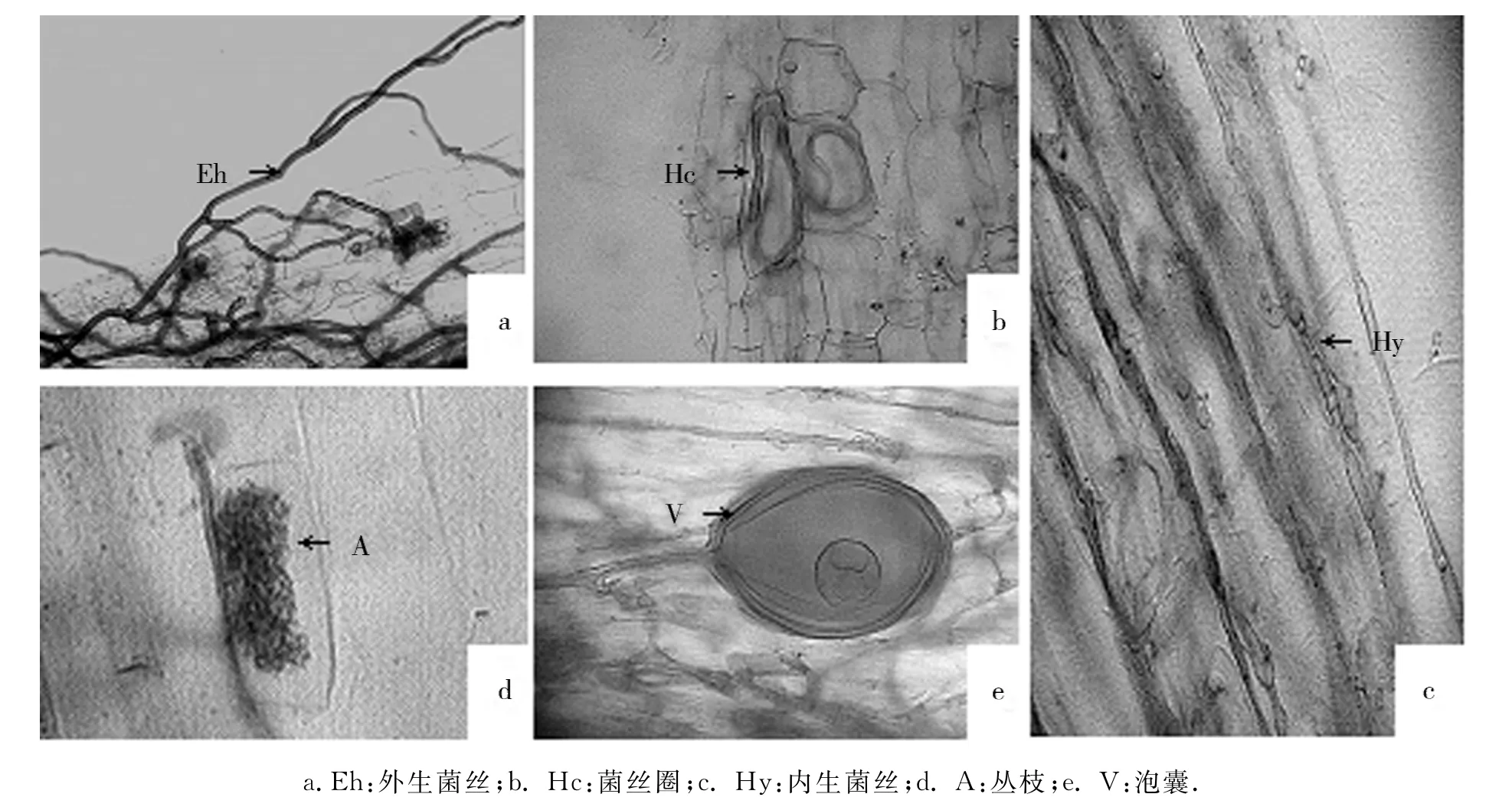
图1 菌根形态结构(×400)Fig.1 Mycorrhizal structure(×400)
2.2 AM真菌时空分布
由表1和表2可知,2010年7-12月,孢子密度随时间呈升-降趋势,最高值出现在9月,为59.02g-1,孢子密度随土层加深而递减;外生菌丝定殖率随时间而下降,随土层变化不显著,最高定殖率为82.33%;泡囊定殖率随时间而上升,随土层递减,最高为33.33%;丛枝定殖率较低,最高值小于3%,无明显时空变化规律;内生菌丝和总定殖率随时间呈升-降趋势,最高值出现在8月,随土层变化不显著.
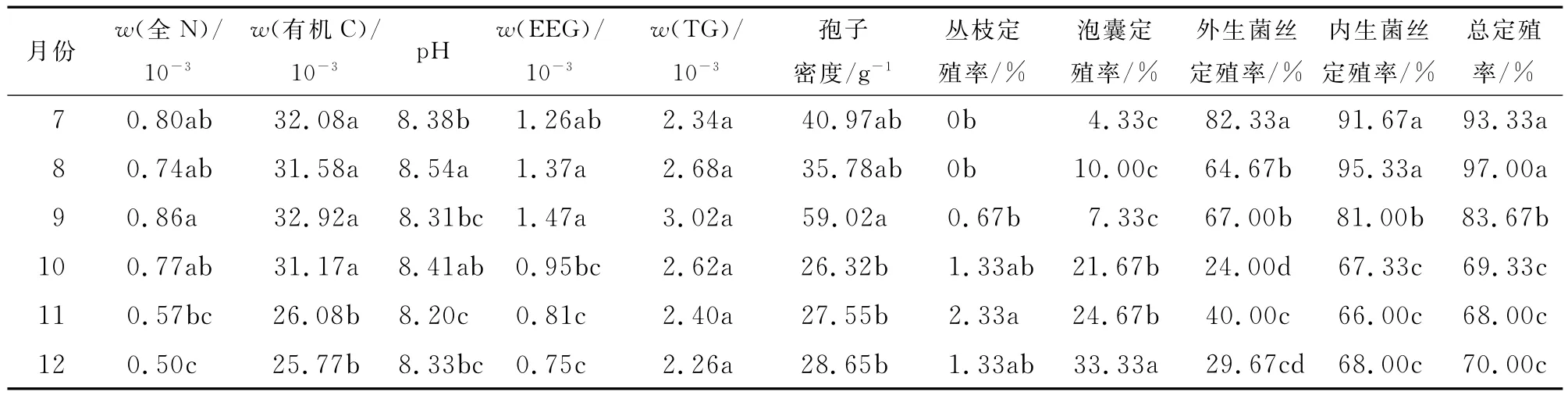
表1 不同月份间AM真菌与土壤因子方差分析Tab.1 Multivariate analysis of variance for AM fungi and soil factors in the rhizosphere of host plant in different months
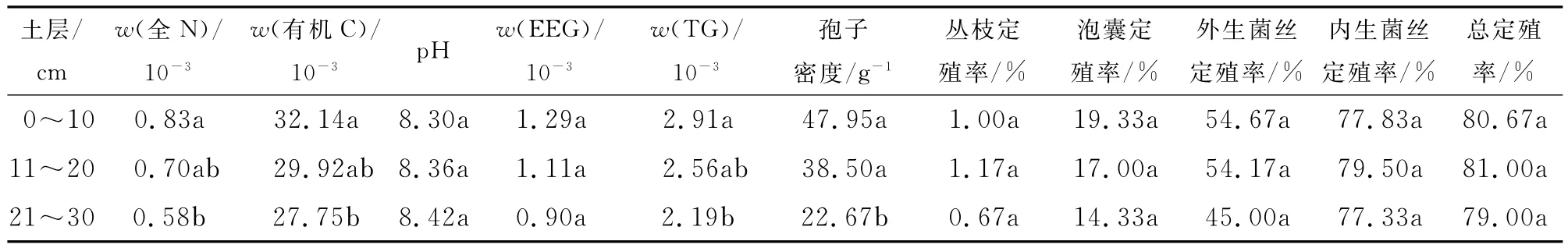
表2 不同土层间AM真菌与土壤因子方差分析Tab.2 Multivariate analysis of variance for AM fungi and soil factors in the rhizosphere of host plant in different soil layers
2.3 AM真菌和球囊霉素相关性分析
由表1,表2可知,总球囊霉素和易提取球囊霉素随时间呈升-降趋势,最高值出现在9月;总球囊霉素和易提取球囊霉素随土层加深而递减.相关性分析表明,总球囊霉素与孢子密度极显著正相关.易提取球囊霉素与孢子密度、外生菌丝、内生菌丝和总定殖率极显著正相关,与丛枝定殖率显著负相关,与泡囊定殖率极显著负相关(表3).说明AM真菌直接影响着土壤球囊霉素的含量.

表3 AM真菌和球囊霉素相关性分析Tab.3 Correlation analysis between glomalin and AM fungi
2.4 球囊霉素与土壤因子间的关系
相关性分析表明,易提取球囊霉素和总球囊霉素与土壤全N和有机C极显著正相关;易提取球囊霉素和总球囊霉素与pH值之间无显著相关性(表4).
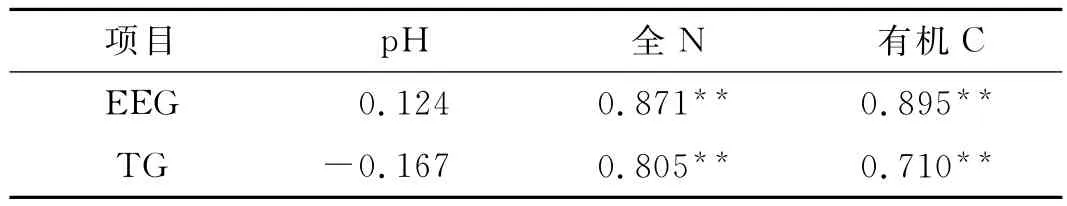
表4 球囊霉素与土壤因子的相关性Tab.4 Correlation between glomalin and soil factors
由图2可知,总球囊霉素在有机C中的质量分数(wC(TG)),0~10cm和11~20cm土层随时间而上升,21~30cm土层随时间无显著变化,随土层下降;总球囊霉素与全N质量比,随时间而上升,土层间无显著差异.易提取球囊霉素在有机C中的质量分数(wC(EEG)),随时间和土层而下降;易提取球囊霉素与全N质量比,随时间而下降,土层间差异不显著.
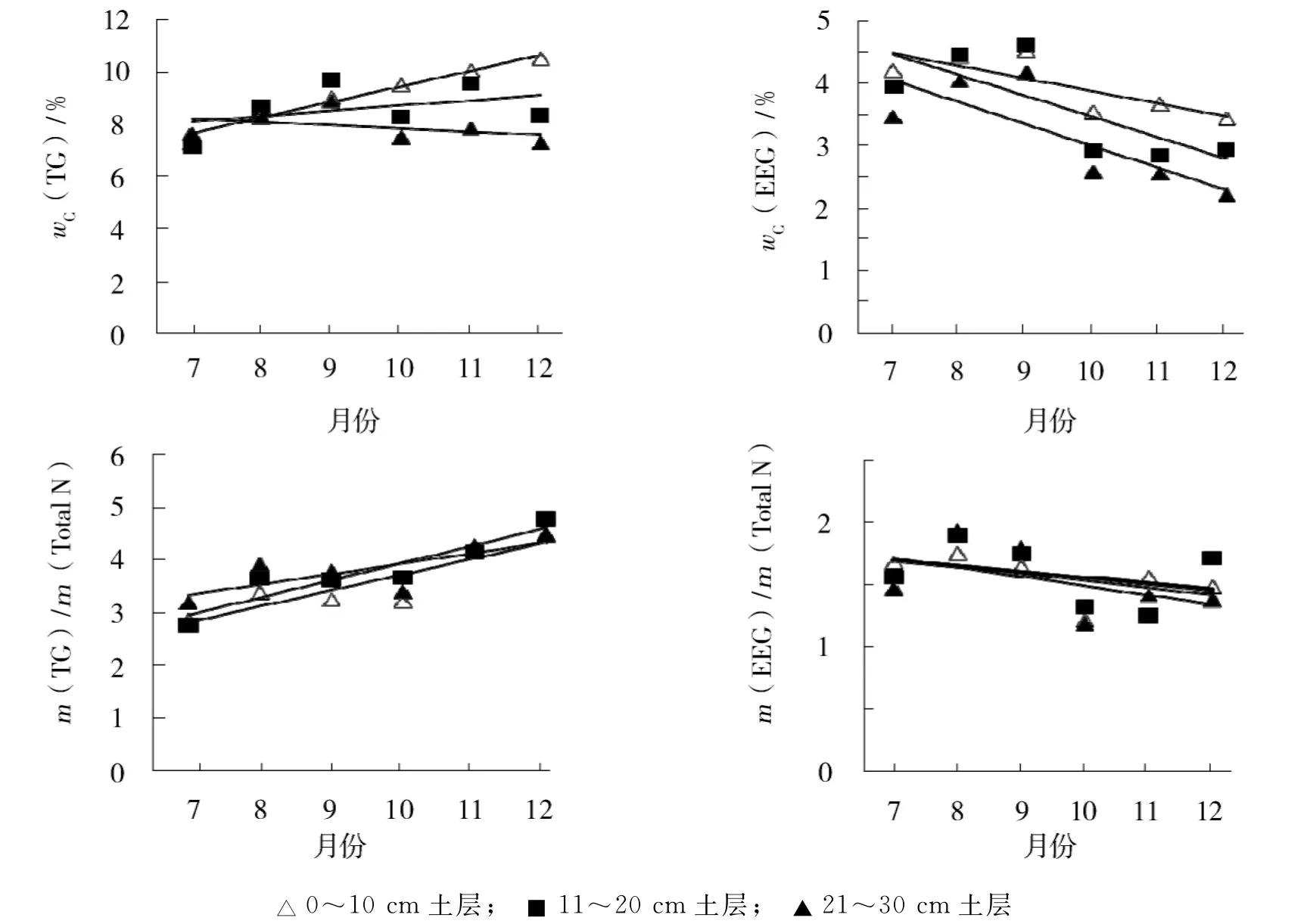
图2 球囊霉素和土壤有机C、全N的比例关系Fig.2 Percentage of glomalin and soil C,N
3 讨论与结论
3.1 金银花根围AM真菌共生关系及时空分布
金银花根围孢子密度最高可达59.02g-1,总定殖率最高达97%,表明金银花能与AM真菌形成良好共生关系.金银花根系发达,毛细根多且再生能力强,这为AM真菌提供了大量初期侵染位置.AM真菌分布和定殖具有明显时空变化规律,泡囊定殖率随时间推移而增高,这是由于泡囊在植物体内存活时间较长,新泡囊的产生伴随着老泡囊的存在[17].外生菌丝定殖率随时间推移而降低,随土层无显著变化.由于夏季植物生长代谢旺盛,吸收传递营养物质和代谢产物增多,传递到根部的营养增多,加强了AM真菌外生菌丝生长,外生菌丝增多又为吸收传递服务,这种互惠互利的模式,使得双方获益;到了秋末冬初,宿主植物生长代谢减慢,外生菌丝不再活跃,不断被降解,造成外生菌丝定殖率随时间显著降低.
3.2 AM真菌和球囊霉素的关系
球囊霉素是AM真菌分泌产生的一类含金属离子的糖蛋白.本实验中,易提取球囊霉素与孢子密度、外生菌丝定殖率、内生菌丝定殖率及总定殖率极显著正相关,总球囊霉素与孢子密度极显著正相关.可以推知易提取球囊霉素与AM真菌有更直接的相关性,即易提取球囊霉素一定程度上反映了AM真菌的定殖情况.球囊霉素存在于AM真菌菌丝体和孢子壁中,随AM真菌菌丝和孢子降解进入土壤[18].本实验中,球囊霉素和孢子密度最高值均出现在9月,而总定殖率和内生菌丝定殖率最高值均出现在8月,外生菌丝定殖率最高值出现在7月.之所以出现这样的规律:一是,随着季节变换,菌丝降解,菌丝体中的球囊霉素进入土壤,土壤球囊霉素含量提高;二是,孢子密度在9月达到最高值,由于孢子壁中含有球囊霉素,土壤中孢子含量变化直接影响了球囊霉素含量.球囊霉素的性质稳定,较难降解,使其在土壤中停留时间较长,能在土壤中积累,从而起到改善土壤结构,使土壤朝着适合植物生长的方向变化.AM真菌与球囊霉素之间深刻的联系,赋予了AM真菌改良土壤的生态学功能,提高了AM真菌在生态系统中的地位.
3.3 球囊霉素和土壤碳氮含量的关系
土壤球囊霉素是土壤有机C,N的一个重要来源[19],其黏附力有利于土壤结构稳定,被认为是AM真菌对植物生长环境的调整与适应,是微生物活动的一种积极应答机制.研究表明,丛枝菌根在碳固持中起重要作用[11],球囊霉素分解极为缓慢,在土壤中能够长期累积,成土时间越长,土壤球囊霉素含量越高[20].本实验中,总球囊霉素和易提取球囊霉素随时间呈升-降趋势,最高值出现在9月,球囊霉素含量并未呈现不断上升趋势,但总球囊霉素与土壤有机C和全N比值呈上升趋势,体现了球囊霉素的积累效应.球囊霉素变化为2.26~3.02g/kg,在有机C中的质量分数为7%~10.5%,低于贺学礼[9]等对毛乌素沙地22.6%~35.2%的研究结果,可能由于本实验土壤为肥沃壤土,腐殖质含量显著高于贫瘠沙土的缘故.唐宏亮[8]等研究结果显示,农田土壤中球囊霉素平均为2.39g/kg,在有机C中的质量分数为20%.Lovelock等[6]在调查热带低地雨林时发现在0~10cm土层球囊霉素平均为6.56g/kg.说明不同生态系统和宿主植物球囊霉素含量差异较大,除样地环境、土壤质地外,耕作方式和宿主植物也影响着球囊霉素在土壤有机C中的质量分数.
金银花能与AM真菌形成良好共生关系,AM真菌分泌的球囊霉素是土壤N和有机C的一个重要和稳定的来源,球囊霉素的积累效应对土壤质量提升起到积极作用.因此,在金银花种植中推行菌根化栽培技术,不仅能够促进植物生长发育,而且对于提高土壤质量,促进土壤生态系统良性循环有重要作用.
[1]刘润进,李晓林.丛枝菌根及其应用[M].北京:科学出版社,2000.
[2]盖京苹,冯固,李晓林.接种丛枝菌根真菌对甘薯生长的影响研究[J].中国生态农业学报,2004,12(1):111-113.
[3]贺学礼,李君,高爱霞,等.不同宿主植物对丹参根围土著AM真菌生长发育的影响[J].河北大学学报:自然科学版,2009,29(5):533-537.
[4]郭辉娟,贺学礼.水分胁迫下AM真菌对沙打旺生长和抗旱性的影响[J].生态学报,2010,30(21):5933-5940.
[5]黄艺,王东伟,蔡佳亮,等.球囊霉素相关土壤蛋白根际环境功能研究进展[J].植物生态学报,2011,35(2):232-236.
[6]LOVELOCK C E,WRIGHT S F,CLARK D A,et al.Soil stocks of glomalin produced by arbuscular mycorrhizal fungi across a tropical rain forest landscape[J].Journal of Ecology,2004,92(2):278-287.
[7]陈颖,贺学礼,山宝琴,等.荒漠油蒿根围AM真菌与球囊霉素的时空分布[J].生态学报,2009,29(11):6010-6016.
[8]唐宏亮,刘龙,王莉,等.土地利用方式对球囊霉素土层分布的影响[J].中国生态农业学报,2009,17(6):1137-1142.
[9]贺学礼,白春明,赵丽莉,等.毛乌素沙地沙打旺根围AM真菌的空间分布[J].应用生态学报,2008,19(12):2711-2716.
[10]曹栋贤,贺学礼,赵金莉.道地药材白芷根际AM真菌的生态学[J].河北大学学报:自然科学版,2007,27(5):525-529.
[11]石伟琦,夏运生,刘晓蕾.丛枝菌根在草原生态系统碳固持中的重要作用[J].生态环境,2008,17(2):846-850.
[12]PHILLIPS J M,HAYMAN D S.Improved procedures for clearing roots and staining parasitic and vesicular arbuscular mycorrhizal fungi for rapid assessment of infection[J].Transactions of the British Mycological Society,1970,55(1):158-161.
[13]IANSON D C,ALLEN M F.The effects of soil texture on extracion of vesicular arbuscular mycorrhizal spores from arid soils[J].Mycologia,1986,78(2):164-168.
[14]张世熔,孙波,赵其国,等.南方丘陵区不同尺度下土壤氮素含量的分布特征[J].土壤学报,2007,44(5):885-892.
[15]张文河,穆桂金.烧失法测定有机质和碳酸盐的精度控制[J].干旱区地理,2007,30(3):455-459.
[16]WRIGHT S F,UPADHYAYA A.Extraction of an abundant and unusual protein from soil and comparison with hyphal protein of arbuscular mycorrhizal fungi[J].Soil Science,1996,161(9):575-586.
[17]贺学礼,侯晓飞.荒漠植物油蒿根围AM真菌的时空分布[J].植物生态学报,2008,32(6):1373-1377.
[18]DRIVER J D,HOLBEN W E,RILLIG M C.Characterization of glomalin as a hyphal wall component of arbuscular mycorrhizal fungi[J].Soil Biology and Biochemistry,2005,37(1):101-106.
[19]RILLIG M C,ALLEN M F.What is the role of arbuscular mycorrhizal fungi in plant-to-ecosystem responses to Elevated CO2[J].Mycorrhiza,1999,9(1):1-8.
[20]田慧,刘晓蕾,盖京苹,等.球囊霉素及其作用研究进展[J].土壤通报,2009,40(5):1215-1219.
AM Fungal Distribution and the Relationship With Soil Carbon and Nitrogen in the Rhizosphere ofLonicerajaponica
ZHANG Xiang-he,HE Xue-li,WANG Lei
(College of Life Sciences,Hebei University,Baoding 071002,China)
The purpose of the experiment is to take full advantage of AM fungi resources to promote Chinese herbal medicine growth.The temporal and spatial distribution of AM fungi and the relationship with soil carbon and soil nitrogen were investigated in rhizosphere ofLonicerajaponicain Anguo city of Hebei province.Soil samples were collected monthly between July 2010and December 2010in the rhizosphere ofL.japonica.The results showed that the symbiotic relationship was formed between AM fungi andL.japonica.Maximum spore density and colonization was 59.02g-1and 97%,respectively.Spore density and total colonization first increased and then decreased with sampling time.Spore density decreased with soil deepened,and total colonization almost had no difference.The total extractable glomalin(TG)was positively correlated with spore density.The easy extracted glomalin(EEG)was positively correlated with spore density,hyphal and total colonization,and it was negatively correlated with vesicular colonization.Glomalin was positively correlated with soil organic C and total N.Glomalin was an important source of soil organic C and total N,and soil quality was improved by the cumulative effect of glomalin.
AM fungi;glomalin;temporal and spatial distribution;soil carbon and soil nitrogen;Lonicerajaponica
Q 948.12
A
1000-1565(2011)05-0522-06
2011-05-16
河北省自然科学基金资助项目(C2010000273)
张翔鹤(1987-),女,河北邢台人,河北大学在读硕士研究生,主要从事药用植物及菌根生物技术研究.
贺学礼(1963-),男,陕西蒲城人,河北大学教授,博士,主要从事药用植物及菌根生物技术研究.
E-mail:xuelh1256@yahoo.com.cn
赵藏赏)

