蜂胶软胶囊的体外溶出度测定
王灵波,蒋旭凯
(1.浙江省慈溪市第二人民医院药剂科,315315;2.湖州师范学院生命科学院,313000)
蜂胶是蜜蜂从长胶源植物的树芽、树皮等部位采集的树脂,再混以蜜蜂舌腺和蜡腺等腺体的分泌物,经蜜蜂反复代谢合成的一种胶状物质。其功效主要成分是黄酮类化合物,研究显示其具有抗菌消炎、抗病毒、抗肿瘤、抗氧化[1-4]等多种功效,现已成为各国科学研究的热点。蜂胶软胶囊是采用优质提纯蜂胶加工溶解后,以适当比例加入辅料中制成的软胶囊。查阅相关资料发现,目前关于蜂胶软胶囊的溶出度测定研究报道较少。笔者以蜂胶黄酮溶出度为评价指标,研究蜂胶软胶囊的体外溶出度。
1 仪器与试剂
1.1 仪器 ZRS-8型智能溶出仪(天津大学无线电厂),752型紫外可见分光光度计(上海光谱仪器有限公司),KQ-100B型超声波清洗器(昆山超声仪器有限公司),BS124S型电子天平 (赛多利斯科学仪器有限公司),数显鼓风干燥箱(上海博讯实验有限公司医疗设备厂)。
1.2 样品和试剂 纯蜂胶(广州禾杰蜂业有限公司),蜂胶软胶囊(广州禾杰蜂业有限公司,规格:每粒0.5 g,批号:091201,091202,091203),盐酸(浙江衢州巨化集团),芦丁对照品(含量≥99%,中国药品生物制品检定所,批号:100080-200306),聚乙二醇400(上海市南群化工有限公司),丙三醇(北京市化工技术有限公司)。所用辅料为药用规格,所用试剂为分析纯。
2 方法与结果
2.1 溶出介质的选择[5]蜂胶软胶囊标示含量每粒0.5 g,含蜂胶总黄酮含量为30.13 mg。为模拟胃液酸度,选择0.1 mol·L-1盐酸(9→1 000 mL)为蜂胶软胶囊溶出度测定介质,可满足溶出条件。
2.2 线性关系考察
2.2.1 检测波长的选择 分别称取芦丁对照品和纯蜂胶适量,以0.1 mol·L-1盐酸为溶剂,超声处理溶解,用紫外分光光度计在200~400 nm范围内扫描,结果见图1和图2。从紫外光谱图所见,芦丁和纯蜂胶吸收图谱基本一致,纯蜂胶中除黄酮外的其他物质对其吸光度的影响可忽略不计。在265 nm和(372±5)nm处都有特征吸收峰,265 nm处吸光度最大,故选取265 nm为测定波长。
2.2.2 标准曲线建立[6-7]精密称取105℃干燥至恒质量的芦丁对照品0.100 2 g,加0.1 mol·L-1盐酸溶液,在50~60℃超声(功率250 W,频率20 kHz)30 min使其溶解并放冷至室温,并定容至100 mL量瓶中,吸取5.0 mL置于500 mL量瓶中,加0.1 mol·L-1盐酸溶液,充分振荡均匀,稀释至刻度,此时芦丁浓度10μg·mL-1。分别精密吸取该溶液 1.0,2.0,4.0,6.0,7.0,8.0 mL,置 于 10 mL 比 色 管 中,加0.1 mol·L-1盐酸溶液至10 mL,制成芦丁浓度为1.0,2.0,4.0,6.0,7.0,8.0 μg·mL-1溶液,以 0.1 mol·L-1盐酸溶液作参比液,在265 nm处测定吸光度值,以吸光度(A)对芦丁浓度(C)作直线回归,得线性回归方程:A=0.093 1C-0.058 8,r=0.999 5,表明芦丁在1.0~8.0μg·mL-1浓度范围内A和浓度呈良好的线性关系。
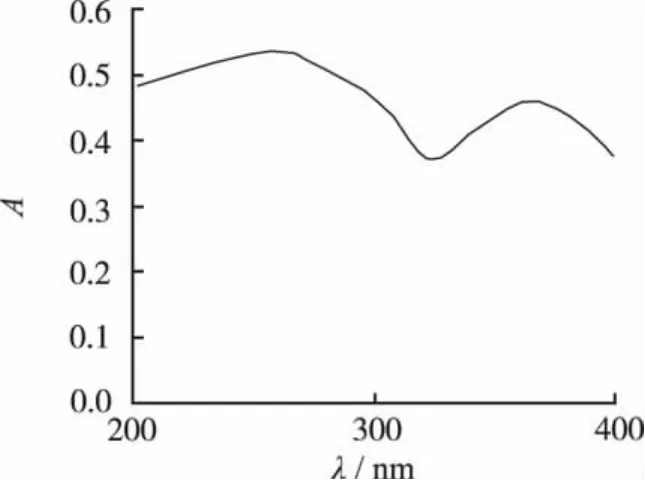
图1 芦丁紫外吸收光谱Fig.1 Ultraviolet absorption spectrum of rutoside
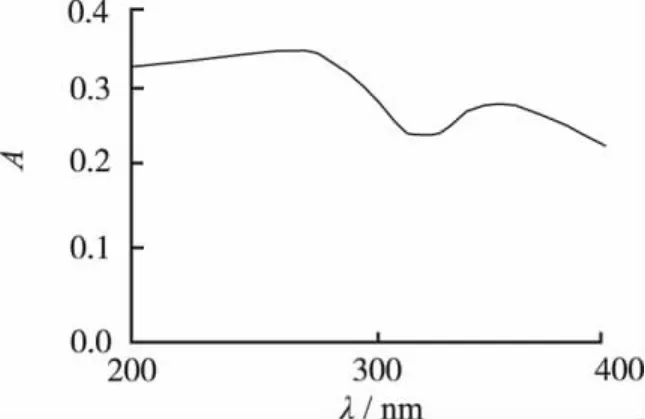
图2 纯蜂胶紫外吸收光谱Fig.2 Ultraviolet absorption spectrun of propolis
2.3.4 精密度实验 取线性关系下配制的4.0,6.0,8.0μg·mL-13种样品溶液,测定上述3种浓度溶液吸光度各6次。RSD=0.54%(n=18),精密度符合规定。
2.3.5 加样回收率实验[8]精密称取同一批软胶囊内容物(不含空胶囊黄酮含量81.43 mg·g-1)共6份,各加入一定量对照品溶液(4μg·mL-1),依法测定。平均加样回收率为99.35%,RSD=1.51%(n=6)。
2.4 软胶囊溶出影响因素的考察
2.4.1 溶出方法选择 分别按溶出度测定法(《中华人民共和国药典》2010版附录XC[9]-转篮法和桨法)测定,取样品1粒,以0.1 mol·L-1盐酸溶液1 000 mL为介质,转速为100 r·min-1,温度(37.0±0.5)℃,分于10,20,30,45,60 min 时取样 5 mL(随即补充同温空白介质5 mL),经孔径0.45μm微孔滤膜过滤,弃去初滤液,取续滤液,作为供试品溶液,精密量取续滤液2.00 mL,置10 mL比色管中。加0.1 mol·L-1盐酸至刻度,用紫外分光光度计测其吸光度值,计算累积溶出百分率。结果表明,当采用转篮法100 r·min-1测定本品溶出度,45 min取样测定,溶出度达86.73%,且溶出均匀,而采用桨法100 r·min-1时,溶出度只有80.05%,且囊壳溶解后易附着于杯底,阻止药物的溶出,溶出均一性差,故选择转篮法作为样品溶出度的测定方法。
2.4.2 转速的选择 取同批次样品3粒,投入3个溶出杯中,分别以 50,75,100 r·min-1的转速,45 min 时按“2.4.1”取样,测定溶出度,当转速为 50,75和100 r·min-1时,45 min溶出度分别75.27%,83.52%,85.86%。为使样品充分溶出,采用转速100 r·min-1,该转速也是《中华人民共和国药典》2010年版(二部)收载的有关胶囊剂溶出度测定所选用的常用转速。
2.5 溶出度测定
2.5.1 溶出均一性 分别将同批6粒蜂胶软胶囊置于6个溶出杯中,转速为100 r·min-1,参照“2.4.1”分别于 10,20,30,45,60,70 min 取样测定,按回归方程计算累计溶出量。结果见表1,结果表明,样品溶出均一性良好。
以时间(t,min)为横坐标,平均累积溶出百分率(%)为纵坐标作图,见图3。
2.5.2 溶出参数提取 由威布尔(Weibull)分布函数可推导出 lnln{1/[1-F(t)]}=m ln(t- τ)-ln t0。借助Excle[10],根据同批次不同时间平均累积溶出量求得Y=1.087 3X-3.408 4,lnln{1/[1-F(t)]}=1.087 3ln t-ln t0,得出溶出参数 T50=16.41,Td=22.
2.3 方法学考察
2.3.1 空白干扰实验 取样品空胶囊和辅料(聚乙二醇400和丙三醇)分别制成溶液,测定A值,结果显示,空胶囊和辅料对蜂胶软胶囊A值测定基本无影响。
2.3.2 重复性实验 取浓度为6.0μg·mL-1的样品溶液6份,平行测定其A值,平均A值为0.502,RSD=0.33%,重复性良好。
2.3.3 稳定性实验 取浓度为8.0μg·mL-1的样品溶液,分别于 0.5,1.0,1.5,2.0,2.5h 测定其 A,结果平均A为0.679,RSD=0.19%,表明样溶液在2.5 h内稳定。98,T80=35.6,m=1.087 3。

表1 样品累计溶出量Tab.1 Cumulative dissolution of the samples %
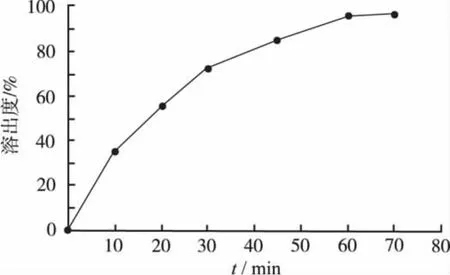
图3 蜂胶软胶囊溶出曲线Fig.3 Dissolution curves of propolis soft capsules
2.5.3 不同批次软胶囊溶出度测定 选取3批蜂胶胶囊,每批6粒,依本文溶出度测定法测定其45 min时溶出量,结果见表2。
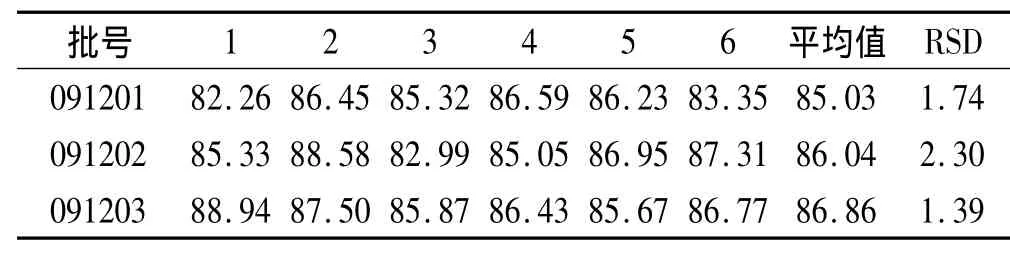
表2 3批次样品45 min时溶出度Tab.2 Dissolution of the three batchs of samp les at 45 m in %
3 讨论
由表2可知,3批蜂胶胶囊在45 min的溶出量均大于标示含量的80%,符合《中华人民共和国药典》2010年版二部的要求,表明本溶出度实验及测定条件稳定可行。溶出方法选用转篮法,以0.1 mol·L-1盐酸溶液(9→1 000 mL)为溶出介质,体积1 000 mL,转速100 r·min-1,恒温(37.0±0.5)℃,采用紫外分光光度法测定吸光度,测定波长265 nm,45 min时取样,测定吸光度,计算溶出度。该方法可靠、准确、快速,可作为蜂胶软胶囊的溶出度的测定方法,能为考察和控制蜂胶软胶囊的质量提供参考,若样品45 min时的药物溶出标示量>80%为合格。
本文中蜂胶软胶囊的溶出速率不是很快,45 min溶出度未达到90%,可能是由于软胶囊制剂的溶出度测定不同于一般的片剂和硬胶囊,本品内容物为油状混悬液,囊壳破裂后遇水溶性的溶出介质,油相有时因不能较快分散而易结成块状物,影响主药的溶出。且囊壳中含明胶,长期放置易粘连老化,溶出实验时易堵塞篮孔,对药物的溶出有阻碍作用。
[1] 周立东,郭伽,郑莲香,等.蜂胶化学成分研究进展[J].世界科学技术-中医药现代化,2006,8(1):61-62.
[2] 马佳,王筱敏.蜂胶总黄酮对病毒性心肌炎小鼠心肌凋亡的影响[J].医药导报,2009,28(5):577-580.
[3] 刘海鹏,王钦茂.蜂胶治疗口腔疾病的药理作用和临床应用现状[J].中国临床药理学与治疗学,2002,7(4):381-384.
[4] 杨更森,侯晓薇,郭兰英,等.蜂胶口胶防龋作用初步研究[J].中国临床药理学与治疗学,1999,4(1):40-42.
[5] 吕长淮.我国药物溶出度检查方法的现状与展望[J].安徽医药,2006,10(7):537.
[6] 王志良,王芳.牙周康胶囊溶出度实验研究[J].中国药事,2003,17(11):69-70.
[7] 孙瑜,张文.阿托伐他汀钙软胶囊溶出度的测定[J].齐鲁药事,2006,25(12):737-739.
[8] 陈丽华,徐德生,冯怡,等.甘草总黄酮微丸溶出度的考察[J].中国医院药学杂志,2008,28(20):1761.
[9] 国家药典委员会.中华人民共和国药典(二部)[M].北京:中国医药科技出版社,2010:附录XC.
[10] 方崇波.运用Excle程序快速计算片剂的溶出度参数[J].制剂技术,2006,15(18):18-20.

